 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Химические свойства. Классификация и номенклатура аминокислотКлассификация и номенклатура аминокислот Общая формула всех аминокислот: Исключение:
В зависимости от кислотно-основных свойств выделяют:
НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ
Валин Лейцин Изолейцин Лизин Треонин Триптофан Метионин Фенилаланин
Полунезаменимые: Частичнозаменимые:
Стереоизомерия α-аминокислот Все аминокислоты (кроме глицина) имеют асимметрический атом углерода и существуют в виде двух энантиомеров:
Способы получения аминокислот 1. Гидролиз белков (invitro). 2. Аминирование α–галогенкарбоновых кислот:
3. Синтез Штреккера:
4. Восстановление производных α-кетокислот (восстановительное аминирование):
Химические свойства 1. Кислотность-основность
неионизированная форма цвиттер-ион
Кислотно-основные свойства аминокислот количественно характеризуют значениями рКа кислотной группы (в том числе и боковых радикалов) и рI – изоэлектрической точкой (см. учебник Н.А. Тюкавкиной «Биоорганическая химия»). Изоэлектрическая точка соответствует значению рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионной и анионной форм равны. В изоэлектрической точке суммарный заряд молекулы равен 0.
Три группы аминокислот дают разные равновесные системы: - нейтральные – три формы
катион цвиттер-ион анион
- кислые (анионогенные) содержат в радикале дополнительно карбоксильную группу и образуют равновесные системы из 4-х форм:
- основные (катионогенные) содержат в радикале дополнительно NН2- группу и образуют равновесные системы из 4-х форм:
Аминокислоты – амфолиты:
2. Нуклеофильные и электрофильные свойства аминокислот.
а) Реакции по аминогруппе:
б) Реакции по карбоксильной группе
В организме синтез биогенных аминов протекает поддействием пиридоксальфосфата.
3. Реакции по другим группам: - гидроксилирования – введение в боковой радикал аминокислоты гидроксильной группы.
- окисления SH-связей
- карбоксилирования – введение карбоксильной группы
- иодирования – введение атомов иода с образованием иодтиронинов – гормонов щитовидной железы:
4. Качественные реакции аминокислот. а) Реакция с нингидрином:
б) Биуретовая реакция
в) Ксантопротеиновая реакция (на Phe, Tyr, Trp, His):
г) реакция на серусодержащие аминокислоты:
4. Образование пептидов:
Валиллейцилтриптофан (Val-Leu-Trp)
Синтез пептидов осуществляют в несколько стадий: - защита NH2-группы в первой аминокислоте алкилированием - защита СООН-группы во второй аминокислоте этерификацией - активация СООН-группы в первой фосфорилированием - синтез пептида - снятие защитных групп
Иначе возможно образование смесей пептидов. Например:
Из 3 разных аминокислот получается трипептидов из 4 разных аминокислот – тетрапептидов из 20 разных аминокислот – полипептидов
Дата добавления: 2015-12-15 | Просмотры: 602 | Нарушение авторских прав |



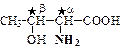

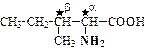









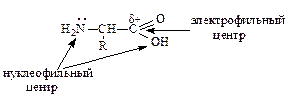




 ДОФА Дофамин Норадреналин Адреналин
ДОФА Дофамин Норадреналин Адреналин 5-Гидрокситриптофан Серотонин
5-Гидрокситриптофан Серотонин Гистидин Гистамин
Гистидин Гистамин
 g-аминомасляная кислота (ГАМК)(нейромедиатор, транквилизатор)
g-аминомасляная кислота (ГАМК)(нейромедиатор, транквилизатор)






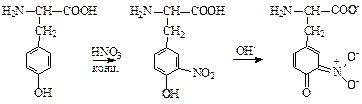
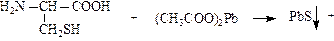


 Ala + Val Ala-Ala + Val-Val + Ala-Val + Val-Ala
Ala + Val Ala-Ala + Val-Val + Ala-Val + Val-Ala