|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
МОДУЛЬ 1. Цитология как наукаВведение
При подготовке специалистов-биологов среди общих биологических дисциплин важное место занимает цитология - наука о строении и функциях клетки. Цитология - наука экспериментальная, поэтому в учебном плане подготовки биологов, кроме лекционного времени, по данной дисциплине отводится время на лабораторные занятия. В задачи лабораторного практикума по цитологии с основами гистологии входят: проверка и закрепление теоретических положений, излагаемых в лекционных курсах и учебниках; ознакомление со строением клеток и тканей животных и растений; привитие навыков самостоятельной и научно-исследовательской работы (постановка цели опыта, проведение эксперимента, ведение первичной научной документации, обсуждение результатов опытов, оформление выводов). Материал курса разделен в лабораторном практикуме на 3 модуля. В каждый из модулей входит от 1 до 5 работ. Каждая работа соответствует одному лабораторному занятию продолжительностью 2 (реже 4) академических часа. В первой половине занятия проводится контроль знаний студентами теоретического материала, для чего используются контрольные вопросы по теме. Вторая часть занятия посвящена изучению и зарисовке микроскопических препаратов под руководством преподавателя. Общая оценка успеваемости студента слагается из его знаний теоретического курса и умения использовать их при микроскопировании цитологических и гистологических препаратов. К лабораторному практикуму студент допускается только после инструктажа по технике безопасности. Основные положения техники безопасности изложены в инструкциях, которые должны находиться на видном месте в лаборатории. Специфические моменты отмечены в описании отдельных работ. МОДУЛЬ 1. Цитология как наука РАБОТА № 1 1.1. Правила по технике безопасности
1. Допускаются к работе в лаборатории студенты, прошедшие инструктаж по технике безопасности. 2. Нужно работать в белом халате из хлопчатобумажной ткани и иметь личное полотенце. 3. На каждом занятии назначается дежурный, который отвечает за чистоту и порядок. 4. За каждым студентом закрепляется рабочее место, которое необходимо содержать в чистоте и порядке. 5. Запрещается держать в лаборатории пищевые продукты, принимать пищу, пить воду из химической посуды. 6. Перед работой следует проверить исправность нагревательных приборов, вентиляции, защитных средств. Ремонт оборудования может производить только инженер. 7. Запрещается работать с разбитой посудой, пользоваться реактивами из банок без этикеток. 8. Необходимо переливать приготовленные растворы в склянки с надписями. Нельзя оставлять без присмотра включенные приборы и электрооборудование. 9. Работать с летучими и ядовитыми веществами можно только под тягой. 10. Использовать для отмеривания кислот, щелочей и ядовитых реактивов нужно цилиндры либо пипетки с резиновой грушей или ватным тампоном. 11. При работе с едкими веществами следует надевать предохранительные очки, резиновые перчатки и фартуки. 12. Сливать кислые и щелочные реактивы в раковину можно только после их нейтрализации. 13. Для нагревания горючих и летучих реактивов нужно пользоваться водяными банями. Нельзя их нагревать на открытом огне или вблизи пламени. 14. При внезапном отключении тока необходимо выключить все электроприборы. 15. Тушить огонь при загорании легко воспламеняющихся жидкостей нужно углекислотным огнетушителем, песком или кошмой. 16. При загорании проводов следует немедленно их обесточить, тушить огонь углекислотным огнетушителем или асбестовым покрывалом. 17. Работать с ртутными термометрами нужно очень осторожно. 18. После окончания работы привести в порядок рабочее место (убрать со стола реактивы и оборудование, из ящиков стола – мусор, стол вымыть, протереть сухой тряпкой) и сдать дежурному. 1.2. Правила оформления работ
Каждый студент ведет рабочую тетрадь, оформление которой должно отвечать следующим требованиям: - на титульном листе указывают предмет, по которому делаются записи, кем они делаются (курс, группа, подгруппа, фамилия, имя, отчество); - каждое занятие отмечают порядковым номером, указывают его дату; - при оформлении работы указывают её заглавие, описывают цель, указывают объект изучения; - результаты фиксируют в виде рисунков с обязательными подписями к ним и описывают текстом, или оформляют в виде таблиц (характер оформления работы обычно указан в методическом пособии); - рисунки должен быть размером с четверть тетрадного листа, иметь номер, название, выноски и подписи. - в конце каждой работы делают вывод или заключение, которые обсуждаются при подведении итогов занятия. Зарисовывание препаратов имеет исключительно важное значение в процессе его изучения. Процесс зарисовки учит студента «читать» препарат, понимать своеобразие и общность клеток и тканей, глубже осмысливать их морфологические, генетические и функциональные особенности. Все записи необходимо делать в лаборатории. Для проверки академической активности и качества работы студента дневник периодически проверяет преподаватель, дает ему оценку. 1.3. Правила работы с микроскопом
Микроскоп необходимо содержать в чистоте и предохранять от повреждений. В нерабочем состоянии микроскоп должен быть накрыт чехлом. Особое внимание следует обращать на чистоту объективов и других оптических деталей. ВНИМАНИЕ! Нельзя касаться пальцами поверхностей линз. Для предохранения оптических деталей визуальной насадки от пыли следует оставлять окуляры в тубусах или надевать на них колпачки. Оптические поверхности окуляров, объективов и конденсора можно осторожно протирать чистой ватой, навернутой на деревянную палочку и смоченной специальной жидкостью для чистки оптических деталей. При загрязнении внутренних поверхностей линз объектива необходимо объектив отправить для чистки в оптическую мастерскую. ВНИМАНИЕ! Запрещается самим разбирать объективы, окуляры, конденсор. Рассмотрим важнейшие погрешности при работе с микроскопом, чтобы начинающие исследователи не допускали их с самых первых шагов, добиваясь таким образом максимального использования возможностей микроскопа. К таким ошибочным действиям необходимо отнести следующие. Одновременное применение вогнутого зеркала и конденсора, что нарушает принцип освещения препарата. Использование высоко-апертурных конденсоров с NA = 1,2 - 1,4 с низко-апертурными объективами с NA = 0,2 - 0,4 ухудшает качество изображения. Для устранения этой ошибки следует предварительно уменьшить нумерическую апертуру конденсора путем снятия (отвинчивания) его верхней линзы. Произвольное опускание конденсора без учета толщины предметного стекла может привести к появлению артефактов. Регулировка освещенности поля зрения микроскопа при помощи опускания и поднятия конденсора, поскольку это влияет на качество изображения. Произвольное изменение величины отверстия апертурной диафрагмы конденсора с целью регулировки освещенности поля зрения микроскопа. Пренебрежение нейтральными светофильтрами и матовыми стеклами для регулировки освещенности поля зрения микроскопа, что ухудшает восприятие препарата и может оказывать отрицательное влияние на зрение исследователя. Применение толстых предметных стекол (толще 1, 2 мм), что препятствует правильной установке освещения при высокоапертурных объективах, поскольку при этом не удается сфокусировать конденсор на объекте.
Пренебрежение созданием полной иммерсии при работе с объективами, имеющими нумерическую апертуру более 1,2, что не позволяет полностью использовать нумерическую апертуру объектива. 1.4. Меры безопасности при работе с микроскопом
При работе с микроскопом с осветителем следует соблюдать меры безопасности, соответствующие мерам, принимаемым при эксплуатации электроустановок напряжением до 1000 В. ВНИМАНИЕ! Замену лампы в осветителе микроскопа производить только при отключении от электрической сети. Во избежание ожога кожи рук о колбу лампы или контактные пластины патрона замену лампы следует производить через 15-20 мин после ее перегорания. Замену плавкой вставки (предохранителя) в микроскопе следует производить при отключенном от сети микроскопе. После работы на микроскопе с осветителем необходимо отключить его от сети. Не рекомендуется оставлять без присмотра включенный в сеть микроскоп. 1.5. Устройство микроскопа
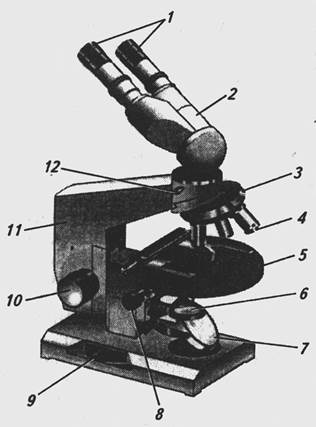
Микроскоп представляет собой оптический прибор, дающий увеличенное изображение мелких объектов и их деталей. Хотя различные марки световых микроскопов имеют конструктивные отличия, в каждом из них существуют оптические и механические узлы. Устройство микроскопа наглядно показано на рис. 1.
Рис 1. Устройство микроскопа с зеркалом: 1- окуляры; 2 – бинокулярная насадка; 3 – револьверное устройство; 4 – объектив; 5 – предметный столик; 6 – конденсор; 7 – зеркало; 8 – рукоятка перемещения кронштейна конденсора; 9 – рукоятка тонкой фокусировки; 10 – рукоятка грубой фокусировки; 11- тубусодержатель; 12 – винт для крепления насадки. Оптическая узел составляют осветительная система (конденсор и зеркало), объективы и окуляры вместе с тубусом, все составные части строго центрированы одна в отношении с другой. Механический узел микроскопа состоит из штатива, на котором крепятся оптические детали, предметного столика и механизмов фокусировки микроскопа. 1.6. Настройка освещения микроскопа 1.6.1. С вынесенным осветителем
В соответствии с принципом Келера при установке освещения для микроскопа типа МБИ-3, а также микроскопов серии Микмед с вынесенным осветителем необходимо руководствоваться следующими правилами. 1. Устанавливают осветитель ОИ-19 (или ОИ-9м) перед микроскопом с помощью соединительной планки, что обеспечивает нормальное расстояние микроскопа от осветителя. Включают его через трансформатор в сеть и, поворачивая корпус, направляют световой поток на плоскоезеркало микроскопа. 2. Поднимают конденсор микроскопа в верхнее положение и полностью закрывают его диафрагму. 3. Уменьшают диаметр отверстия ирисовой диафрагмы осветителя до 1-2 мм. 4. Перемещая патрон лампочки осветителя вдоль оси и, одновременно, поворачивая зеркало микроскопа и корпус осветителя, добиваются получения изображения нити лампочки на закрытой диафрагме конденсора. При этом центр изображения нити лампочки должен находиться в центральной части ирисовой диафрагмы. 5. Открывают отверстие диафрагмы конденсора и осветителя. 6. Уменьшают яркость свечения нити лампочки при помощи реостата. 7. Помещают исследуемый препарат на предметный столик микроскопа, ставят необходимый объектив в рабочее положение и, глядя в окуляры бинокулярной насадки микроскопа, перемещением тубуса фокусируют оптику микроскопа на объект. 8. Почти полностью закрывают диафрагму осветителя и перемещением конденсора добиваются резкого изображения диафрагмы осветителя в поле зрения микроскопа. 9. Поворотом зеркала центрируют изображение диафрагмы осветителя, а затем открывают ее настолько, чтобы изображение диафрагмы было равно (или немного больше) полю зрения микроскопа. 10. Вынимают один окуляр и, глядя в тубус микроскопа, уменьшают диафрагму конденсора до едва заметного появления ее краев на фоне светлого кружка задней линзы объектива. 11. Помещают окуляр на место. В прорези осветителя вставляют синее и матовое стекла. Затем, глядя в микроскоп, при помощи реостата осветителя устанавливают необходимую освещенность препарата. 12. Исследуют препарат.
Примечания. 1. При работе с низкоапертурными объективами малого увеличения (10х и меньше) перед настройкой освещения устанавливают сменный низкоапертурный конденсор или, если это позволяет конструкция конденсора, отделяют (отвинчивают) его верхнюю линзу. 2. Пункт 7 можно выполнить в самом начале при произвольно установленном освещении, а затем внести коррективы в соответствии с принципом Келера. 1.6.2. С встроенным в основание осветителем
Порядок настройки микроскопа со встроенным осветителем. 1. Устанавливают матовое стекло в откидную рамку конденсора. 2. Вводят в ход лучей объектив меньшего увеличения (10х и менее). 3. Вводят в ход лучей матовое стекло и откидную линзу конденсора. 4. Поднимают рукояткой кронштейн с конденсором до упора и полностью раскрывают апертурную диафрагму конденсора. 5. Устанавливают патрон с лампой в шарнир до упора. 6. Устанавливают лампу таким образом, чтобы ее нить располагалась горизонтально. 7. Подключают источник питания к сети и включают лампу. 8. Фокусируют микроскоп на резкое изображение препарата, установленного на предметном столике. 9. Перемещая патрон с лампой за рукоятку вдоль оси и разворачивая его вместе с шарниром в горизонтальной плоскости, добиваются наиболее яркого и равномерного освещения поля зрения микроскопа. 10. При работе с другим объективом повторяют настройку освещения. 11.ВНИМАНИЕ! При работе с объективами с увеличением более 10х откидная линза конденсора должна быть выведена из хода лучей. 1.7. Приготовление постоянных и временных препаратов
Постоянные препараты являются прекрасным демонстрационным материалом и могут храниться долгие годы. На тонких срезах толщиной 10-22 микрона можно наблюдать проникновение пыльцевых трубок, подсчитывать число хромосом, изучать митоз и мейоз, развитие зародыша и так далее. Техника приготовления окрашенных микропрепаратов включает в себя несколько этапов. Объекты претерпевают сложную обработку. 1. Подготовка материала к фиксации. 2. Фиксирование материала водным или спиртовым фиксатором (24 часа и до 12 часов соответственно). 3. Промывка зафиксированного материала. 4. Полное обезвоживание промытого материала. 5. Пропитывание материала растворителями парафина (хлороформом, ксилолом или бензолом). 6. Пропитывание материала парафином до полного испарения хлороформа (или ксилола). 7. Заливка материала в парафин (материал, залитый в парафин можно хранить очень долго). 8. Изготовление блоков из материала, пропитанного парафином. 9.Получение срезов при помощи микротома. 10. Наклейка срезов на предметные стекла. 11. Просушивание препаратов при температуре 40 - 45о С, стекла со срезами можно хранить долго, оберегая их от пыли и высокой температуры. 12. Удаление парафина из срезов ксилолом. 13. Удаление ксилола из срезов спиртом. 14. Удаление спирта из срезов дистиллированной водой. 15. Окрашивание препаратов (иногда протравливание и окрашивание) и дифференцировка. 16. Обезвоживание окрашенных срезов 96%-ным и 100%-ным спиртами. 17. Замещение спирта в срезах на ксилол (одновременно происходит просветление срезов ксилолом). 18. Заключение срезов в канадский бальзам. 19 Просушивание и подчистка, этикетирование препаратов. 20. Изучение препаратов под микроскопом. Также широко распространены в микроскопической технике давленые препараты, для изготовления которых не требуется сложной процедуры обезвоживания, заключения в промежуточную жидкость, в парафин и получения микротомных срезов. Давленые препараты применяют при изучении митоза, кариотипов и при работе с животными объектами. Наиболее часто для приготовления давленых препаратов применяют различные фиксаторы. Зафиксированный материал промывают в 70 %-ном спирте. В нем можно сохранять материал в течение длительного времени, но лучше хранить в холодильнике. При изготовлении давленых препаратов исключительное значение имеют способы мацерации тканей. Обычно для этого используют 45 %-ную уксусную кислоту, 40-45 %-ную пропионовую кислоту, 1 н. соляную кислоту, энзимы. Окрашивают препараты ацетокармином, реактивом Шиффа, нигрозином и др. РАБОТА № 2. 2.1. Важнейшие характеристики микроскопа
Микроскоп для цитологических исследований должен иметь набор из 4-7 высокоапертурных объективов апохроматов, в том числе объективов 90х с нумерической (числовой) апертурой (A)1,3—1,4; набор компенсационных окуляров; апланатический конденсор прямого и косого освещения с Aне менее 1,4; штатив; механизмы фокусировки объективов и перемещения препаратов; бинокулярную насадку для наблюдения в микроскоп обоими глазами, набор светофильтров, а также точную центрировку всех оптических и механических деталей микроскопа. Кроме того, микроскоп должен быть оснащен осветителем, который может быть как вынесенным (ОИ-9м для МБР-3), так и встроенным (у микроскопов МБИ-6, МБИ-11, Микмед-1 вариант 2). Освещение устанавливают в соответствии с принципом Кёлера, который заключается в обеспечении условий для максимального использования апертур оптических компонентов микроскопа, т. е. в создании условий наблюдения, при которых числовые апертуры конденсора и объектива совпадают. Конденсор состоит из 2 или 3 линз и обеспечивает освещение полей на объекте при работе с объективами с увеличением от 3,5 до 100х. Различают несколько типов конденсоров в зависимости от метода наблюдения в микроскопе: конденсор светлого поля, конденсор темного поля, конденсор для наблюдений по методу фазового контраста, конденсор с апертурной диафрагмой для косого освещения и др. Например, конденсор ОИ-14 кроме прямого освещения объекта обеспечивает косое, что позволяет получить более рельефное и контрастное изображение. Зеркало микроскопа имеет две поверхности – плоскую и выгнутую, оно располагается под конденсором и направляет в него свет. Из кондесора пучок света попадает на препарат, находящийся на столике микроскопа, а затем попадает в окуляр. Визуальная насадка микроскопа (тубус), как правило, бинокулярная.Она позволяет устанавливать расстояние между осями окулярных тубусов в соответствии с глазной базой наблюдателя в диапазоне от 54 до 72 мм (на рисунке возможность изменения этого расстояния показана стрелками). В левом окулярном тубусе имеется диоптрийный механизм, который с помощью вращения кольца 2 позволяет компенсировать ошибку наблюдателя от плюс 5 до минус 5 дптр. Окулярные тубусы имеют наклон 45°. Увеличение бинокулярной насадки — 1,5х. В комплект микроскопа может входить монокулярнаянасадка, которая позволяет проводить исследование объектов только одним глазом. В отличие от бинокулярной насадки она имеет увеличение, равное 1х. При использовании такой насадки можно применять полярофильтры для исследования в поляризованном свете. При работе с объективами, рассчитанными на длину тубуса, отличающуюся от стандартной 160 мм, применяется вертикальнаянасадка с прямым выдвижным тубусом. С помощью шкалы на выдвижном тубусе устанавливается механическая длина тубуса, на которую рассчитан объектив. Окуляры нередко состоят из двух линз. Они могут иметь различное увеличение и позволяют проводить наблюдения в полях зрения разного диаметра (табл. 1). Таблица 1. Характеристика некоторых окуляров
Окуляры строят мнимое изображение и увеличивают создаваемое объективами изображение, не выявляя подробностей строения. Маркировка окуляра позволяет определить его увеличение, а в некоторых случаях - диаметр поля зрения. Револьверное устройство обеспечивает установку четырех объективов. Смена объективов производится вращением револьверного устройства за конусную поверхность до фиксированного положения. Объективы выполняют главную функцию: в их системе линз формируется первичное изображение, которое передается в окуляры. Объективы рассчитаны на механическую длину тубуса 160 мм, линейное поле в плоскости изображения 18 мм и толщину покровного стекла 0,17 мм. Большое значение имеет полное или частичное отсутствие в объективе оптических аберраций, которые могут привести к тому, что изображение объекта может быть искаженным вследствие его размытости, искривления, окрашенности. Аберрации оптики микроскопа могут быть разного типа. Сферическая аберрация - изображение точки передается в виде кружка рассеяния. Астигматизм - изображение точки передается в виде кружка рассеяния эллипсоидной формы. Кома - резкость изображения снижается от центра к границе поля зрения. Кривизна поля зрения не позволяет одновременно видеть резко центр и края поля зрения. Дисторсия - нарушения подобия между объектом и его изображением вследствие разного линейного увеличения на краях и в центре поля зрения. Хроматические аберрации - хроматизм увеличения и хроматизм положения. Хроматизм положения - изображения, созданные разными цветами, располагаются на неодинаковом расстоянии от оптической системы. Хроматизм увеличения изображения находятся в одной плоскости, но имеют неодинаковые размеры. Высококачественные объективы-апохроматы изготавливают с высокой нумерической апертурой. В них устранены сферическая и хроматическая аберрации. Объективы-апохроматы применяются в сочетании с компенсационными окулярами. Характеристики некоторых объективов указаны в табл. 2. Каждый объектив характеризуется определенной величиной рабочего расстояния в миллиметрах. При работе с объективами следует соблюдать осторожность, чтобы не повредить линзы. Особенно это важно при работе с объективами с большим увеличением, для которых рабочее расстояние(расстояние между поверхностью покровного стекла и линзой объектива) составляет 0,10—0,12 мм. Фокусирование на объект осуществляют перемещением тубусодержателя. Грубую фокусировку производят вращением рукояток макровинта, расположенных по обеим сторонам тубусодержателя. Диапазон грубой фокусировки микроскопа - 40 мм. Тонкую фокусировку производят с помощью микровинта, выполненного в виде диска с накаткой. Один оборот диска соответствует перемещению тубусодержателя на 0,5 мм, а вращение диска от упора до упора - не менее 2 мм. Перед началом работы необходимо установить рукоятку тонкой фокусировки приблизительно в среднее положение. Таблица 2 Некоторые характеристики объективов
Примечание. * Водная иммерсия. ** Масляная иммерсия Препарат крепят на предметном столике с помощью клемм или держателей. Предметные столики могут быть различной формы, вращаемыми, оснащенными препаратоводителями с координатным перемещением объекта. В последних держатели можно перемещать относительно друг друга (в зависимости от размера предметного стекла) при помощи винтов 2. Осветительные устройства могут быть вынесенными, накладными и встроенными. В случае вынесенного осветителя используется зеркало. Оно имеет две отражающие поверхности: плоскую и вогнутую. Вогнутую поверхность используют при естественном освещении, в отдельных случаях она может служить для повышения освещенности объекта. Накладные осветители ОИ-32М или ОИ-35 вставляют в посадочное гнездо в основании микроскопа. Встроенный в основание микроскопа осветитель включает галогенную лампу, коллекторную линзу, вблизи фокуса которой располагается нить лампы. 2.2. Разрешающая способность
Каждый объектив характеризуется определенной разрешающей способностью, фокусным расстоянием (глубиной резкости) и увеличением. Разрешающая способность объектива микроскопа (d) — наименьший диаметр частицы, которую можно увидеть при данном объективе, или то наименьшее расстояние между двумя линиями, при котором они видны как отдельные. Разрешающая способность объектива микроскопа зависит от значений нумерической (числовой) апертуры (A) объектива и конденсора и длины волны источника света (λ). Для пучка лучей, параллельных оптической оси микроскопа, разрешающую объектива микроскопа определяют по формуле:
d = λ/A (1.1)
Для наклонных лучей разрешающая способность в 2 раза выше:
d = λ/2A (1.2)
где: λ – длина волны, нм; А – числовая аппретура объектива. Длина волны лучей источника света в видимой части спектра может меняться от 0,4 мкм (400 нм) для фиолетовых лучей до 0,7 мкм (700 нм) для красных. Следовательно, чем короче длина волны лучей источника света и чем больше апертура объектива, тем выше разрешающая способность объектива микроскопа, т. е. тем более тонкие структуры мы сможем увидеть в микроскоп. При освещении объекта наклонными лучами разрешающая способность объектива микроскопа в 2 раза выше, чем при освещении прямо падающими лучами. Освещая препарат синими лучами (λ = 0,47 мкм), т. е. применяя в осветителе синий светофильтр, можно изучать более тонкие структуры, чем при освещении обычным белым светом. Пример:для объектива с A =1,4 при освещении белым светом (λ = 0,55 мкм) диаметр наименьшей видимой частицы при прямо падающем свете равен 0,39 мкм, при косом освещении - 0,20 мкм, а при освещении синим светом - 0,34 и 0,17 мкм, соответственно. Максимальное разрешение, которое можно получить при использовании светового микроскопа, 0,20-0,35 мкм. Увеличить разрешающую способность можно при использовании ультрафиолетового света (длина волны 0,26—0,28 мкм), что позволяет получить разрешение 0,13—0,14 мкм. 2.3. Числовая апертура
Числовая, или нумерическая апертура (А) объектива характеризует светособирательную способность и определяется по формуле:
A= n× sinα (1.3)
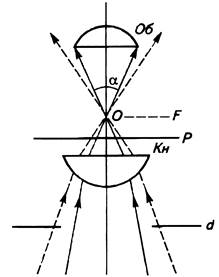
где: n – показатель преломления среды между фронтальной линзой объектива и покровным стеклом; α – половинный угол входного отверстия объектива (угол, одна сторона которого совпадает с оптической осью, другая образована линией, соединяющей точку выхода лучей из объектива с границей действующего отверстия объектива) (рис. 2).
Рис. 2. Угол отверстия объектива микроскопа. Об- объектив; Кн – конденсор; Р – плоскость препарата; F- фронтальная плоскость; α – угол отверстия объектива. (Пухальский и др., 2007) 2.4. Общее увеличение микроскопа
Увеличение объектива указано на оправе, там же указана и числовая апертура. Конденсоры тоже имеет определенную числовую апертуру. Если апертура конденсора меньше апертуры объектива, то возможности объектива, таким образом, используются в работе не полностью. Общее увеличение микроскопа определяется как произведение увеличения объектива (V об) на увеличение окуляра(V ок):
V= Vоб×Vок (1.4)
Если объектив имеет увеличение 90х, а окуляр 15х, то общее увеличение равно 1350. Увеличения, превышающие эту величину, не имеют значения и их называют бесполезным. Это связано с тем, что структуру препарата окуляр может увеличить настолько, чтобы она просматривалась под тем же углом зрения что и в объективе. Это увеличение называется полезным, и оно равно 1000 А. Расчеты показывают, что полезное увеличение не может превышать 1300 -1450 раз. Большее увеличение не выявляет новых деталей на изображении, а освещенность его становится меньше. 2.5. Глубина резкости изображения
Глубина резкости изображения(глубина фокуса) - способность объектива одновременно давать резкие изображения точек, находящихся от него на разном расстоянии, или глубина препарата, видимая одновременно резко. Она зависит от увеличения микроскопа и апертуры объектива. Каждый объектив позволяет видеть препарат на определенную глубину в одной плоскости. На большом увеличении необходимо поочередно фокусировать объектив в разных плоскостях. На малых увеличениях и малой апертуре глубина резкости больше, чем при больших увеличениях. Показатель глубины резкости следует особенно учитывать при микрофотографии, когда необходимо четко видеть изображение объекта в одной плоскости зрения. Глубина резкости – это глубина препарата, видимая одновременно резко. Её определяют по формуле:
T = (1000/7 A×V) +(λ/2 A 2) (1.5)
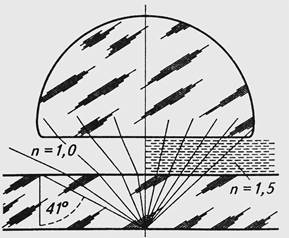
При небольших увеличениях и малой апертуре глубина резкости больше, чем при больших увеличениях и высокой апертуре. Качество микроскопа определяется не увеличением, а разрешающей способностью оптических устройств. В случае сухих объективов (без использования жидких сред - иммерсии) коэффициент преломления равен единице (п = 1) и NA < 0,95. Иммерсионная система - объектив микроскопа, у которого пространство между фронтальной линзой и рассматриваемым предметом заполнено жидкостью с более высоким показателем преломления, чем воздух. Для иммерсионных объективов нумерическая апертура зависит от показателя преломления жидкости, находящейся между препаратом и объективом. Поэтому для водноиммерсионных объективов NA меньше либо 1,25 (вода имеет n = 1,33), а для масляно - иммерсионных объективов NA меньше либо равно 1,4 (кедровое масло имеет n = 1,515). На рисунке 3 представлен ход лучей при использовании масляной иммерсии и сухого объектива. Как видно из этого рисунка, в сухой системе некоторая часть лучей не попадает в объектив, так как при выходе из покровного стекла, они отклоняются. Лучи, которые в месте выхода к поверхности стекла образуют угол больше 41о (предельный угол), полностью отражаются. Для стекла и воды предельный угол равен 41°, для кедрового масла и стекла, он не существует по причине равенства показателей их преломления. Для улучшения качества изображения часто применяется полная иммерсия, когда иммерсионную жидкость наносят и на конденсор.
Рис. 3. Сравнение хода лучей при использовании сухого (слева) и иммерсионного масляного (справа) объективов.
При работе с иммерсионными объективами следует соблюдать осторожность, чтобы при опускании тубуса не повредить линзу. Иммерсионную жидкость наносят между линзой и объективом в виде капли на поверхность покровного стекла препарата и, опуская затем тубус, погружают линзу в каплю иммерсии. Иммерсионную жидкость можно нанести и на поверхность линзы объектива либо по капле и на препарат, и на объектив. Главное требование — создание иммерсии без пузырьков воздуха. Только в случае соответствия апертур коллектора осветителя, конденсора и объектива разрешающая способность оптики микроскопа используется полностью. Задание 1. Определение зависимости Т и d от длины волны
Ознакомиться с объективами, окулярами и конденсором биологического микроскопа. Приготовить временный препарат кожицы лука и рассмотреть его при разных длинах волн, используя цветные светофильтры, красный и синий. Зарисовать препарат при трех длинах волн. Определить, при какой длине волны видны более мелкие детали. Рассчитать разрешающую способность и глубину резкости. Результаты занести в табл.3. Таблица 3. Зависимость разрешающей способности и глубины резкости от длины волны света.
Сделать вывод о зависимости d и T от длины волны (λ). Дата добавления: 2015-12-16 | Просмотры: 762 | Нарушение авторских прав |
 Применение покровных стекол несоответствующей толщины (толще или тоньше 0,17 мм).
Применение покровных стекол несоответствующей толщины (толще или тоньше 0,17 мм).