|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
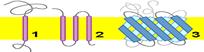
Топологическая классификацияПо отношению к мембране мембранные белки делятся на (рис. 807240919) Монотопические политопические
Рис. 807240919. Локализация белков в мембране монотопическая (1), битопическая (2) и политопическая (3).
Монотопные белки пересекают мембрану один раз, политопные белки - несколько раз. Политопические, или трансмембранные, белки полностью пронизывают мембрану и, таким образом, взаимодействуют с обеими сторонами липидного бислоя. Как правило, трансмембранный фрагмент белка является альфа-спиралью, состоящей из гидрофобных аминокислот (возможно от 1 до 20 таких фрагментов) (рис. 807241121, 807241122, 807241123).
Только у бактерий, а также в митохондриях и хлоропластах трансмембранные фрагменты могут быть организованы как бета-складчатая структура (от 8 до 22 поворотов полипептидной цепи). Бета‑складчатая структура - периодическая складчатая конфигурация, возникающая в результате образования водородных связей между параллельно-ориентированными участками одной или нескольких полипептидных молекул. Интегральные монотопические белки постоянно встроены в липидный бислой, но соединены с мембраной только на одной стороне, не проникая на противоположную сторону.
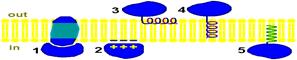
Рис. 807241138. Различные категории монотопических белков. 1 – белки, связанные с интегральными белками (сукцинатдегидрогеназа); 2 – белки, присоединенные к полярным «головкам» липидного слоя за счёт электростатического взаимодействия (прямого или кальций-опосредованного). (протеинкиназа С); 3 – белки, вязанные с мембраной амфипатической альфа-спиралью, параллельной плоскости мембраны, 4 - белки, «заякоренные» в мембране с помощью короткого гидрофобного концевого домена (цитохром b5); 6 – белки «заякоренные» в мембране за счет жирнокислотного радикала, ковалентно присоединенного к белковой молекуле (G-белок). Анализ аминокислот некоторых мембранных белков показал, что они содержат примерно столько же полярных аминокислот, сколько и обычные водорастворимые белки, тем не менее, в воде они растворяются очень плохо. Причина их гидрофобности кроется не в самом аминокислотном составе, а в порядке чередования аминокислотных остатков – гидрофобные аминокислотные радикалы не рассеяны вдоль по полипептидной цепи, а сконцентрированы в гидрофобные домены. Некоторые мембранные белки увеличивают свою гидрофобность с помощью ковалентной связи с липидными компонентами мембран. Эти белки используют для более прочного контакта с бислоем миристиновую С14:0 или пальмитиновую С16:0 жирные кислоты или гликозилфосфатидилинозитол. Белки, связанные с жирными кислотами, локализованы, в основном, на цитоплазматической поверхности плазматической мембраны, а белки, связанные с гликозилфосфатидилинозитолом – на наружной. Дата добавления: 2015-12-15 | Просмотры: 654 | Нарушение авторских прав |