|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Генетика антител и системы антиген/рецепторОбразование антител и их функции. Живые организмы постоянно подвергаются атаке как извне - со стороны бактерий и вирусов, так и изнутри – со стороны клеток, которыев результате случайных событий приобретают способность неограниченно делиться и формировать опухоли. В ходе эволюции выработалась сложная защитная система, состоящая из ряда клеточных и гуморальных факторов. Эта система называется иммунной, а изучающая ее наука - иммунологией [100]. На рис. 4.61 представлена сильно упрощенная схема иммунологической защиты и ее основные компоненты. Указаны также те компоненты, для которых обнаружены генетические дефекты. Важнейшие структуры иммунной системы - лимфоциты - обладают рецепторами к антигенам. Рецепторы лимфоцитов (и Т-, и В-клеток) закодированы в геноме и сходны по своей структуре, однако гены для этих двух типов рецепторов различны и локализуются в разных хромосомах. Секретируемые рецепторы В-клеток (антитела) представлены иммуноглобулинами. Рецепторы Т-клеток не секретируются. Специфичность рецептора целиком определяется первичной структурой его антиген-связывающего участка. Этот участок кодируется целым набором генов, причем в ходе развития лимфоцита один из генов вариабельной части молекулы (V-ген), выбранный случайным образом, объединяется с геном константной части (С-г е ном). Таким образом, дифференцированный лимфоцит способен продуцировать только один тип рецептора, специфичный для одного определенного антигена, а вся популяция лимфоцитов как целое содержит полный набор рецепторов, которые организм способен синтезировать. Контакт с определенным антигеном вызывает пролиферацию тех лимфоцитов (клонов), кото- 4 Действие генов 101
рые имеют рецептор, соответствующий этому антигену. Генетика антител (рецепторов В-лимфоцитов) изучена значительно лучше, чем рецепторов Т-клеток. Впрочем, основные принципы в этих случаях, по-видимому, сходны. Белки миеломы как инструмент исследования. У большинства людей иммуноглобулины (антитела, или секретируемые В-клетками рецепторы антигенов) представляют собой сложную смесь белков, синтезируемых многими различными клеточными клонами. На первый взгляд такая гетерогенность кажется непреодолимым препятствием на пути химического анализа антител, поскольку для него необходимы очищенные белки. Однако, как и во многих других случаях, сама природа «предусмотрела» ситуации, позволяющие решить эту задачу. Неоплазии возникают при злокачественном перерождении одиночных клеток. Во многих случаях это происходит в результате соматических мутаций (разд. 5.4.6). Если дифференцировка клеток, продуцирующих антитела, произошла до начала злокачественного роста, плазматические опухолевые клетки будут в большом количестве продуцировать один-единственный вид антител. Действительно, такие моноклональные белки были обнаружены у мыши и у человека при миеломатозах-это распространенный тип плазматических опухолей. Белки миелом можно выделить и очистить в достаточных количествах для определения их аминокислотной последовательности. Таким путем была изучена структура антител. Классификация иммуноглобулинов [1123; 1124]. Принято различать пять классов иммуноглобулинов: IgG, IgM, IgA, IgD и 102 4 Действие генов
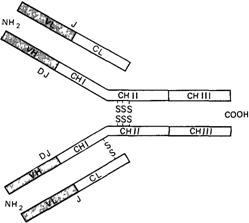
IgE. Молекулы иммуноглобулинов каждого из этих классов состоят из нескольких полипептидных цепей различной длинытак называемых легких цепей (L) и тяжелых цепей (Н). Класс иммуноглобулина определяется тем, к какому из пяти типов - γ, μ, α, δ или ε - относятся входящие в его состав тяжелые цепи. Легкие цепи бывают лишь двух типов - k или λ. В любой молекуле присутствуют легкие цепи только одного из этих двух типов, но в каждом классе встречаются иммуноглобулины с легкими цепями как k-, так и λ-типа. Молекула IgG представляет собой типичный иммуноглобулин, в ее составе две Н-цепи связаны дисульфидными мостиками друг с другом, а также с двумя L-цепями. Другие классы иммуноглобулинов отличаются более сложной структурой, например одна молекула IgM построена из пяти субъединиц, в каждой из которых имеется по две Н-цепи. В ходе нормального иммунного ответа первыми образуются антитела класса IgM, затем они заменяются антителами класса IgG той же специфичности. Переключение синтеза происходит в тех же клетках, которые синтезировали IgM (рис. 4.62). Константная и вариабельная области. Все тяжелые и легкие цепи иммуноглобулинов имеют общее свойство, отличающее их от всех изученных к настоящему времени белков: в них имеются константные и вариабельные области. Константная область (С) построена подобно большинству других полипептидов, ее аминокислотная последовательность одинакова у С-цепей всех типов, исключение составляют лишь отдельные аминокислотные остатки, по которым наблюдаются полиморфные варианты. Обычно они выявляются косвенно, по подавлению агглютинации эритроцитов специфическими антителами. Эти варианты обозначаются как группы Gm и Km (Inv) для тяжелых и легких цепей соответственно. Вариабельные области, напротив, по аминокислотным последовательностям оказались различными во всех изученных к настоящему времени белках миелом. Все вариабельные области легких и тяжелых цепей имеют примерно равную длину107-120 аминокислот. Константная область легких цепей приблизительно равна по длине вариабельной области. В тяжелых цепях константная область по длине почти в точности соответствует нескольким копиям вариабельной области (рис. 4.63). Константные области тяжелых γ1- и α1-цепей в три раза, а μ- и ε-цепей в четыре раза длиннее сходных областей легких цепей. Более того, все сегменты константной области в некоторой степени гомологичны между собой, т.е. их аминокислотные последовательности, хотя и различаются по многим деталям, но все же настолько сходны, что это не может быть случайностью. Общее происхождение генов всех цепей иммуноглобулинов. Проще всего такое сходство объяснить общим эволюционным происхождением всех этих сегментов. Предположим, что исходно существовал один ген, который кодировал полипептидную цепь, по длине приблизительно соответствующую константной области легкой цепи. В ходе эволюции этот ген многократно дуплицировался. Некоторые дупликации при- 4 Действие генов 103
вели к возникновению генов, кодирующих полипептиды, в составе которых одна и та же аминокислотная последовательность повторена три или даже четыре раза. Дуплицированные участки ДНК были полностью гомологичны по структуре, но различались по относительному расположению. Дивергенция этих структурно гомологичных между собой участков в ходе эволюции обусловила наблюдающиеся в настоящее время различия в аминокислотной последовательности константных областей различных иммуноглобулинов. Первая дупликация исходного гена, вероятно, произошла в ходе хромосомной перестройки. Последующие акты дупликации легко могли осуществляться путем неравного кроссинговера при ошибочном спаривании тесно сцепленных генов, гомологичных по структуре, но различающихся по расположению. По-видимому, это наиболее вероятный механизм увеличения числа гомологичных участков в константных областях различных генов тяжелых цепей. В дальнейшем эволюция различных легких и тяжелых цепей происходила в основном путем дупликаций и хромосомных перестроек. Гены легких и тяжелых цепей не располагаются рядом в составе одной и той же хромосомы. Генетически полиморфные сайты легких цепей (Km-система) и тяжелых цепей (Gm-система) не сцеплены между собой [78]. Генетический контроль вариабельных областей. До сих пор мы рассматривали генетический контроль только константных областей, который можно удовлетворительно объяснить в рамках представлений классической генетики. Однако подобный подход не годится для вариабельных областей. Как объяснить, что все аминокислотные последовательности вариабельных областей, проанализированные к настоящему времени, оказались различными? Можно предположить, что любой человек обладает очень большим количеством клонов плазматических клеток, каждый из которых образует иммуноглобулин со структурой вариабельного участка, характерной лишь для этого клона. Возможно также, что специфичность антитела определяется его вариабельной областью (V). При этом остаются открытыми два принципиальных вопроса. 1. Какие генетические механизмы контролируют синтез вариабельных областей? 2. Каким образом в результате их действия возникает специфичность антител'? Соматические мутации или избирательная активация генов! Для объяснения генетического контроля вариабельных областей было предложено несколько гипотез. Наибольшую Известность получили две из них: гипотеза «соматических мутаций» и гипотеза «избирательной активации генов». Согласно гипотезе соматических мутаций, в геноме человека имеется лишь один ген, в котором в процессе созревания В-лимфоцитов возникают многочисленные случайные мутации. На самом деле соматические мутации происходят в ходе пролиферации клеток всех типов (разд. 5.1.6). Однако эта гипотеза подразумевает наличие специфического механизма, который обеспечивает избирательное увеличение частоты соматических мутаций именно в гене вариабельной области. Можно представить себе такой механизм, например предположив, что рассматриваемый участок ДНК недоступен для действия ферментов репарации. 104 4 Действие генов
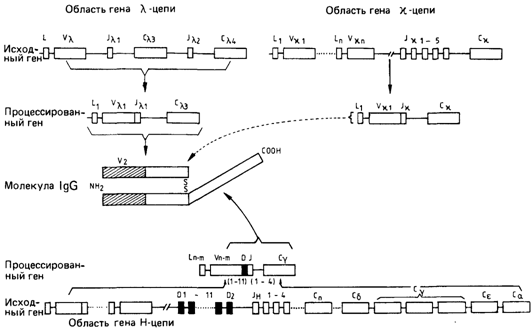
Соматические мутации, несомненно, случайны. Следовательно, изучение миеломных белков должно продемонстрировать полностью независимые аминокислотные замены в вариабельных областях различных антител. Конечно, в молекуле могут быть такие участки, мутации в которых недопустимы и которые поэтому должны быть идентичными во всех вариабельных областях иммуноглобулинов. Все исследованные к настоящему времени вариабельные области можно подразделить на группы, в пределах которых определенные аминокислотные замены являются общими, тогда как другие аминокислотные замены совершенно различны. Этот факт делает более убедительной альтернативную гипотезу генетического контроля вариабельных областей. Согласно этой гипотезе, у каждого человека имеется большой набор генов, которые организованы в виде высокоповторяющейся последовательности. Однако в каждой клетке активным может быть только один из таких генов. Этот ген может каким-то образом соединиться с геном константной области полипептидной цепи, в результате образуется непрерывная молекула мРНК. Если допустить, что подобная организация генов возникла в результате многократных актов неравного кроссинговера, за которым в течение многих тысячелетий происходила ненаправленная фиксация точковых мутаций, то наблюдаемые закономерности вполне объяснимы. Мутации, которые являются общими для нескольких полипептидных цепей, очевидно, были фиксированы до того, как гены этих цепей дуплицировались; мутации, которые обнаруживаются лишь в одной цепи, по всей вероятности, возникли сравнительно недавно. Обе гипотезы связаны с необычным для генетики допущением. Для накопления столь большого количества соматических мутаций необходимо увеличение частоты их возникновения или скорости отбора, характерное для В-лимфоцитов. Избирательное объединение одного из многих генов вариабельной области с геном константной области должно осуществляться специальным механизмом, который ранее не был обнаружен. Такое соединение не может происходить на уровне белка, так же как и на уровне РНК, поскольку мРНК уже содержит полную информацию о белке. Следовательно, оно должно происходить на уровне ДНК. Первые предположения относительно такого механизма возникли после открытия ферментов рестрикции, способных расщеплять молекулу ДНК по определенным последовательностям нуклеотидов (разд. 2.3 и 9.2). Одна из нормальных функций таких ферментов может заключаться в расщеплении ДНК с образованием протяженных фрагментов, которые впоследствии объединяются в новом порядке и только после этого транскрибируются. Изучение одних аминокислотных последовательностей не позволяло решить, какая из гипотез была верна. Для ответа на этот вопрос необходимо прямое исследование структуры соответствующих генов. Проблема была решена с помощью методов генной инженерии (разд. 2.3). Оказалось, что сторонники обеих гипотез были отчасти правы. На рис. 4.64 представлена структура генов мыши, кодирующих легкие λ - и ϰ-цепи и тяжелые цепи иммуноглобулинов. Хотя значительная часть этих исследований выполнена на мышах, существуют убедительные доказательства сходства соответствующих генов мыши и человека. Имеются три типа сегментов генов иммуноглобулинов, которые организованы принципиально сходным образом: гены константной области, гены вариабельной области и так называемый соединительный сегмент. Далее эти сегменты будут обозначаться соответственно буквами С, V и J - прямыми заглавными в случае участков молекул белка и курсивом в случае кодирующих их сегментов генов Впрочем, в деталях эти элементы различаются (см. рис. 4.64). Для легкой λ-цепи имеются два гена константной области. Поскольку белок содержит единственную С-область, при его синтезе должен происходить выбор одного из четырех генов С-области (по два таких гена имеется на каждой из двух гомологичных хромосом). Помимо этого, для каждого С-гена имеются собственный ген J и один ген V. Имеется также короткий сегмент (так называемый L-сегмент), на- 4. Действие генов 105
ходящийся слева от V, внутри которого находится стартовая точка транскрипции. Ген легкой ϰ-цепи содержит один С-сегмент и 5 различных J-сегментов. Гены V-области весьма многообразны, по современным оценкам их насчитывается 90-300. Среди последовательностей, кодирующих Н-цепь, обнаружено 8 различных С-сегментов. Продукт гена Сμ присутствует в белке IgM, продукты генов Cδ, γ1, γ2b, γ2αвходят в состав иммуноглобулинов IgD, IgG, IgA. Существуют также 4 различных гена J-сегмента. В отличие от легких цепей, тяжелые цепи содержат дополнительную аминокислотную последовательность, которая кодируется D-сегментом, присутствующим в 12 копиях. Кроме того, имеется 100-200 LH-VH сегментов. В ходе дифференцировки клеток, образующих антитела, один L-V сегмент соединяется с одним J-сегментом (а в случае клонов, образующих тяжелые цепи, с одним D- и одним J-сегментом) и одним С-сегментом. Поэтому возможно огромное количество комбинаций: если в геноме содержится 2V λ, 3J λ, 300 V ϰи 4 J ϰ -сегмента, то общее число различных вариантов легких цепей равно 1206 (2x3 + 300 х 4). Подобным образом, если имеется 200VH-, 12D- и 4Jн-сегмента, то максимальное число различных тяжелых цепей должно быть 9600 (200 VH х 12D х 4JH). He будем далее углубляться в вопрос о доказательстве гипотезы избирательной активации генов. Прямые исследования генов показали, что их перестройка осуществляется в ходе дифференцировки В-лимфоцитов, а также до нее. В настоящее время на изучении этой проблемы сосредоточили свои усилия несколько групп исследователей. Некоторые факты уже выяснены. В частности, оказалось, что воссоединение различных сегментов генов осуществляется не с абсолютной точностью, и это может служить дополнительным источником разнообразия. В других случаях подобные неточности приводят к сдви- 106 4 Действие генов
гу правильной рамки считывания, в результате нарушается трансляция белка Таким образом, многообразие антител достигается ценой некоторых потерь Иногда в месте объединения происходит инсерция одного или нескольких нуклеотидов Однако перечисленные факторы, определяющие различия, не могут полностью объяснить многообразие антител В действительности сторонники гипотезы соматических мутаций оказались отчасти правы В настоящее время путем сравнения гомологичных нуклеотидных последовательностей генов иммуноглобулинов разных индивидов получены убедительные данные, доказывающие, что в них происходят многочисленные соматические мутации В большинстве случаев это простые нуклеотидные замены, которые приводят к замещению одной аминокислоты (см разд. 5.1.4) Они были обнаружены не только в V-сегменте, но также и в J- и D -сегментах Итак, существуют 4 источника разнообразия антител в клетках 1) только одна из множества копий V-сегментов соединяется с соответствую-
4. Действие генов 107
щими J-, D и С-сегментами с образованием функционального гена; 2) соединение концов сегментов происходит не с абсолютной точностью; 3) в месте соединения возможно встраивание дополнительных нуклеотидов; 4) помимо рекомбинации (как в трех предыдущих случаях) источником многообразия могут служить соматические мутации в V-, J- и D-сегментах. Благодаря всем перечисленным механизмам один организм синтезирует многие тысячи различных антител. Отметим здесь другой факт, важный с эволюционной точки зрения. Как говорилось в разд. 3.5.5, иммунный ответ определяется, в частности, специфичностью HLA. Поэтому было вполне логично исследовать возможные сходные участки в аминокислотных последовательностях этих белков [1173; 1329а]. Как показано на рис. 3.39, молекула HLA состоит из тяжелой и легкой цепей. Тяжелая цепь включает внутриклеточную часть молекулы, а также участки α3, α2, α1. Была обнаружена статистически значимая гомология в аминокислотной последовательности между участками HLA-B7 и С-областью IgG. Эти белки имеют и другие общие структурные особенности, например у них совпадают три инвариантных аминокислотных остатка (два остатка цистеина и один остаток треонина), имеются также целые участки гомологии вокруг цистеина. В общем аминокислотные последовательности таковы, что возможно образование трехмерной структуры, весьма близкой к структуре молекулы IgG. Все эти данные, несомненно, указывают на общее эволюционное происхождение семейства генов HLA и генов иммуноглобулинов. Мы вернемся к этому вопросу в гл. 7. Вариабельная область и специфичность антител. Как уже отмечалось, специфичность антител определяется вариабельными областями молекулы, которые различаются по аминокислотным последовательностям. Внутри вариабельной области имеются участки, в которых вариабельность выше, чем в других. Антигены связываются со специфическими участками молекулы антитела. Если специфичность антитела действительно определяется различиями в аминокислот- 108 4. Действие генов
ных последовательностях, то участки связывания следует искать среди наиболее вариабельных областей. Для х-цепей это участки аминокислот 28-34, 50-56, 91-96. Пространственную структуру молекул белков определяют методом рентгеноструктурного анализа. В настоящее время рентгеноструктурные данные получены для вариабельной области ϰ-цепи (рис. 4.65). Полипептидная цепь изогнута так, что образует двуслойную структуру, причем соседние сегменты одного слоя антипараллельны и связаны друг с другом водородными связями. Получены данные в пользу того, что вариабельные области λ-цепей и тяжелых цепей организованы сходным образом. Темно-серые участки на рисунке соответствуют гипервариабельным районам. Обозначены также аминокислоты, обеспечивающие контакты между двумя мономерами молекулы антитела. Две такие вариабельные области молекулы формируют карман диаметром 15А, стенки которого образованы гипервариабельными участками [1123]. Весьма вероятно, что этот карман является частью участка связывания антигена и его форма определяет специфичность антитела. В свою очередь форма кармана определяется аминокислотной последовательностью гипервариабельных участков. Еще на ранних этапах развития иммунологии специалисты зачастую сравнивали взаимодействие антигена и антитела с ключом и замком. Пространственная модель, представленная на рис. 4.65, показывает, что эти представления, по-видимому, не просто метафора. Дата добавления: 2015-12-16 | Просмотры: 787 | Нарушение авторских прав |