|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Фармакогенетика и экогенетика 4.5.1. Фармакогенетика
Развитие биохимической генетики человека, обнаружение наследственных дефектов ферментов, привели к возникновению новой отрасли генетики - фармакогенетики. Еще Гэррод, основатель биохимической генетики человека [75] (разд. 1.5), и известный английский генетик Холдейн [87] отмечали, что необычные реакции на лекарственные препараты и пищевые продукты могут объясняться биохимической индивидуальностью людей. Действительно, в 50-е годы было показано, что некоторые аномальные реакции, связанные с применением лекарств, обусловлены различиями в свойствах ферментов. Так, гемолитическая анемия, которая встречается у некоторых людей при употреблении в пишу бобов, а также при действии различных лекарств, в действительности объясняется недостаточной активностью глюкозо-6-фосфат-дегидрогеназы (G6PD) (разд. 4.2.2.2). Было установлено, что с одним из вариантов псевдохолинэстеразы [1195; 1152] связана длительная задержка дыхания после введения суксаметониума - препарата, который широко применяется для релаксации мышц во время хирургических операций. Выяснилось, что значительная вариабельность уровня изониазидгидразина в крови обусловлена генетически детерминированными различиями в активности ацетилтрансферазы у разных индивидов [1073]. Эти факты побудили одного из авторов этой книги (А. Мотульски) высказать предположение о том, что аномальная реакция на лекарственные препараты иногда может быть связана с наследственной ферментативной недостаточностью [1222]. Другой автор (Ф. Фогель) первым предложил термин «фармакогенетика» [1337]. Система G6PD (30590). Эта система уже обсуждалась в разд. 4.2. Ген, контролирующий синтез этого фермента, локализован в Х-хромосоме, поэтому гемолитические реакции на лекарственные препараты, обусловленные недостаточностью G6PD, проявляются главным образом у мужчин. У гетерозиготных женщин часто регистрируется промежуточный уровень активности фермента, причем у некоторых гетерозигот он приближается к нормальному, а у некоторых - к уровню, характерному для больных (рис. 4.6) [1234]. В крови таких гетерозигот присутствуют две популяции эритроцитов - нормальная и мутантная. Количественное соотношение между ними обычно близко к 1:1, но может и варьировать в отдельных случаях от 1:99 до 99: 1 [999]. Частота встречаемости G6PD-зависимой реакции на некоторые лекарства у женщин зависит от частоты соответствующего аллеля в популяции и от степени 4 Действие генов 109
инактивации Х-хромосомы, которая определяется количественным соотношением нормальных и дефектных по G6PD клеток. Среди женщин с клиническими формами недостаточности, лишь незначительная часть приходится на гомозигот, в основном это гетерозиготы, у которых преобладают мутантные клетки с низким уровнем фермента. Различные лекарственные препараты с возможным гемолитическим эффектом также различаются по их потенциальной способности вызывать нарушения в крови. Установлена связь некоторых распространенных вариантов G6PD с гемолитической реакцией (табл. 4.4). Показано, что помимо лекарственных препаратов, гемолиз может вызываться бактериальной или вирусной инфекцией, проявляться при желтухе новорожденных, когда печень еще не способна перерабатывать билирубин (продукт метаболизма гемоглобина), который выделяется при гемолизе. Наиболее тяжелая форма гемолиза детерминируется такими мутантными формами G6PD, как Mediterranean и Canton (табл. 4.4). Для этих случаев характерно не только уменьшение активности, но и нестабильность молекул фермента [1146]. При распространенном типе недостаточности G6PD, характерном для лиц африканского происхождения, молодые эритроциты, возраст которых составляет менее 60 дней (продолжительность жизни нормального эритроцита составляет 120 дней), содержат достаточные количества фермента, а характерная для этого заболевания нестабильность фермента проявляется только в старых эритроцитах. В этом случае происходит лишь ограниченный гемолиз и летальные исходы почти не наблюдаются. При более тяжелом гемолизе, который характерен для средиземноморского варианта, исход может быть и фатальным. Этот вариант отличается от недостаточности африканского типа также тем, что обусловленный им гемолиз индуцируется большим числом лекарственных препаратов. Для большинства других форм фермента данные о спектре потенциально опасных препаратов еще не получены.
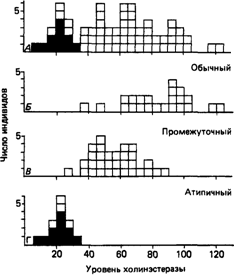
Варианты псевдохолинэстеразы [1104]. Препарат суксаметониум, или сукцинилдихолин, широко применяется в качестве релаксанта мышц при хирургических операциях. Фермент превдохолинэстераза катализирует гидролиз препарата, благодаря чему в норме его действие непродолжительно. У редко встречающихся больных этот фермент обладает очень низким сродством к препарату, что приводит к длительной задержке дыхания вследствие подавления деятельности дыхательных мышц. В таких случаях в течение многих часов, пока пациенту не введут очищенный фермент или плазму, содержащую активную псевдохолинэстеразу, приходится прибегать к искусственному дыханию. Причиной ненормального метаболизма препарата служат различные мутации как в гетерозиготном, так и в компаунд-гетерозиготном состоянии, изменяющие активный центр псевдохолинэстеразы, которая в этих случаях не способна эффективно гидролизовать субстрат. Наиболее часто встречается мутантный аллель СНЕ 1D. Аллель, кодирующий нормальную псевдохолинэстеразу, обозначают СНЕ 1U. Примерно 3-4% людей европейского происхождения являются гетерозиготами (СНЕ 1U /СНЕ 1D), а один из каждых 3500 индивидов - гомозиготой по мутантному аллелю. Вместе они составляют группу риска по продолжительной задержке дыхания при введении суксаметониума. Измененный фермент обычно идентифицируют in vitro по его устойчивости к ингибитору дибукаину. У мутантных гомозигот фермент относительно устойчив к дибукаину, гетерозиготы проявляют промежуточную устойчивость (табл. 4.21). Другой аллель псевдохолинэстеразы (СНЕ 1S ) обусловливает полное отсутствие активности этого фермента. Гомозиготы по этому аллелю (СНЕ 1S / / СНЕ 1S ) очень чувствительны к действию суксаметониума, так как в плазме крови этих больных псевдохолинэстеразы нет. Аллель СНЕ 1Sраспространен среди эскимосов Аляски. Еще один мутантный аллель (СНЕ 1F ) детерминирует устойчивость к фториду. Обычно в качестве субстрата при исследованиях псевдохолинэстеразы применяют бензоилхолин. Однако у некоторых 110 4. Действие генов
больных с длительной задержкой дыхания нарушение фермента удается обнаружить только тогда, когда для этого используют непосредственно сукцинилдихолин [1103]. Варианты ацетилтрансферазы [1062; 1204, 1271]. Многие лекарственные препараты ацетилируются в печени ферментом N-ацетилтрансферазой. В число этих препаратов входят изониазидгидразин, фенелзин, дапсон, салицилазосульфопиридин, сульфаметазин, нитрозепам, гидролазин и прокаинамид. Разные индивиды отличаются по способности ацетилировать контрольный препарат, например изониазидгидразин или сульфаметазин, при введении in vivo. Приблизительно 50% европейцев и африканцев инактивируют препарат медленно, тогда как 80-90% жителей Азии - быстро. Семейный анализ показал, что люди, медленно инактивирующие препараты, лишены активности ацетилазы, а быстро инактивирующие обладают одной или двумя копиями гена, который кодирует ацетилтрансферазу. Точный биохимический механизм, отвечающий за полиморфизм N-ацетилтрансферазы, не установлен. Тесты для оценки ацетилирования in vitro в настоящее время не разработаны, вот почему, чтобы выяснить способность конкретного человека осуществлять ацетилирование, ему приходится вводить контрольный препарат. С этой целью можно с успехом использовать кофеин в стандартной дозировке, которая эквивалентна его содержанию в чашке кофе, поскольку основной продукт ацетилирования кофеина (5-ацетиламино6-формиламино-3-метилурацил) выделяется с мочой только у людей, способных к быстрой инактивации препаратов [1113]. Среди клинических последствий полиморфизма способности к ацетилированию следует отметить большую частоту полинейропатии в ответ на изониазидгидразин среди «медленно инактивирующих». Побочные эффекты, подобные явлениям при волчанке, чаще встречаются у «медленно инактивирующих» при действии гидролазина и прокаинамида. У «медленно инактивирующих» сильнее выражены гематологические эффекты дапсона и салицилазосульфопиридина. Возможно, «быстро инактивирующим» требуется вводить более высокие дозы различных препаратов для достижения требуемого терапевтического эффекта. Высказывались также предположения о том, что изониазидгидразин является у «быстрых инактиваторов» токсичным для печени, так как ацетилизониазид более токсичен для печени, чем изониазидгидразин [1280]. 4. Действие генов 111 Кривые распределения и действие генов. При моногенном типе наследования должны наблюдаться качественные различия между продуктами нормального и мутантного генов. Если есть возможность производить измерение на уровне продукта гена, то при графической обработке результатов обычно удается идентифицировать различные генетические классы в виде отдельных мод на кривой распределения. Кривая распределения активности G6PD у мужчин с нормальной активностью и с дефектом этого фермента имеет две неперекрывающиеся моды. Все три генетических класса вариантов псевдохолинэстеразы можно легко идентифицировать в опытах со специфическими ингибиторами. Этот метод
позволяет получить прямые качественные данные о природе мутации. Однако, если измеряется уровень псевдохолинэстеразы в крови, а не характер ее ингибирования, различить три класса вариантов столь же просто не удается, поскольку между нормальными гомозиготами и гетерозиготами и между гетерозиготами и мутантными гомозиготами наблюдается перекрывание (рис. 4.67). Эти данные показывают, что мультимодальную кривую распределения можно рассматривать как свидетельство моногенного наследования признака. Однако, если об активности мутантного гена судят не по его первичному продукту, на результаты будут влиять другие генетические факторы и факторы среды, что в конечном счете может обусловить мономодальный характер кривой. Поскольку мономодальная форма кривой обычно интерпретируется как доказательство полигенного определения признака (разд. 3.6), в тех случаях, когда в распоряжении исследователей имеются только данные о распределении частот, выводы о механизме наследования следует делать с осторожностью. Полиморфизм по реакции на дебрисохин и спартеин [971; 1072, 1305]. Распространенный полиморфизм, проявляющийся у 5-8% европейцев и африканцев, связан с дефектом окисления ряда лекарственных препаратов (табл. 4.22). Он был обнаружен независимо при изучении действия антигипертензивного препарата дебрисохина, имитирующего окситоцин, и антиаритмического препарата спартеина. Индивиды, способные быстро окислять эти препараты, могут быть как нормальными гомозиготами, так и гетерозиготами, тогда как медленное окисление свойственно лишь мутантным гомозиготам. Точная биохимическая природа полиморфизма не установлена, однако имеются надежные данные в пользу того, что изменен компонент системы цитохрома Р-450 печени (эта система участвует в метаболизме соединений, поступающих извне) [1050; 1219; 1258]. К сожалению, в настоящее время выявить окислительный полиморфизм in vitro невозможно. Для определения окислительно-
112 4. Действие генов
го статуса индивида необходим прием внутрь контрольного препарата и анализ его метаболизма в моче (т.е. определение соотношения 4-оксидебрисохина к дебрисохину). В настоящее время исследуется вклад этого полиморфизма в побочное действие так называемых бета-блокаторов [1051]. Полиморфизм по способности окислять мефенитоин [1353]. Показано, что окисление противосудорожного препарата мефенитоина контролируется отдельным геном, не сцепленным с полиморфизмом по реакции на дебрисохин. Относительно высокая частота побочных эффектов мефенитоина обусловлена, вероятно, тем, что 2-5% людей не способны окислять этот препарат. Окисление мефенитоина (дилактин), по-видимому, контролируется белковым продуктом этого же полиморфного гена. Другие моногенные фармакогенетические признаки. Известен ряд других важных с точки зрения фармакогенетики состояний, которые наследуются как простые менделевские признаки. Они перечислены в табл. 4.23.
4 Действие генов 113
114 4 Действие генов
Мультифакториальная фармакогенетика. В ряде исследований, основанных на близнецовом методе, было продемонстрировано, что генетические факторы играют существенную роль в определении времени полураспада лекарственных препаратов. Во всех опытах, когда препарат вводили монозиготным и дизиготным близнецам, время полураспада различалось гораздо меньше для монозиготных близнецов [1335; 1270]. Расчеты коэффициента наследуемости, основанные на подобных данных, показали, что генетические факторы вносят большой вклад в общий размах времени полураспада препаратов, в некоторых случаях он оценивается в 99% (табл. 4.24). Если препарат исследовать на большой выборке из нормальной популяции, наблюдается значительная вариабельность уровня препарата в крови. И хотя на этот показатель влияют различные факторы, решающую роль играют различия в метаболизме препаратов. Время полужизни (или устойчивый уровень препарата) является более или менее постоянным для индивида и, согласно результатам исследований на близнецах, контролируется в основном генетическими факторами. Биохимические механизмы конкретных реакций метаболизма препаратов в настоящее время не установлены. Вариации времени полураспада для большинства препаратов могут быть представлены в виде колоколообразной кривой Гаусса (рис. 4.68). После введения средней дозы препарата у определенной части популяции (по обе стороны от моды) в организме устанавливается либо слишком высокий, либо слишком низкий уровень препарата. С одной стороны, при высоком уровне препарата это может приводить к токсичности, а с другой, при низком уровне - к отсутствию терапевтического эффекта. После того как было доказано, что генетические факторы играют заметную роль в метаболизме большинства лекарственных препаратов, фармакогенетика из узкой области знаний о необычных реакциях на препараты превратилась в центральную дисциплину фармакологии и терапии [1229]. Фармакогенетическая вариабельность на уровне отдельных органов. Генетическая вариабельность на уровне отдельных органов уже рассматривалась при обсуждении дефекта G6PD в эритроцитах. Действие алкоголя на мозг будет обсуждаться в разд. 8.2.3.5. Кроме того, побочные эффекты некоторых психотропных препаратов также обусловлены генетически [1271]. Напри- 4. Действие генов 115
мер, при лечении фенотиазином может развиться болезнь Паркинсона, причем риск заболевания втрое выше у людей, родственники которых больны паркинсонизмом [1272]. «Тардивная дискинезия», выражается в ненормальных и неконтролируемых движениях, нередко встречается у больных, получающих психофармакологические препараты; при этом наблюдается значительная внутрисемейная корреляция. Подобная терапия оказывает воздействие на работу нейромедиатора дофамина (разд. 8.2.3.6). Поэтому интересно, что при действии нейролептиков в хвостатом ядре крыс возрастает количество дофаминовых рецепторов, отдельные линии животных различаются по этому признаку. Шизофрения у людей может быть вызвана такими препаратами, как ЛСД, амфетамин и даже злоупотреблением алкоголем (алкогольные галлюцинации). Случаи заболевания шизофренией отмечаются значительно чаще у прямых родственников лиц, уже страдающих этим заболеванием. Редкое, но опасное осложнение общей анестезии - злокачественная гипертермия - часто бывает связана с повышенной мышечной ригидностью. Примерно у половины обследованных больных отмечалось неполное аутосомно-доминантное наследование. Многие пробанды страдают от незначительных мышечных аномалий, таких как птоз, судороги, вывихи или ушибы. Отмечались отклонения в электромиограммах, а также незначительные цитологические признаки миопатии. 4.5.2. Экогенетика [143; 969; 1228; 1250] Концепция экогенетики, впервые предложенная в 1971 г. Брюэром [1017], возникла в результате развития фармакогенетики. Лекарственные препараты составляют лишь небольшую долю химических факторов окружающей среды, воздействию которых подвергается человеческое сообщество. Существует множество других потенциально токсичных веществ, которые могут поражать людей с генетической предрасположенностью. Экогенетика расширяет центральную концепцию фармакогенетики о различных генетически обусловленных реакциях на лекарственные препараты, объясняя сходным образом реакции на другие факторы среды. Поскольку исследования, основанные на близнецовом методе, свидетельствовали о том, что метаболизм лекарственных препаратов подвержен генетическому контролю, можно было заключить, что превращение любых химических агентов также контролируется генетически. Экогенетика человека изучает реакцию человеческого организма на различные агенты среды. В ее задачи входят объяснение различной чувствительности отдельных людей к действию потенциально опасных внешних агентов и изучение индивидуальных особенностей адаптации к окружающей среде. Рабочая гипотеза фармакогенетики заключается в том, что биохимические особенности организма определяют характер реакции на внешний агент, особенно в тех случаях, когда уже известно, что данное действие вызывает у людей неодинаковые реакции. Подобно рассмотренным явлениям фармакогенетики, некоторые экогенетические реакции определяются действием редких мутантных генов и обусловливают резко аномальный ответ или идиосинкразию. Причиной разнообразия реакций может быть и полиморфизм. По всей вероятности, чаще всего экогенетические реакции определяются несколькими генами. Необычные ответные реакции проявляются у немногих людей, которые по своему генетическому статусу значительно отклоняются от моды распределения. 116 4 Действие генов
Канцерогены. Недавние исследования, проведенные на бактериальных системах (разд. 5.2.2), позволяют предполагать, что большинство мутагенов являются одновременно канцерогенами. Вероятно, принципы фармакогенетики справедливы и для потенциально канцерогенных веществ. Тот факт, что у большинства людей при действии химических агентов или других раздражителей рак обычно не развивается, можно отчасти объяснить генетическими механизмами. Неоплазии возникают только у людей с отклонениями в метаболизме, например в организме которых данное вещество медленно инактивируется или превращается в еще более канцерогенное. Генетические варианты ферментов репарации (разд. 5.1.6.3) или иммунного надзора в мутантных клетках также могут приводить к раковым заболеваниям. Под действием ферментативной системы арилгидроксилазы полициклические углеводороды в организме человека могут превращаться в более мощные канцерогены. Данные близнецового и семейного анализа показывают, что уровень этого фермента контролируется генетически. Точный механизм пока не установлен, хотя высказывались предположения, что у человека наследование моногенное [1160], как и у мышей в случае аналогичной ферментативной системы [1235]. Однако более вероятно, что это полигенный признак [1235; 1026]. Так или иначе, люди с высокоактивной арилгидроксилазой, вероятно, более подвержены риску раковых заболеваний, индуцированных полициклическими углеводородами, например раку легких в результате курения [1161; 1068]. Совсем недавно для лимфоцитов человека описан генетический полиморфизм по глутатионредуктазе [1296]. Этот фермент играет важную роль в биологическом превращении и детоксификации различных эндогенных и поступающих извне соединений. В исследованной выборке, состоящей из 248 человек, обнаруживалось четкое тримодальное распределение. 133 человека обладали низкой, 94 - высокой, и 21 - очень высокой ферментативной активностью. Данные, полученные при обследовании 8 семей, можно было объяснить простым аутосомным кодоминированием. Вполне возможно, что люди с высокой активностью фермента в печени лучше защищены от вредного воздействия химически активных соединений. Метаболизм конкретных соединений изучен еще недостаточно, чтобы с уверенностью можно было говорить о влиянии генетических вариаций у человека на канцерогенные эффекты факторов среды. К числу механизмов канцерогенеза, возможно, следует отнести и полиморфизм по ферментам репарации. Больные генетическими нарушениями систем, репарирующих мутации (анемия Фанкони, синдром Блума, атаксия-телеангиэктазия, пигментная ксеродерма), часто заболевают различными формами рака. Интересно, что среди гетерозиготных носителей этих заболеваний (их довольно много в человеческих популяциях) частота заболевания раком тоже повышена, но гетерозиготность по пигментной ксеродерме становится фактором риска лишь после воздействия мощного солнечного излучения (разд. 4.2.2.8). Поскольку многие формы рака связаны, по-видимому, с факторами среды, воздействию которых подвергается большинство населения, именно генетический подход может объяснить, почему заболевание развивается только у некоторых людей. Недавно было предпринято исследование полиморфизма по окислению лекарственных препаратов типа дебрисохин/спартеин. Изучали 245 больных раком легких и 234 контрольных курильщика (рис. 4.69). Изначально предполагалось, что в организме людей, способных к быстрому окислению, может происходить более полная инактивация канцерогенных веществ табачного дыма. Полученные результаты свидетельствуют в пользу этого предположения: среди больных раком оказалось меньше «медленных окислителей» (т. е. людей, у которых обе копии гена были представлены полиморфными вариантами), чем в контроле (1,9% против 9% в контроле). Более того, распределение «быстрых окислителей» (т. е. нормальных гомозигот и гетерозигот по этому гену) среди больных раком сдвинуто таким образом, что позволяло предполагать более высокую частоту гомо- 4 Действие генов 117
зигот по гену, определяющему быстрое окисление. Действительно, 77% раковых больных оказались гомозиготами по этому гену и 22%-гетерозиготами, тогда как в контроле эти частоты составили соответственно 49 и 42% (больные с раком легких р2 = 0,016, 2 pq = 0,22, q2 = 0,77, контрольная выборка: р2 = 0,09, 2pq = 0,42, q2 = 0,49). Хотя приведенные данные позволяют предполагать наличие генетического контроля этого полиморфизма, не исключено, что результаты исследований (т.е. гидроксилирование дебрисохина в печени и выделение продукта реакции с мочой) искажаются самим ходом ракового заболевания. Поэтому для окончательного вывода о наследственной природе полиморфизма необходим семейный анализ. Рак мочевого пузыря эпидемиологически может быть связан с действием аминов, производимых химической промышленностью. Было проведено 7 исследований корреляции полиморфизма по ацетилированию и рака мочевого пузыря у 633 больных и соответствующей контрольной выборки [1268]. В целом, по данным этих исследований риск заболеть раком у «медленных инактиваторов» лишь в 1,3 раза выше. Из этого следует, что скорость ацетилирования играет незначительную роль в развитии рака мочевого пузыря, связанного с канцерогенностью неацетилированных аминов. 118 4. Действие генов
Сообщение о том, что у курильщиков, больных раком мочевого пузыря, котинина выделяется значительно больше, чем никотин-1- н -оксида, требует подтверждений. Однако достаточно интересно само предположение о том, что дефекты метаболизма никотина связаны с риском рака мочевого пузыря. Недостаточность α1- антитрипсина (10740). Недостаточность α1-антитрипсина обусловлена Z-аллелем в гомозиготном состоянии и вызывает предрасположенность к ранней обструкции дыхательных путей. У гетерозигот по этому признаку функция легких несколько нарушена. Возможно, что на частоту заболеваемости у гетерозигот влияют также степень загрязнения окружающей среды и курение [1095; 653]. Параоксоназа [1231]. Широко используемый инсектицид - паратионин - превращается в печени в параоксон, который далее окисляется параоксоназой сыворотки. У европейцев наблюдается четкое бимодальное распределение уровня активности фермента, причем у 50% населения этот фермент имеет низкую активность. Семейный анализ показал, что лица, имеющие низкую активность параоксоназы, являются гомозиготами по аллелю, кодирующему низкоактивный фермент (его частота в популяции 0,7). Сложнее отличать гомозигот с высокоактивным аллелем от гетерозигот. Эпидемиологические данные о значении этого полиморфизма для людей, подвергшихся действию паратионина, в настоящее время отсутствуют. Можно предполагать, что при низких дозах паратионина более высокий риск отравиться имеют гомозиготы. Если дозы большие, генотип не сказывается на проявлении симптомов. Продукты питания. Наиболее ярким примером генетических различий в реакции на пищевые продукты является гиполактазия у взрослых. У всех детей в кишечнике имеется фермент лактаза, необходимый для всасывания лактозы. У большинства людей кишечная лактаза исчезает после того, как прекращается кормление грудным молоком, поэтому большинство взрослых являются толерантными к лактозе. Существует мутация, при которой способность всасывать лактозу сохраняется. Естественно, она имеет селективное преимущество в сельскохозяйственных районах, где молоко - обычный продукт питания. В Центральной и Северной Европе большинство людей имеют такой мутантный ген в количестве одной или двух копий. Утрата гена приводит к неусвоению лактозы, это состояние наследуется как аутосомный рецессивный признак. Мутация, при которой всасывание лактозы сохраняется, распространена также в Африке и в Азии в некоторых популяциях, члены которых занимаются скотоводством и ведут кочевой образ жизни. Вопрос о частотах генов, ответственных за сохранение лактазы, будет обсуждаться в разд. 7.3.1. При употреблении в пищу молока или других продуктов, содержащих лактозу, люди, не способные к ее усвоению, страдают метеоризмом, кишечными расстройствами и диареей [1285]. Целианическая болезнь является генетическим дефектом, при котором чувствительность к клейковине приводит к нарушению всасывания в кишечнике [1323]. Если подобрать диету без клейковины, патологические симптомы исчезают [1059]. У некоторых людей, мутантных по G6PD, при употреблении в пищу бобов развивается гемолитическая анемия [1079]. Для больных фавизмом характерно снижение уровня α-глутаровой кислоты, выделяющейся с мочой [1031], это может быть связано с биологическим превращением токсического вещества, содержащегося в бобах. Генетический механизм, лежащий в основе выделения глутаровой кислоты, в настоящее время неизвестен. Вообще говоря, гетерозиготность по аутосомно-рецессивным генам, которые в гомозиготном состоянии вызывают наследственные метаболические заболевания, заслуживают большего внимания исследователей. Такая гетерозиготность является источником генетических вариантов, различающихся по чувствительности к действию факторов среды. Отрывочные сведения, имеющиеся в настоящее время, позволяют предполагать, что чувствительность к различным факторам распространена значительно сильнее, 4. Действие генов 119
чем считалось ранее. По фенотипу гомозигот и природе ферментативных дефектов можно предсказывать, каким образом заболевание должно проявляться у гетерозигот. Характер питания в западных странах (высокое содержание жиров в пище), по мнению большинства специалистов, способствует развитию ишемической болезни сердца [1247]. Обнаружено несколько аутосомных доминантных генов, контролирующих метаболизм липидов; они обусловливают семейную гиперхолестеринемию, семейную триглицеридемию и семейную комбинированную гиперлипидемию [1109] (разд. 3.8.14.2). Представляется маловероятным, что частота семейной гиперхолестеринемии (приблизительно 1/500 в США) обусловлена характером пищи, поскольку уровни холестерина очень близки у японцев, больных гиперхолестеринемией, у европейцев и африканцев [1206], тогда как средний уровень холестерина в популяциях Японии значительно ниже. Гены, ответственные за наследственную гипертриглицеридемию и комбинированную гиперлипидемию, вообще не экспрессируются до 25 лет [1109]. Возможно, характер питания увеличивает частоту этих заболеваний. Влиянию диеты могут быть подвержены и еще неидентифицированные гены (полигены), которые участвуют в определении уровня холестерина, но не являются родственными главным генам. В настоящее время вопрос о влиянии диеты на работу всех этих генов интенсивно изучается. Ген гемохроматоза характерен для ряда популяций в Европе [1010]. Гомозиготы, способные быстро поглощать железо, составляют приблизительно 1/500 популяции, однако симптомы заболевания развиваются лишь у немногих гомозигот. Дети и женщины часто страдают от недостатка железа в организме. В Швеции практикуется добавление соединений железа в хлеб. Это должно приводить к более частому и более раннему проявлению гемохроматоза. Вероятно, добавление железа в хлеб не наносит вреда гетерозиготам, которые весьма многочисленны и составляют 10% популяции. Страдать в этих условиях будут больные тяжелой формой талассемии, у которых и без того повышен уровень железа. Поэтому в ряде стран такая тактика не получила распространения, хотя, несомненно, она позволила бы снизить число случаев недостаточности железа. Эти соображения показывают, насколько сложные общественные проблемы могут быть связаны с генетической гетерогенностью популяции. То, что полезно для одной части популяции, для другой оказывается вредно. Более того, соотношение вреда и пользы не всегда поддается точной научной оценке. Вероятно, с развитием наших знаний о генетической вариабельности мы будем сталкиваться со все новыми подобными проблемами. Дата добавления: 2015-12-16 | Просмотры: 1092 | Нарушение авторских прав |