|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Выявление гетерозиготВыявление гетерозигот по ФКУ и гиперфенилаланинемии. Для заболеваний, связанных с нарушением метаболизма (в частности, ФКУ), выявление гетерозигот имеет не только теоретическое, но и практическое значение, поскольку может быть использовано для генетических рекомендаций близким родственникам, например сибсам, родители которых страдали ФКУ. Сибсы, не имеющие признаков заболевания, с вероятностью 2/3 являются гетерозиготами. Идеальный метод выявления гетерозиготпрямой анализ фермента, для которого в настоящее время необходима биопсия печени. Другие методы основаны на целенаправленной перегрузке этого метаболического пути: даже имеющейся у гетерозиготы активности фермента достаточно для переработки фенилаланина, в норме потребляемого с пищей, ее может не хватить для переработки избытка фенилаланина. Первую попытку тестирования гетерозигот с помощью избытка фенилаланина предпринял в 1967 г. Хсиа [1134]; он вводил фенилаланин гетерозиготам и следил за его исчезновением в крови. Оказалось, что гетерозиготы довольно четко отличаются от нормальных индивидов. Позднее этот метод удалось усовершенствовать, измеряя в крови не только уровень фенилаланина, но и тирозина, который, как установлено, у гетерозигот несколько ниже. Состояние здоровья у гетерозигот. На первый взгляд гетерозиготные родители больных ФКУ, а также их братья и сестры абсолютно здоровы. Пенроуз [1262], однако, обнаружил в семье больных ФКУ у шести родственников особый вид психического заболевания депрессивного типа, которое проявлялось после 50 лет. Он предположил, что для гетерозигот характерен повышенный риск заболевания психическими расстройствами. Однако в течение последних 50 лет проблеме возможных аномалий и подверженности заболеваниям у гетерозигот по ФКУ уделялось пора- 54 4. Действие генов
зительно мало внимания, и немногие исследования, посвященные этой проблеме, часто не адекватны с точки зрения эпидемиологии. Этот вопрос рассматривается в недавнем обзоре [1340]. Особенности, выявляемые у гетерозигот по ФКУ, подразделяются на 4 основных типа: отклонения по IQ и другим психологическим тестам; повышенный риск психических заболеваний; отклонения от нормы в электроэнцефалограмме (ЭЭГ), нарушение процессов размножения. Первые три аспекта будут подробно рассмотрены в разд. 8.2.3.2, посвященном генетике поведения; здесь отметим лишь, что большинство гетерозигот психически здоровы, однако для них высок риск заболеть шизофренией определенного типа, развивающейся в позднем возрасте. Описано небольшое снижение IQ (особенно в отношении устной речи), довольно часто выявляются отклонения в ЭЭГ. Согласно некоторым данным (вызывающим сомнение), для гетерозиготных по ФКУ женщин повышен риск спонтанных абортов и мертворождений. Заслуживают внимания отдельные сообщения об аномально высоком уровне фенилаланина крови у гетерозигот в стрессовых ситуациях, таких как грипп с высокой температурой [1008] или беременность. Специалистами в области экогенетики было выдвинуто интересное предположение, что аспартам, подслащивающее вещество с высоким содержанием фенилаланина, может наносить вред развивающимся эмбрионам у гетерозиготных женщин. (См. обсуждение материнской гиперфенилаланинемии в разд. 9.1.) Приведенные здесь данные, касающиеся гетерозигот по ФКУ, пока нельзя считать доказанными. Обследование нескольких сотен детей с небольшим умственным отставанием и отклонениями в поведении показало наличие среди них индивидов с повышенным уровнем фенилаланина в крови [1125]. Для проверки этих данных необходимы дополнительные исследования. Если факты подтвердятся, можно будет с уверенностью сказать, что уменьшенная активность фермента у гетерозигот делает их более подверженными определенным стрессовым ситуациям: этот феномен необходимо изучать. Общие проблемы выявления гетерозигот. Впервые важность выявления и изучения гетерозигот для медицинской генетики отметил в 1949 г. Нил [1236]. Им были систематизированы имевшиеся в то время разрозненные данные. Позже (в 1953 г.) появились более полные работы Нила [1237] и (в 1954 г.) Франческетти и Клайна [1084]. Быстрое развитие биохимической генетики сделало возможным выявление гетерозиготных носителей многих болезней, особенно тех, которые обусловлены дефектами ферментов, выявляемых в фибробластах или клетках крови (табл. 4.10). Как правило, активность ферментов у гетерозигот снижена приблизительно вдвое по сравнению с нормальными гомозиготами, однако во многих случаях четкую грань между этими двумя группами провести невозможно. Некоторые индивиды демонстрируют промежуточные характеристики даже при прямом измерении активности фермента. Это неудивительно, если принять во внимание, что разные мутации в составе одного и того же локуса вызывают изменения активности фермента различных типов. Выявление гетерозигот важно не только для изучения механизма действия ферментов, оно имеет очень большое практическое значение. Установление факта гетерозиготности очень существенно для людей, у которых близкие родственники страдают болезнями, детерминируемыми Х-хромосомой или аутосомно-рецессивными болезнями. Например, сыновья женщин, гетерозиготных по Х-сцепленному заболеванию, с вероятностью 50% наследуют эту болезнь. Для большинства аутосомно-рецессивных болезней выявление гетерозигот не играет столь важной роли, если только потенциальные гетерозиготыбратья или сестры больного гомозиготного индивида - не собираются жениться на двоюродных родственниках. Риск появления гомозиготных детей имеется только в том случае, когда будущие родители оба гетерозиготны, а для большинства рецессивных заболеваний вероятность случайной встречи таких гетерозигот чрезвычайно мала (см. закон Харди-Вайнберга, разд. 3.2). Выявление гетерозигот - необходимый этап при обследовании популяций. Уста- 4. Действие генов 55
новлено, например, что около 8% негритянского населения Америки - гетерозиготны по гену серповидноклеточной анемии и около 3-4% евреев-ашкенази являются гетерозиготами по гену болезни Тея-Сакса. Наиболее распространенным (1:2000) рецессивным заболеванием в Северной и Центральной Европе следует считать муковисцидоз. Гетерозиготы по нему составляют 4-5% всей популяции. Их выявление в этом случае очень желательно, поскольку велика вероятность обнаружения пар, в которых оба партнера несут ген муковисцидоза в гетерозиготном состоянии (не зная об этом). Потомство таких пар необходимо подвергать внутриутробному обследованию. К сожалению, основной биохимический дефект при этом заболевании неизвестен. Поиск гетерозигот и пренатальная диагностика значительно упростились после того, как ген, ответственный за это заболевание, с помощью тесно сцепленного маркерного фрагмента ДНК был локализован в 7-й хромосоме [1167; 1344а; 1357а]. Подверженность заболеваниям у гетерозигот по рецессивным состояниям. Отсутствие простого надежного способа выявления гетерозигот по муковисцидозу достойно сожаления еще и потому, что с его помощью можно было бы решить и другую серьезную проблему. В начале 60-х годов появилось сообщение, согласно которому гетерозиготные носители муковисцидоза имеют повышенный риск заболеть язвой желудка или двенадцатиперстной кишки, а также хроническим бронхитом [1170]. Последующие исследования как будто не подтвердили эти данные. Окончательно вопрос можно будет решить только после того, как в возрастной группе, особенно подверженной названным заболеваниям, будут учтены все гетерозиготы. Подобные исследования возможны только при наличии надежного теста на гетерозиготность. В разд. 3.7.4 обсуждалась недостаточность α1-антитрипсина как пример гомозиготного состояния, которое во многих случаях обусловливает подверженность хроническим обструктивным болезням лег- 56 4 Действие генов
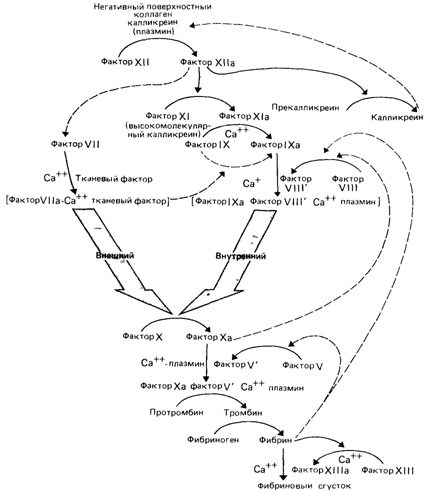
ких. Опасность заболеть увеличивается при соприкосновении с определенными агентами окружающей среды, такими как табачный дым. Известно также, что гетерозиготы по серповидноклеточной анемии здоровы в нормальных условиях, но при умеренной гипоксии, например на высоте свыше 2500 м над уровнем моря, у них может возникнуть серповидноклеточная анемия и развиться инфаркт селезенки. Имеется много разрозненных данных [2340], касающихся других заболеваний. Например, у гетерозигот по различным липидозам наблюдается незначительное снижение IQ в сочетании с личностными расстройствами. У гетерозигот по цистинурии часто образуются камни в почках; гетерозиготы по галактокиназной недостаточности подвержены преждевременной катаракте; при некоторых разновидностях болезни Вильсона описаны нарушения функционирования почечных канальцев и незначительные неврологические изменения. Возможный риск развития рака был тщательно изучен для гетерозигот по пигментной ксеродерме, которая обусловлена нарушением эксцизионной репарации ДНК (разд. 5.1 6.3). Повышенный риск рака в сравнительно молодом возрасте был характерен для синдрома Блума и для атаксии-телеангиэктазии (но не для анемии Фанкони). Интересно отметить, что вероятность заболеть раком кожи для гетерозигот по пигментной ксеродерме повышена только на юге США, но не в других районах страны В данном случае налицо экогенетическая проблема: увеличение интенсивности УФ-излучения вызывает перегрузку эксцизионной системы репарации, которая вполне может справиться с низким уровнем УФ-излучения. Для того чтобы сделать обоснованный вывод о подверженности обычным болезням и о наличии небольших физиологических отклонений, требуются сложные статистические исследования и тщательный подбор контролей. Прежде всего необходимо обследовать большое количество гетерозигот, выявленных надежными биохимическими и генетическими методами. Изучение гетерозигот позволит глубже понять генетические условия, вызывающие обычные заболевания, и подойти к решению многих других проблем. Например, вариабельность, выявляемая при измерении IQ, в значительной степени может быть вызвана в популяции просто высокой частотой гетерозигот по рецессивным болезням (см. разд. 8.2.3.2). Если окажется, что повышенная чувствительность к заболеванию у гетерозигот является правилом, а не исключением, наши предсказания об увеличении мутационного груза, обусловленного ионизирующей радиацией и химическими мутагенами, придется в значительной степени пересмотреть. Таким образом, необходимы дальнейшие исследования в этом направлении. Особенно важно разрабатывать качественные тесты, позволяющие отличать гетерозигот от нормальных индивидов. Тестирование гетерозигот при гемофилии А(30670). Особое значение в генетической консультации имеет выявление гетерозиготных носителей в случае заболеваний, сцепленных с полом. Гемофилия А – одно из наиболее часто встречающихся заболеваний, детерминируемых Х-хромосомой (разд. 3.1.4). Она возникает в результате нарушения гуморального фактора, необходимого для первой стадии свертывания крови (рис. 4.27) - антигемофилического глобулина (фактор VIII). У нормальных индивидов активность этого белка в плазме варьирует от 40 до 300% относительно среднего значения в популяции, принятого за 100% [1277]. У больных гемофилией активность фактора VIII резко снижена или даже полностью отсутствует. Однако плазма большинства больных содержит вещество, которое реагирует с антисывороткой к фактору VIII. Судя по всему, в крови таких гемофиликов содержится антигемофилический глобулин, потерявший свою активность, но сохранивший иммунологические свойства в качестве перекрестно-реагирующего материала (ПРМ, англ. CRM разд. 4.2.2.2); концентрация такого белка - нормальная. У гетерозигот благодаря инактивации Х-хромосомы половина клеток продуцирует активный фактор VIII, способный обеспечить свертывание крови и проявлять специфические иммунологические свойства. Остальные клетки продуцируют ПРМ, сохраняющий иммунологические свойства, но утративший способность участвовать в свертывании крови. Таким образом, активность свертывания крови у 4. Действие генов 57
гетерозигот должна быть снижена приблизительно вдвое по сравнению с нормой. При иммунологическом определении, однако, будет выявляться нормальное количество антигемофилического 1лобулина, поскольку с антителами будут одновременно реагировать и активный белок, и ПРМ. До разработки иммунологического теста идентификация гетерозигот основывалась только на определении активности фактора VIII. Хотя средняя активность у гетерозигот действительно была низкой и составляла около 50%, сохранялось большое перекрывание между гетерозиготами и нормальными индивидами, сильно затруднявшее генетическую консультацию. Этот результат не удивителен, поскольку у здоровых людей способность к свертыванию крови варьирует в огромной степени. Серьезный прогресс стал возможен после введения в практику количественного иммунологического теста. Однако, прежде чем использовать этот метод, необходимо доказать наличие ПРМ в крови хотя бы одного больного гемофилией в обследуемой семье, поскольку существует разновид- 58 4. Действие генов
ность гемофилии А (острая), при которой ПРМ в крови отсутствует. A priori ясно, что не всякую гетерозиготную женщину можно выявить таким способом, поскольку вследствие случайной инактивации Х-хромосомы некоторые индивиды будут абсолютно нормальными по обоим тестам (иммунологическому и свертываемости). Совсем недавно для идентификации носителей гена гемофилии стали применяться усовершенствованные биохимические методы, в особенности определение компонентов молекулы фактора VIII; кроме того, стали более адекватными статистические методы, объединившие вероятностные оценки на основе изучения родословных и результаты лабораторных исследований [1111 а, б]. Обнаружение полиморфизма ДНК в гене фактора VIII открыло новые перспективы не только для выявления гетерозигот, но и для пренатальной диагностики. Здесь будет уместно заметить, что последние годы характеризовались впечатляющим прогрессом в исследованиях свертывания крови и его нарушений. Совместная работа различных белков, подчиненных сложному генетическому контролю, в процессе свертывания крови и растворения тромбов - это пример взаимодействия многих генетических факторов в выполнении сложной физиологической функции. Этот клубок удалось распутать в основном благодаря изучению крови больных с различными генетическими нарушениями свертываемости. Свертывание крови - это не простая и даже не просто разветвленная цепная реакция; в нее входят циклы обратной связи. Некоторое представление о системе свертывания крови дает рис. 4.27. Эта тема детально обсуждается в литературе [1111а, б; 1214]. Выявление гетерозигот по мышечной дистрофии Дюшенна [1119; 1221]. Определение носителей дефектного гена особенно важно с практической точки зрения при Х-сцепленной мышечной дистрофии Дюшенна (31020). Это тяжелое неизлечимое заболевание, которое неизбежно ведет к ранней смерти. Вот почему у женщин с высоким риском рождения больного мальчика беременность разумнее прекратить, если установлено, что эмбрион мужского пола. Из этого следует, что риск рождения больного и статус носителя должны быть определены с максимальной точностью. Для этого необходимо сочетание статистических и биологических методов (см. приложение 8). Среди биологических методов наиболее информативен метод измерения активности сывороточного фермента - креатинфосфокиназы. В норме этот фермент обнаруживается только в мышцах, и уровень его в сыворотке низок. Однако при нарушении мышечной ткани большое количество фермента попадает в кровь и активность его возрастает. У гемизиготных больных мужчин регистрируется очень высокий уровень креатинфосфокиназы. Лишь на последних стадиях болезни, когда разрушена уже большая часть мышечной ткани, он снижается. Около 70% женщин, достоверно являющихся гетерозиготными носителями (у которых по крайней мере один сын пораженный), имеют отчетливо повышенный уровень фермента в крови. Проблема диагностики осложняется тем обстоятельством, что нормальные индивиды и носители наиболее четко различаются лишь в детстве, а с возрастом уровень креатинкиназы падает и у здоровых, и в еще большей степени у гетерозигот. Падает он также и в ходе беременности. Помимо определения активности креатинкиназы было предложено много других способов выявления гетерозигот. Недавно с помощью методов ультрасонографии или компьютерного ультразвукового сканирования у носителей обнаружены значительные изменения в строении бедренных и икроножных мышц [1283]. В будущем значительную роль в более точной оценке риска, несомненно, будет играть анализ сцепления с ДНК-маркерами на основе технологии рекомбинантных ДНК [1358] (разд. 3.4.3). Заметим, однако, что дистрофия Дюшенна нередко проявляется в семье спорадически, т. е. возникает вследствие новых мутаций в половых клетках матери (разд. 5.1.3.4), что во многих случаях затрудняет анализ сцепления. Вот почему совершенно необходимо улучшать методы выявления носителей по их фенотипу. Мозео [1221] и Харпер [1119] выдвинули ряд полезных предположений для генетической консультации. 4. Действие генов 59
Трудности в выявлении гетерозигот. Если о гетерозиготности судят по уровню ферментативной активности или на основании какого-либо количественного анализа крови, часто возникают осложнения, связанные с перекрыванием значений. Методы поиска гетерозигот могут заметно различаться для носителей аутосомно-рецессивных или сцепленных с Х-хромосомой мутаций, с одной стороны, и для носителей гена аутосомно-доминантного заболевания, с другой. В большинстве случаев средние уровни анализируемого вещества у гетерозигот и у нормальных индивидов достоверно различаются. Однако при этом, как правило, имеет место значительное перекрывание выборочных распределений, так что многие здоровые люди по уровню анализируемого вещества могут быть ошибочно приняты за гетерозигот. Причины этого явления не вполне ясны, возможно, оно связано с существованием невыявленных «изоаллелей», каждый из которых определяет свой диапазон уровней ферментативной активности (разд. 3.6). При использовании количественных тестов для правильной интерпретации результатов важно оценить априорную (или байесовскую) вероятность гетерозиготности. В таблице 4.11, А в качестве примера показаны результаты ферментного анализа для острой перемежающейся порфирии. Это заболевание может проявляться у гетерозигот, но при скрининге популяции большую часть случаев повышения активности порфобилиноген-дезаминазы следует отнести к ложным гетерозиготам, поскольку реальная популяционная частота истинных гетерозигот составляет всего лишь 1:10 000. Для больного, среди родственников которого нет пораженных порфирией, но у которого некоторые клинические симптомы позволяют заподозрить это заболевание, априорную вероятность можно оценить только грубо. У брата или сестры достоверно больного априорная вероятность гетерозиготности составляет 50%. Вероятность того, что в таких случаях результаты обследования действительно свидетельствуют в пользу гетерозиготности, можно вычислить, исходя из априорного ожидания и степени перекрывания между здоровыми и гетерозиготами, которая должна быть определена по возможности точно (табл. 4.11, А, Б). Из этого вытекает необходимость организации централизованных лабораторий, где должно проводиться сравнительное обследование большого числа здоровых и гетерозигот и где можно было бы получить генетическую консультацию. Изучение уровня порфобилиноген-дезаминазы при острой перемежающейся порфирии показало, что значения активности этого фермента, характерные для 30% контрольной (т. е. нормальной) популяции, перекрываются со значениями, полученными на выборке несомненных гетерозигот, страдающих острой перемежающейся порфирией (1) (табл. 4.11). Только у 20% гетерозигот уровень фермента был ниже, чем у всех представителей контрольной популяции. Рассмотрим модельный случай, когда у людей различных групп установлена одна и та же активность фермента-95 единиц (табл. 4.11). В соответствии с априорными оценками вероятности (табл. 4.11, А) общая оценка вероятности носительства гена порфирии составит: а) 0,07% для человека из общей популяции без каких-либо симптомов; б) 7% для человека с 1%-ным риском; в) 44% для лиц с 10%-ным априорным риском и г) 87% для близкого родственника больного с 50%-ным риском. Эти данные показывают значительную неопределенность диагноза в том случае, когда не может быть получена надежная априорная оценка вероятности заболевания. Надо отметить, что повторные измерения не всегда делают окончательную оценку более точной. При очень низких и очень высоких уровнях фермента интерпретация отличается, если, как в нашем примере, для большого числа нормальных и гетерозиготных особей известны уровни активности фермента. В отличие от количественных оценок, которые, как правило, неоднозначны, качественная аномалия по закону «все или ничего», выявленная биохимически или с помощью рекомбинантных ДНК, позволяет поставить четкий диагноз независимо от априорных вероятностных оценок. 60 4. Действие генов
4 Действие генов 61
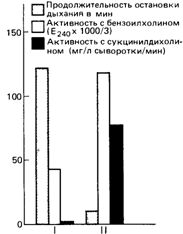
4.2.2.9. Лечение наследственных метаболических заболеваний [1289; 1057; 1058] Общие принципы. В прошлом констатация наследственного характера признака подразумевала, что такой признак нельзя изменить путем внешних воздействий. Поэтому считалось, что наследственные болезни невозможно лечить. Многие врачи и психиатры полагали, что роль генетики в развитии медицины незначительна. Ошибочность подобной точки зрения становится ясной при изучении врожденных дефектов метаболизма. Наши возможности повлиять на заболевание или на аномалию поведения зависят часто не от того, наследуются они или нет, а от глубины наших знаний о механизмах развития патологии. Повлиять на наследуемые признаки можно в принципе на всех уровнях действия гена. Теоретически, наиболее полным было бы воздействие на уровне генетического материала - ДНК. Впервые перенос ДНК неполовым путем с помощью бактериофага (или другими способами) был продемонстрирован для бактерий. В настоящее время такой перенос становится возможным для высших организмов, включая клетки человека. Методы генной инженерии привлекли внимание широкой общественности, однако без достаточных оснований акцент в публикациях делался на клонировании и создании искусственных людей. В результате многие были напуганы последствиями генетических исследований человека вообще. В действительности же генная терапия некоторых менделирующих заболеваний в будущем может стать очень эффективной. В таком случае она займет достойное место в ряду различных терапевтических средств. Эту тему мы более подробно обсудим дальше, в разделе 9.2, посвященном генетическому будущему человечества. В некоторых случаях, вероятно, проще заменить не сами гены, а их непосредственные продукты, мРНК. В настоящее время примеры удачного применения такого подхода неизвестны. Значительно дальше исследователи продвинулись в попытках заместительной терапии с использованием ферментов или других белков. Часто метаболические последствия генетического блока удается преодолеть путем соответствующего воздействия извне. Классический пример такого подхода - лечение фенилкетонурии диетой с ограниченным содержанием фенилаланина - обсуждался в разд. 4.2.2.7. В других случаях клинические последствия связаны не с накоплением метаболитов, предшествующих блокированному этапу, а с отсутствием метаболита, следующего после него. В такой ситуации может оказаться полезным добавление к пище отсутствующего метаболита. Наконец, возможно успешное лечение многочисленных вторичных последствий генетических заболеваний от исправления нарушений эндокринной регуляции, вызванных блоком синтеза гормонов, до переливания крови при наследственной анемии. Краткая сводка существующих терапевтических возможностей приведена на рис. 4.28. Ниже будут рассмотрены многочисленные примеры. Более полный обзор дан в [1058]. Заместительная белковая или ферментная терапия. Классический пример лечение гемофилии А. Фактор VIII при активности в 30-40% от средней для нормы останавливает кровотечение. Такой уровень активности может быть достигнут инъекциями этого фактора. Его концентрат готовят из крови человека. Доступность концентрата сделала возможным лечение кровотечений в домашних условиях; больные гемофилией могут вести почти нормальную жизнь. Проблемы возникают в связи с тем, что для приготовления достаточных количеств требуемого препарата необходимо большое количество донорской крови [428]. В настоящее время уже сделаны первые и решающие шаги, направленные на получение чистых препаратов фактора VIII методами генетической инженерии: соответствующий ген уже клонирован, достигнута его экспрессия (в составе плазмиды) в культуре трансформированных клеток. Другим примером может служить лечение препаратами псевдохолинэстеразы больных с нарушенной активностью этого фермента [1105]. Отметим два благоприят- 62 4 Действие генов
ных фактора, облегчающих коррекцию данной патологии 1 Недостаточность псевдохолинэстеразы не оказывает вредного воздействия в нормальных условиях, профилактическое лечение требуется только тогда, когда больному вводят мышечные релаксанты, т е при серьезных операциях 2 После инъекции нормальной плазмы активность фермента уменьшается в два раза в течение 12 часов Таким образом, для проведения операции достаточно одной инъекции При первых попытках лечения в качестве источника фермента использовали плазму здорового человека, но вскоре стало очевидно, что очищенные препараты фермента обладают явными преимуществами Как показано на рис 4 29, необходимый уровень фермента поддерживается достаточно долго после инъекции и нормализует длительность релаксации мышц Ферментная терапия других наследственных заболеваний пока не вошла в каждодневную врачебную практику, хотя предварительные исследования оказались довольно успешными, например в случае болезни Гоше, при которой внутривенно вводили недостающую глюкоцереброзидазу (23080, [1056]) Как правило, заместительная терапия при заболеваниях, вызванных ферментной недостаточностью, требуется в течение всей жизни В связи с этим возникают следующие проблемы 4 Действие генов 63
а) фермент удаляется из организма довольно быстро, необходимо постоянное поддержание его уровня; б) если вводимый фермент будет воспринят иммунной системой как чужеродный белок, антитела сделают инъецируемый материал биологически неэффективным. Существуют различные способы преодоления подобных препятствий. Для получения ферментов, которые синтезируются в клетках человека и потому являются наиболее предпочтительными для терапии, необходимы очень большие объемы клеточных культур. Источником ферментов может служить также плацентарный материал. Ферментативный дефект при мукополисахаридозе типа Хурлера (разд. 4.2.2.3) удается временно компенсировать переливанием лейкоцитов [1168], а при болезни Хантера пациентам имплантируют культивированные in vitro фибробласты близких родственников [1052]. В обоих случаях достигается временное снижение количества накопленного метаболита. Недавние достижения в этой области подробно обсуждаются в других обзорах [1057; 1058]. Если фермент вводить в составе полупроницаемых микрокапсул, доступ к нему возможных антител будет затруднен, в то время как субстрат, молекулы которого обладают обычно гораздо меньшей молекулярной массой, сможет проникнуть внутрь капсулы [983]. Для ферментов, поглощаемых клетками, таких, как ферменты лизосом, которые участвуют в катаболизме гликозаминогликана (разд. 4.2.2.3), можно применять внутривенное введение без использования капсул. В заключение отметим, что заместительная терапия при заболеваниях, вызванных дефектами ферментов, не всегда возможна и эффективна. Более плодотворным нам представляется подход, который подразумевает воздействие на метаболические последствия ферментативных дефектов. Изменение факторов внешней среды удаление метаболита перед блокированным этапом. Метаболит, являющийся субстратом дефектного фермента и накапливающийся перед блокированным этапом метаболического пути, достаточно просто удалить, если он не синтезируется в организме, а поступает с пищей. Мы уже говорили об этом в случае фенилкетонурии. В качестве другого примера можно привести галактоземию, которая возникает из-за недостаточности одного из трех ферментов, превращающих галактозу в глюкозу. При этом заболевании удалить накапливающийся субстрат проще, поскольку галактоза содержится почти исключительно в молоке. Проблема усложняется, если вредный метаболит нельзя удалить, не нарушив тем самым нормальной функции организма. В некоторых случаях субстрат дефектного фермента в норме образуется непосредственно в организме. В качестве примера можно опять привести мукополисахариды: они постоянно синтезируются и нужны для многих структурных элементов организма. В такой ситуации небольшое снижение синтеза может замедлить развитие заболевания, а иногда даже помочь 64 4. Действие генов
организму справиться с ним благодаря использованию остаточной активности фермента или альтернативного метаболического пути. Описаны случаи, когда нарушение ферментативной активности фенотипически проявляется не в накоплении метаболита перед блокированным этапом, а в отсутствии метаболита после него. Изменение факторов внешней среды: замещение метаболита после блокированного этапа. Терапия такого типа широко применяется при нарушениях синтеза гормонов. Этой теме посвящено несколько недавних обзоров [171; 1288; 1243]. Упомянем также болезни накопления гликогена (типы I и III). В этом случае большая часть клинических симптомов обусловлена не собственно накоплением гликогена, а невозможностью его расщепления до глюкозы, что ведет к хронической гипогликемии. Лечение внутривенными инъекциями глюкозы столкнулось бы с непреодолимыми трудностями и, кроме того, привело бы к еще большему накоплению гликогена. Поэтому было предложено хирургическое вмешательство с целью формирования пути, позволяющего крови миновать печень; в результате поступающая из кишечника кровь содержит глюкозу в достаточной концентрации. Создание шунта между портальной и нижней полой венами позволяет большей части крови миновать печень и транспортировать глюкозу непосредственно к сердечной мышце и к другим органам. После этой операции в состоянии больных наблюдается явное улучшение [1131]. Другим примером может служить оротовая ацидурия, описанная в разд. 4.2.2.4. Избыток оротовой кислоты сам по себе не вызывает заметных вредных последствий, однако, недостаток уридинсодержащих соединений приводит к нарушению синтеза нуклеиновых кислот, что влечет за собой мегалобластную анемию и, кроме того, серьезную задержку роста. Добавлением уридина к пище удается восполнить недостаток метаболита и предотвратить проявление клинических симптомов заболевания.
Удаление метаболита, предшествующего блокированному этапу, и добавление метаболита, следующего за блоком. При заболеваниях, связанных с накоплением гликогена, повышение концентрации глюкозы (которая образуется в блокированной реакции благодаря тому, что кровь частично минует печень) приводит одновременно к уменьшению накопления гликогена. При других болезнях клинические симптомы обусловлены обоими механизмами, что приводит к усложнению терапии. Примером может служить гомоцистинурия [23620], причиной которой является нарушение цистатионин - синтазы (рис. 4.30). Гомоцистеин образуется из метионина, поступающего с пищей. Поэтому необходимо уменьшить количество потребляемого метионина. Но поскольку метионин, как и фенилаланин, принадлежит к числу незаменимых аминокислот, его нельзя полностью исключить. Важно также, что в нормальных условиях из метионина образуется цистеин (рис. 4.30). Для гомоцистинурии характерно большое число симптомов. Многие из них вызваны недостатком цистеина; поэтому диета включает повышенное количество цистеина. При другом типе гомоцистинурии помогают терапевтические дозы витамина В6, который является коферментом цистатионин - синтазы. Лечение путем устранения побочных эффектов метаболических заболеваний. В настоящее время большинство наследственных болезней, поддающихся лечению, лечат именно этим способом. При таком подходе не требуется точного знания патофизиологических и генетических механизмов. Например, мы почти ничего не знаем о биохимических причинах полидактилии, «заячьей губы» или «волчьей пасти». Но это не мешает успешно оперировать таких больных. Очень мало известно о биохимических основах психических болезней (разд. 8.2.3.6). Тем не менее для лечения больных, страдающих шизофренией или эмоциональными расстройствами, оказалось возможным подобрать чисто эмпирическим путем вполне адекватный способ медикаментозного лечения. Во всех областях медицины большая часть методов 4. Действие генов 65
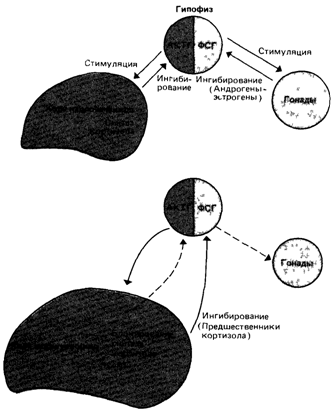
лечения (включая успешные) основана на эмпирических выводах независимо от того, каким в действительности является вклад генетической компоненты в развитие заболевания. В настоящее время наши возможности лечения наследственных болезней не очень велики [1045]. Впрочем, этот вывод можно отнести к большинству заболеваний. Главная цель медико-биологических исследований - терапевтическое вмешательство, основанное на детальных знаниях патофизиологических механизмов. В качестве примера приведем группу адреногенитальных синдромов, обусловленных дефектами ферментов, участвующих в синтезе стероидных гормонов надпочечников. Установлено, что при нарушении синтеза кортизола (17-оксикортикостерона) блокирована нормальная обратная связь, подавляющая образование АКТГ в гипофизе, который стимулирует образование в большом количестве 17-кетостероидов из 17-оксипрогестерона. Кетостероиды в свою очередь стимулируют развитие половых признаков и ведут к маскулинизации больных женщин. Добавление кортизола восстанавливает цикл обратной связи, снижается образование АКТГ и, вследствие этого 17-кетостероидов, что предотвращает маскулинизацию (рис. 4.31). Диета при болезнях метаболизма и общий генотрофический принцип. При многих болезнях метаболизма фенотипических последствий ферментативного дефекта можно избежать, если соответствующим образом изменить диету. Только в силу редкости подобных состояний их относят к патологии: если бы подобные ферментативные нарушения обнаруживались у большей части населения, мы изменили бы соответственно свои привычки в еде, и то, что сейчас считается дефектом, рассматривалось бы как норма. Примером может служить сниженное всасывание лактозы, содержащейся в молоке, характерное для большинства лиц восточного происхождения, негров и многих европейцев. Потребление больших количеств молока и молочных продуктов вызывает у таких дефектных по лактазе больных метеоризм и чрезмерно повышенную перистальтику. У большинства людей, происходящих с северо-запада Европы, такие проблемы не возникают, поскольку уровень лактазы у них достаточно высок (разд. 7.3.1; [1924; 1922]). В разд. 4.2.2.5 были описаны патологические состояния, вызванные нарушениями всасывания, переработки и утилизации предшественников коферментов (витаминов). Эти болезни можно лечить необычно высокими дозами конкретных витаминов. Однако с эволюционной точки зрения даже нормальная потребность в витаминах может рассматриваться как множественная 66 4 Действие генов
генетически обусловленная недостаточность, поскольку и Neurospora crassa, и Е coli способны синтезировать практически все витамины. L-аскорбиновая кислота (витамин С) играет роль мощного восстановителя в метаболизме млекопитающих и синтезируется почти всеми видами, за исключением человека, высших приматов и морских свинок Люди нуждаются в постоянном «лечении с помощью замещения», которое, к счастью, обеспечивается нормальным питанием Однако в исключительных ситуациях, например, в дальних плаваниях прошлых столетии, когда пища не содержала достаточного количества витамина С, развивалась цинга. Другие метаболические пути, утраченные в ходе эволюции,-это пути синтеза так называемых, незаменимых аминокислот Для некоторых бактерий и грибов эти незаменимые для нас аминокислоты таковыми вовсе не являются, а могут синтезироваться из простых источников азота, таких как аммиак До сих пор мы рассматривали диетическое лечение в основном редких, наслед- 4. Действие генов 67
ственных вариантов с ярко выраженными эффектами. Однако даже при простом измерении концентрации фенилаланина в сыворотке, кроме крайних, классических случаев ФКУ, обнаруживаются случаи легкой гиперфенилаланинемии. Для поддержания «нормального» в обычном понимании этого слова развития таким людям не нужно придерживаться специальной диеты. Однако имеются данные, указывающие на несколько повышенную подверженность болезням гетерозигот, у которых снижена активность фенилаланингидроксилазы. Если это подтвердится, можно будет сказать, что такая чувствительность зависит от количества избыточного фенилаланина, остающегося после удовлетворения нужд синтеза белка. В разд. 6.1.2 мы обсудим генетический полиморфизм. Установлено, что треть всех находящихся в крови человека ферментов встречается в различных молекулярных формах, часто с неодинаковой активностью. Это означает, что метаболические пути слегка отличаются у разных индивидов (за исключением однояйцевых близнецов), т.е. человек «биохимически индивидуален» [225]. Одна из особенностей такой индивидуальности заключается в том, что для оптимального развития пищевые потребности разных людей могут слегка отличаться. Этот «генотрофический принцип» является частью взаимной адаптации индивида, его конкретной генетической конституции и окружающей его среды. Дата добавления: 2015-12-16 | Просмотры: 1022 | Нарушение авторских прав |