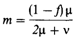|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Возможные различия частот возникновения мутаций у индивидов разного полаЕсли большинство мутаций зависит от клеточных делений и репликации ДНК, то следует ожидать не только роста частоты мутаций в мужских половых клетках с увеличением возраста мужчин, но и абсолютно более высокой частоты мутаций у мужчин по сравнению с женщинами. Мужская половая клетка претерпевает намного больше клеточных делений, чем женская (см. рис. 5.15 и 5.16). В случае доминантных мутаций у человека это предположение не поддается прямой проверке, так как мы не можем определить, где возникла та или иная отдельная мутация, проявляющаяся в фенотипе «спорадического» больного,-в мужской или в женской зародышевой клетке. Однако для мутаций, сцепленных с Х-хромосомой, такая проверка возможна. Для трех Х-сцепленных болезней - гемофилии А, синдрома Леша—Найхана и мышечной дистрофии Дюшенна - имеется достаточный фактический материал; анализ данных по каждому из этих заболеваний привел, однако, к противоречивым результатам. Различия частот мутаций у индивидов разного пола в случае гемофилии А. Холдейн [1474] был первым, кто, анализируя данные о случаях гемофилии, полученные в одном популяционном исследовании, проведенном в Дании [557], постулировал, что частота мутаций в мужских половых клетках выше, чем в женских. Согласно Ходцейну [1472], определенная часть (т) всех носителей Х-сцепленного рецессивного аллеля
5 Мутации 179 должна быть представлена сыновьями матерей, гомозиготных по нормальному аллелю, т. е. (при наличии генетического равновесия) индивидами, болезнь которых возникла вследствие мутации de novo, произошедшей в половых клетках их матерей. Мутации в зародышевых клетках матерей должны приводить к появлению спорадических случаев заболевания, т. е. к появлению больных, являющихся единственными гемофиликами среди своих братьев и сестер. Однако, принимая во внимание статистические соображения, следует ожидать, что некоторое число изолированных случаев болезни будет встречаться даже в ситуации, когда все матери гетерозиготны (см. разд. 3.3.4; приложение 3). Если же еще возникают мутации de novo, доля таких случаев будет больше. Эту долю т можно оценить из посемейных данных; можно также проверить «нулевую гипотезу» о том, что эти данные не обнаруживают достоверного отклонения от ожидаемых в ситуации, когда все гемофилики - сыновья гетерозиготных матерей. Однако, чтобы избежать неконтролируемых смещений при выявлении сибств только с одним и более чем одним больным, надо всякий раз, когда это возможно, определять частоту мутантных мужчин в серии семей, отобранных в ходе полного (усеченного) отбора (разд. 3.3.4). Последнее означает, что в пределах определенного временного интервала выявлены все живущие в данной популяции гемофилики и их семьи. В случае гемофилии и других сцепленных с полом рецессивных болезней такие исследования должны ограничиваться мальчиками и семьями, родословные которых не дают доказательств гетерозиготности матерей. В литературе мы нашли четыре серии данных, удовлетворяющих условиям, необходимым для достаточно точного и полного выявления указанных случаев [1671]. В этих сериях не обнаруживается никакого излишка спорадических случаев над ожидаемым для ситуации, когда все матери гетерозиготны. Это означает, что рассматриваемые данные согласуются с гипотезой о том, что все или почти все мутации de novo происходят в мужских половых клетках (табл. 5.13), если справедливо предпо-
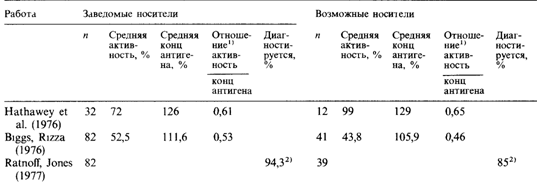
ложение о существовании генетического равновесия между мутационным процессом и отбором или если потеря аллелей, обусловленная отбором против гемофиликов, компенсируется каким-либо другим способом, например нарушением расщепления в пользу гетерозигот или в результате их адаптивного преимущества. В случае гемофилии эти возможные механизмы компенсации исключены. Если бы в настоящем исследовании использовались материалы работ, выполненных в последнее время, следовало бы учесть ослабление отбора, обусловленное лечением гемофиликов препаратами фактора VIII (см. разд. 4.2.2.9). Эти данные не совместимы с гипотезой о равенстве частот возникновения мутаций в гаметах индивидов разного пола. Дополнительные данные можно получить, проведя тестирование на гетерозиготность, поскольку определение отношения активности фактора VIII к концентрации антигена гемофилии позволяет выявить большую часть гетерозигот. Сравнение результатов такого тестирования заведомых гетерозигот и матерей спорадических больных, казалось, должно было показать, что последние чаще характеризуются нормальными величинами этих отношений, чем первые. Однако из табл. 5.14, в которой суммированы результаты нескольких исследований, видно, что заведомые гетерозиготы мало 180 5 Мутации
отличаются от матерей спорадических больных. Это еще одно доказательство того, что почти все матери спорадических больных являются гетерозиготами. Проведенное позднее сравнение оценок, полученных методом максимального правдоподобия [1699] с использованием данных о факторе VIII, для заведомых носителей и для матерей спорадических больных (возможных носителей) показало, что μ ≈ 1/10 v, т. е. частота мутаций в мужских половых клетках должна быть приблизительно в десять раз выше частоты мутаций в женских гаметах [1701]. Таким образом, доказательства того, что в случае гемофилии большинство мутаций возникает действительно в мужских половых клетках, довольно убедительны. Два других возможных объяснения, состоящие в том, что гетерозиготные женщины гораздо более плодовиты, чем нормальные, или что существует некоторое нарушение расщепления в пользу мутантного гена, можно отвергнуть как малоправдоподобные. Частота мутаций в мужских половых клетках, вероятно, выше и в случае синдрома Леша — Найхана [1456]. Мы уже говорили о повышенном возрасте дедов пораженных по материнской линии. У мужчин болезнь протекает так тяжело, что они никогда не имеют детей. Следовательно, их относительная плодовитость (f) равна 0. Если μ = v, приведенная формула упрощается до т = 1/3. При равенстве мутационных частот у индивидов разного пола треть всех пораженных, принадлежащих к одному поколению, должна быть сыновьями гомозиготных по нормальному аллелю матерей, так как болезнь возникла у них вследствие мутации de novo в гаметах их матерей. В настоящее время нет данных об эпидемиологических исследованиях, в которых были бы изучены все семьи определенной популяции. Однако при этой болезни гетерозиготы можно диагностировать с помощью лабораторных тестов. Поэтому интересно проверить, действительно ли одна треть всех известных больных – сыновья гомозиготных по нормальному аллелю матерей. В коллективном исследовании [1456] было изучено 47 семей: 39 – из США, 3 – из Великобритании и по 1 - из Канады, Бельгии, Германии, Ирландии и Швейцарии. В 27 семьях было только по одному-единст- 5. Мутации 181
венному больному мужского пола. Во всех этих случаях проведено тестирование матерей на гетерозиготность и обнаружено всего четыре гомозиготы по нормальному аллелю. В остальных 23 случаях (а также во всех семьях с более чем одним больным) матери оказались гетерозиготами. Таким образом, гомозиготы по нормальному аллелю составляли намного меньше одной трети всех матерей. Имеются три гипотезы, объясняющие наличие большого числа гетерозигот среди матерей: 1) поскольку семьи не были проранжированы на основе результатов эпидемиологического исследования, их выборка может быть смещена в сторону семей с более чем одним пораженным; 2) возможно репродуктивное преимущество гетерозигот или нарушение расщепления; 3) частота мутаций в мужских половых клетках выше, чем в женских. Первое и второе предположения представляются маловероятными. Наиболее правдоподобное объяснение этих данных дает третья гипотеза о более высокой частоте мутаций в мужских половых клетках. Синдром «ломкой» Х-хромосомы Этот синдром-вероятно, самая распространенная Х-сцепленная наследственная болезнь человека (см разд. 8.2.1.2). Недавно полученная для него оценка частоты мутаций оказалась самой высокой из всех оценок, вычисленных для «классических» фенотипов человека (разд. 5.1.3.2). Сегрегационный анализ родословных, объединенных в большое число серий [1619], не выявил спорадических больных, причину недуга которых можно объяснить мутациями, возникшими в половых клетках их матерей. В случае синдрома «ломкой» X сегрегационный анализ дал результат, сходный с полученным ранее для гемофилии А (см. табл. 5.13) Авторы сделали вывод, что в случае синдрома «ломкой» X все мутации de novo произошли в мужских половых клетках. Нам представляется такой вывод преждевременным. Ведь смещения выборки родословных, взятых в анализ, неизбежны. Как отмечалось в разд. 5.1.3.2, эти исследования не основываются на результатах изучения всех случаев болезни в популяции ограниченной численности. Кроме того, нельзя исключить возможность «инфляции» оценки частоты мутаций, обусловленной частичной компенсацией потери генов вследствие происходившего в прошлом увеличения плодовитости носителей с легкой формой заболевания [1678]. Правильный вывод, по нашему мнению, можно сформулировать так. частота мутаций, как и в случае гемофилии А, в женских половых клетках ниже, чем в мужских (v ≈ 10μ) [1682, 2230]. Отсутствие различий между частотами мутаций у индивидов разного пола в случае мышечной дистрофии Дюшенна. Четвертая болезнь, для которой имеются достаточно большие, хорошо изученные популяционные выборки, - это мышечная дистрофия Дюшенна (31020). При этом заболевании относительная плодовитость (/) пораженных также равна 0. Они никогда не имеют детей, и, если частоты мутаций одинаковы у индивидов разного пола, одна треть всех пораженных, вероятно, будут сыновьями матерей, гомозиготных по нормальному аллелю. Эту проблему анализировали на основе данных о трех обширнейших популяционных выборках. После коррекции на очевидное смещение выяснилось, что эти данные удивительно хорошо согласуются с ожидаемой зависимостью т = 1/3. Тогда казалось, что частоты соответствующих мутаций в мужских и женских половых клетках одинаковы. С тех пор опубликовано много новых данных и появились методы тестирования на гетерозиготность (приложение 8). Некоторые авторы считают, что в случае дистрофии Дюшенна частота мутаций в женских половых клетках ниже, чем в мужских [1404; 1430], высказывается и противоположная точка зрения [1405]. Однако основная часть имеющихся на сегодня данных свидетельствует о приблизительном равенстве мутационных частот у индивидов разного пола [1413; 1432]. Мышечная дистрофия Дюшенна характеризуется необычайно высокой частотой соответствующих мутаций и необычным распределением мутационных частот по полу. Вероятно, соответствующий ген очень велик по размеру и имеет несколько более или менее гомологичных по структуре псевдогенов. Это может послужить причиной частого неравного кроссинговера (см. разд. 3.5.8), приводящего к возникновению мутантных фенотипов [1700]. Поскольку ген, Мутации
детерминирующий дистрофию Дюшенна, находится в Х-хромосоме, кроссинговер (в том числе неравный кроссинговер) может происходить только в женском зародышевом пути. Косвенное доказательство более высокой частоты возникновения мутаций в мужских половых клетках. Как отмечалось выше, в случае аутосомно-доминантных аномалий прямое изучение проблемы различий между частотами мутаций в мужских и женских половых клетках невозможно. Однако мы можем построить чисто умозрительное доказательство, основываясь на том, что частота мутаций (например, в случае ахондроплазии) повышается с увеличением отцовского возраста. Если отцовский эффект обусловлен исключительно возрастом отца, что весьма вероятно [1591; 1596], представление о равенстве мутационных частот у индивидов разного пола неприемлемо, даже если все мутации, имеющиеся у детей молодых отцов, возникли в женских половых клетках. Если бы частоты мутаций у молодых родителей разного пола были равны, излишек мутаций de novo, обусловленный эффектом отцовского возраста, привел бы к тому, что частота мутаций в мужских половых клетках оказалась бы гораздо выше, чем в женских. Подробное изложение этого вопроса см. в работе [1677]. Различие между частотами мутаций у мышей разного пола. В исследованиях на людях можно использовать только косвенные методы. При изучении лабораторных животных указанные трудности отсутствуют. Поэтому логично предположить, что рассматриваемая проблема для животных уже решена. Однако соответствующие данные, хотя и важны для развития теории, выглядят не вполне убедительно. Они получены при изучении индуцированного мутагенеза у мышей с помощью многолокусного теста. Этот метод выявляет мутации de novo в F1 с помощью обратного скрещивания с использованием тестерной линии, гомозиготной по семи рецессивным мутациям (разд. 5.2.1). Результаты экспериментов суммированы в табл. 5.15. Различия по
полу не очень значительны. Семь мутантов, обнаруженные среди самок, включают группу из шести мутантов, по-видимому, возникшую в результате одной-единственной мутации, произошедшей на очень ранней стадии развития яичника. Если эта группа засчитывается только один раз, частота мутаций у самок будет равна 1,4 х 10–6, что действительно намного ниже частоты мутаций у самцов. Гипотеза о том, что частота мутаций у самок ниже, чем у самцов, подтверждается данными, свидетельствующими о низком выходе мутаций при облучении самок низкими дозами радиации [1616]. Статистические результаты и механизм мутирования. Различные результаты, о которых говорилось выше, можно сравнить с ожидаемыми в случае каждого из пяти механизмов, перечисленных в табл. 5.9. Для группы мутаций с сильным эффектом отцовского возраста мы можем исключить механизмы, при которых возникновение мутаций предшествует периоду половой зрелости (модель 3) или происходит после завершения клеточных делений (модель 4). Для этой категории весьма маловероятна и зависимость числа мутаций от времени (модель 1). Для группы мутаций с менее выраженным эффектом отцовского возраста остается возможность линейного увеличения их числа с течением времени, вероятно, сочетающегося с мутациями в зрелых половых клетках (модель 5). Большая часть данных свидетельствует в пользу модели (2), предполагающей зависимость от клеточных делений. Эта модель предсказывает существование различий по полу и увели- 5. Мутации 183 чение числа мутаций с возрастом отцов. Однако имеются два момента, заставляющие относиться с осторожностью к возможности полного принятия этой модели: 1) в некоторых случаях не удалось получить доказательств существования сильного эффекта отцовского возраста; 2) крутизна наклона кривой зависимости увеличения числа мутаций от возраста (для болезней, проявляющих сильный эффект отцовского возраста) растет с увеличением возраста. Как показано выше, можно было бы ожидать выравнивания кривой роста числа мутаций в старших возрастных группах. Однако имеющиеся материалы не позволяют решить интересующую нас проблему, гак как о природе изменений в ходе сперматогенеза, происходящих с увеличением возраста, мы знаем слишком мало. И все же эти данные свидетельствуют о том, что мутационный процесс как-то связан с репликацией ДНК и делением клеток. Видимо, не стоит чересчур увлекаться анализом статистических данных; исследования на молекулярном уровне обещают дать более обстоятельные и доказательные материалы. Некоторые авторы считают, что доводы, приведенные в этом разделе, неубедительны и что частоты мутаций у индивидов разного пола в действительности равны друг другу [1560]. Дата добавления: 2015-12-16 | Просмотры: 831 | Нарушение авторских прав |