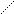|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Молекулярная адсорбция.В зависимости от природы растворенного вещества - электролита или неэлектролита, его адсорбция на твердом адсорбенте может быть молекулярной или ионной Молекулярная адсорбция – это адсорбция из раствора молекул растворенных неэлектролитов или слабых электролитов. Она зависит от: – природы всех трех компонентов системы: адсорбента, растворителя, растворенного неэлектролита, и, прежде всего, от их полярности. – концентрации раствора – температуры Существенным отличием адсорбции из раствора от адсорбции газа на твердой поверхности является наличие конкуренции между растворенным веществом и растворителем за взаимодействие с активными центрами поверхности, причем растворителя значительно больше, чем растворенного вещества. Поэтому, чем меньше растворитель взаимодействует с поверхностью адсорбента, тем лучше будет адсорбироваться растворенный неэлектролит. Адсорбция растворителя на поверхности адсорбента называется смачиванием. Смачивание зависит от полярностей растворителя и поверхности. Гидрофильные полярные адсорбенты (силикагель, глины, пористые стекла) смачиваются полярными растворителями, которые растекаются по ним, а гидрофобные (активированный уголь, сажа) неполярными (по правилу «подобное взаимодействует с подобным»). Рис. 1.12.
а) смачивание б) несмачивание
При смачивании адсорбента растворителем, то есть при адсорбции растворителя, уменьшается поверхностное натяжение адсорбента и энергия Гиббса системы. Система переходит в термодинамически устойчивое состояние. Поэтому в этом случае растворенный неэлектролит адсорбироваться из раствора не будет. Если растворитель не смачивает поверхность, то на ней адсорбируется растворенное вещество. Молекулярная адсорбция описывается правилом Ребиндера – правилом уравнивания полярностей. У него несколько формулировок. 1) Чем хуже растворитель смачивает поверхность адсорбента, тем лучше на ней адсорбируется растворенный неэлектролит. Для удобства применения этого правила и выбора условий молекулярной адсорбции удобно использовать схему (1.12 в.). Так, примером молекулярной адсорбции является метод гемосорбции и лимфосорбции. Это очень эффективный метод очистки крови больного от растворенных в ней токсинов – барбитуратов, фосфороорганических веществ, алкалоидов, путем пропускания крови (ее перфузии) через адсорбент. Поскольку основой крови является полярный растворитель – вода то, согласно правилу Ребиндера и схеме (1.12в), адсорбент должен быть неполярным. Действительно, для гемосорбции используется активированный уголь, модифицированный так, чтобы уменьшить повреждение форменных элементов крови.
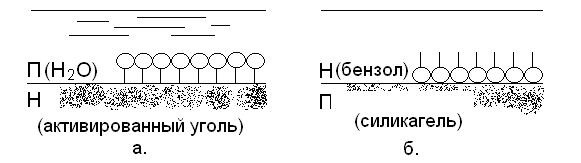
2) На поверхности раздела фаз прежде всего адсорбируются те вещества, при адсорбции которых происходит выравнивание полярностей соприкасающихся фаз, причем с увеличением разности полярностей фаз способность к адсорбции растворенных веществ возрастает. Правило Ребиндера очень наглядно демонстрируется при адсорбции из раствора веществ с дифильной структурой с четкой ориентацией их молекул на границе раздела фаз, выравнивающей полярности фаз (рис. 1.13). Полярный фрагмент молекулы всегда обращен к полярной (гидрофильной) фазе – к воде, силикагелю, а неполярный фрагмент – к неполярной (гидрофобной) фазе – бензолу, активированному углю.
Рис.1.13 Адсорбция ПАВ на границе раздела «Т – Ж» Количество вещества, адсорбированного на поверхности твердого адсорбента можно рассчитать по формуле (1.6):
(1.6.) Ср и Со - равновесная и начальная концентрации растворенного вещества, моль/л. m – масса адсорбента, г. V – объем раствора, л. Дата добавления: 2015-12-16 | Просмотры: 1324 | Нарушение авторских прав |




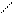










 П
П