 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Медико-биологическое значение адсорбции ПАВ из раствора.
а. б. в. Рис. 1.7 Схема адсорбции ПАВ а) на гидрофобных поверхностях в) при диспергировании жиров б) на гидрофильных поверхностях (масел) желчными кислотами 1.9. Адсорбция газа на твердой поверхности. Типичным примером такой адсорбции является адсорбция газов: хлора, аммиака активированным углем в противогазе. Угарный газ не адсорбируется активированным углем, потому использовать такой противогаз на пожаре бесполезно. Адсорбция газа на твердом адсорбенте, Г, зависит: а) от площади поверхности адсорбента, главным образом от его пористости; б) от природы газа и адсорбента; в) от концентрации (или давления) адсорбирующегося газа; г) от температуры.
Эффективность адсорбента тем выше, чем выше его удельная поверхность, т.е. чем больше он измельчен и выше его пористость. Так, активированный уголь (костный уголь «активирован» обработкой водяным паром выше - 10000С) имеет удельную поверхность 500 – 1000 м2/г, следовательно, обладая огромной избыточной энергией, стремится ее уменьшить за счет адсорбции (уменьшения σ). В медико-биологической практике в качестве адсорбентов применяют также полифан (получают из древесного лигнина), силикагель (SiO2)n (получают из кремниевой кислоты), оксид алюминия Al2O3; природные алюмосиликаты и цеолиты, главными компонентами которых являются оксиды Al2O3 и SiO2, целлюлоза (вата), тальк, бумага и др. Адсорбируемость газа или пара определяется его сродством к поверхности адсорбента. Полярные вещества лучше адсорбируются на полярных адсорбентах (силикагель, алюмосиликаты, глины), а неполярные – на неполярных адсорбентах (активированный уголь, сажа, тальк, фторопласт). При этом, чем больше газ склонен к межмолекулярным взаимодействиям, тем лучше он адсорбируется. При физической адсорбции из смеси газов или паров лучше адсорбируется тот газ, который легче сжижается, т.е. его молекулы более склонны к межмолекулярным взаимодействиям. Понять влияние концентрации газа на величину адсорбции Г можно, исходя из представлений о механизме адсорбции. Изучение механизма адсорбции на твердой поверхности является сложным. Теорий существует несколько. Первой и простейшей теорией, описывающей механизм адсорбции газа на твердом адсорбенте, является мономолекулярная теория Лэнгмюра (1915г.) Вот её положения: 1. Адсорбция молекул газа происходит главным образом на активных центрах поверхности, неровностях (рис.1. 8) 2. На одном активном центре адсорбируется только одна молекула газа. 3.Адсорбированные молекулы образуют на поверхности мономолекулярный слой, соответствующий предельной адсорбции, Г∞. 4. Адсорбированные молекулы не взаимодействуют друг с другом. 5. Адсорбция молекул газа обратима, сопровождается десорбцией. Адсорбция газа на твердой поверхности описывается изотермой Ленгмюра, выраженной через концентрацию или через давление газа (рис. 1.9 и ур-е 1.4).
   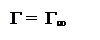

Рис. 1.8 «Активные» центры Поверхности Это уравнение хорошо описывает адсорбцию на линейных участках 1 и 3 при малых и высоких концентрациях газа. При малых концентрациях газа (С << К), значением С в знаменателе можно пренебречь, тогда Г = Г∞ С, т.е. количество адсорбированного газа пропорционально его концентрации (участок 1). При больших концентрациях, С << К, можно пренебречь значением К, уравнение примет вид Г = Г∞, т.е.адсорбируется предельно возможное количество вещества (участок 3). Для средних концентраций вещества (нелинейный участок 2) адсорбция лучше описывается уравнением Фрейндлиха (1.5): Г = К ∙ Сn (1.5) Постоянные К и n находят из эксперимента. Уравнение (1.5) логаифмируют, переводя его в уравнение прямой линии (1.6). lg Г = lg К + n lg С (1.6) Опытным путем находят адсорбцию Г при разных концентрациях вещества и строят график зависимости lg Г от lg С (рис. 1.10)
Рис. 1.10. График для нахождения постоянных в уравнении Фрейндлиха
Отрезок ординаты, отсекаемый полученной прямой, равен lg К, а тангенс угла наклона этой прямой к оси абсцисс, tg α = n. Физическая адсорбция газа на твердом адсорбенте при невысоких температурах является экзотермическим процессом, ∆Н < 0, за счет образования связей газа с поверхностью. Поэтому при повышении температуры увеличивается скорость обратного процесса – десорбции, согласно принципу Ле-Шателье, и адсорбция газа уменьшается (рис. 1.11)
Дата добавления: 2015-12-16 | Просмотры: 723 | Нарушение авторских прав |
 Природными ПАВ являются соли высших жирных кислот, которые называют мылами. Такие соли со щелочными металлами проявляют высокие гидрофильные свойства и поэтому хорошо растворяются в воде и способствуют стабилизации неполярных веществ. Например, гидрофобная поверхность частичек грязи при адсорбции молекул мыла становится гидрофильной и грязь легко смывается водой. (рис. 1.7а) Соли высших жирных кислот с двух- и трехвалентными металлами нерастворимы в воде, но растворимы в неполярных растворителях, например, в жирах, поэтому такие ПАВ стабилизируют полярные дисперсные фазы в гидрофобной среде. (рис. 1.7б) К природным ПАВ относятся фосфо- и гликолипиды, в молекулах которых между полярной и гидрофобной частями имеется глицериновый мостик, усиливающий гидрофильные свойства молекул. Поверхностно активными веществами являются желчные кислоты. В них носителем гидрофобных свойств является стероидный радикал, состоящий из четырех конденсированных колец. Желчные кислоты участвуют в диспергировании (эмульгировании) жира на мельчайшие капельки, в виде которых он лучше всасывается через стенки кишечника. Диспергирование происходит в 12-типерстной кишке, куда поступает из желудка кислая частично измельченная пища. Сюда же поступает секрет поджелудочной железы, имеющий основный характер за счет содержащихся ионов HCO3-. Выделяющийся при реакции нейтрализации CO2 дробит капельки жира, а желчные кислоты, поступающие сюда из желчного пузыря, адсорбируются на поверхности этих капелек, ориентируясь к их поверхности гидрофобным хвостиком, а к водной среде – гидрофильными головками. Поверхность жировых капель за счет такой адсорбции ПАВ становится полярной, близкой к полярности среды, уменьшается σ и эта гетерогенная дисперсная система, несмотря на высокую поверхность раздела фаз, становится термодинамически устойчивой (рис.1. 7в).
Природными ПАВ являются соли высших жирных кислот, которые называют мылами. Такие соли со щелочными металлами проявляют высокие гидрофильные свойства и поэтому хорошо растворяются в воде и способствуют стабилизации неполярных веществ. Например, гидрофобная поверхность частичек грязи при адсорбции молекул мыла становится гидрофильной и грязь легко смывается водой. (рис. 1.7а) Соли высших жирных кислот с двух- и трехвалентными металлами нерастворимы в воде, но растворимы в неполярных растворителях, например, в жирах, поэтому такие ПАВ стабилизируют полярные дисперсные фазы в гидрофобной среде. (рис. 1.7б) К природным ПАВ относятся фосфо- и гликолипиды, в молекулах которых между полярной и гидрофобной частями имеется глицериновый мостик, усиливающий гидрофильные свойства молекул. Поверхностно активными веществами являются желчные кислоты. В них носителем гидрофобных свойств является стероидный радикал, состоящий из четырех конденсированных колец. Желчные кислоты участвуют в диспергировании (эмульгировании) жира на мельчайшие капельки, в виде которых он лучше всасывается через стенки кишечника. Диспергирование происходит в 12-типерстной кишке, куда поступает из желудка кислая частично измельченная пища. Сюда же поступает секрет поджелудочной железы, имеющий основный характер за счет содержащихся ионов HCO3-. Выделяющийся при реакции нейтрализации CO2 дробит капельки жира, а желчные кислоты, поступающие сюда из желчного пузыря, адсорбируются на поверхности этих капелек, ориентируясь к их поверхности гидрофобным хвостиком, а к водной среде – гидрофильными головками. Поверхность жировых капель за счет такой адсорбции ПАВ становится полярной, близкой к полярности среды, уменьшается σ и эта гетерогенная дисперсная система, несмотря на высокую поверхность раздела фаз, становится термодинамически устойчивой (рис.1. 7в).


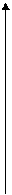 Г 200
Г 200
 500
500 1000
1000 С
С