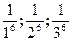|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Коагуляция золей.
Даже при наличии стабилизатора агрегативная устойчивость золей невысока и в них происходит самопроизвольный процесс слипания частиц – коагуляция и уменьшение суммарной площади поверхности. Коагуляция коллоидных растворов происходит с разной скоростью, то есть коллоидные растворы обладают разной устойчивостью. Коагуляцию можно ускорить любыми внешними воздействиями на золь: – резкой сменой температуры; – повышением давления; – механическим перемешиванием или вибрацией; – жестким облучением; – повышением концентрации; – добавлением электролитов. Закономерности коагуляции золей электролитами описываются правилом Шульце – Гарди: 1. Любой электролит может вызвать коагуляцию при концентрациях, равных или больше порога коагуляции. 2. Минимальная концентрация электролита, вызывающая явную коагуляцию, называется порогом коагуляции. Порог коагуляции рассчитывается по формуле:
Величина, обратная порогу коагуляции, называется
3. Коагуляцию вызывают лишь те ионы электролита, знак заряда которых противоположен знаку заряда гранулы. 4. Чем выше заряд коагулирующего иона, тем меньше его порог коагуляции, тем выше его коагулирующая способность. Для одно-, двух- и трехзарядных ионов пороги коагуляции относятся как величины, обратные заряду в шестой степени: 5. Органические ионы обладают большей коагулирующей способностью, чем неорганические с таким же зарядом.
Например, рассмотрим коагуляцию электролитами золя сульфида мышьяка, стабилизированного сероводородом и полученного по реакции: 2AsCl3 + 3H2S → As2S3 ↓ + 6HCl. Он коагулирует под действием катионов, поскольку гранула заряжена отрицательно. Пороги коагуляции резко уменьшаются с ростом заряда катиона. Если бы коагуляцию вызывали анионы, пороги коагуляции были бы одинаковы для этих электролитов. {m(As2S3)n S 2- (2n-x)H+}X – xH+
Электролит Коагулирующий ион Порог коагуляции, моль/л NaCl Na+ 51 KCl K+ 50 CaCl2 Ca 2+ 0.7 AlCl3 Al 3+ 0.09
При коагуляции смесями электролитов может наблюдаться 3 случая: 1. Аддитивность (add - складывать). Электролиты действуют независимо друг от друга. Их коагулирующее действие определяется по правилу простого сложения. 2. Антагонизм электролитов – подавление коагулирующей способности другого иона. 3. Синергизм электролитов – взаимное усиление коагулирующей способности. Встречается реже. Частным случаем коагуляции электролитами является взаимная коагуляция золей, имеющих противоположные знаки зарядов гранул. Например, золи Fe(OH)3 и Al(OH)3 используют для очистки природных и промышленных вод. Их положительно заряженные частицы вызывают быструю взаимную коагуляцию с отрицательно заряженными коллоидными частицами почвы и микрофлоры загрязненной воды. Дата добавления: 2015-12-16 | Просмотры: 971 | Нарушение авторских прав |
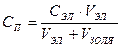 (2.3)
(2.3)