 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Лечение. Помощь больным с метаболической кардиомиопатией следует начинать с лечения той патологии, которая явилась причиной развития дистрофии миокардаПомощь больным с метаболической кардиомиопатией следует начинать с лечения той патологии, которая явилась причиной развития дистрофии миокарда. При эндокринных нарушениях своевременно удаляют опухоли, продуцирующие избыточное количество гормонов (диффузный токсический зоб, феохромоцитома, аденома коры надпочечников), назначают заместительную гормональную терапию при заболеваниях, протекающих со снижением функции эндокринных желез (сахарный диабет, гипотиреоз, хроническая недостаточность коры надпочечников), проводят адекватное лечение острых и хронических инфекций, интоксикации, анемии, авитаминозов. Немаловажное значение имеет устранение причин, вызывающих и усугубляющих дистрофию миокарда, — отказ от курения и злоупотребления алкоголем, исключение физического и психоэмоционального перенапряжения. Наряду с лечением основного заболевания необходимо устранить дистрофию миокарда. Поскольку в ее патогенезе существенное значение имеет нарушение состава внутренней среды организма, нормализация гомеостаза является важнейшим условием восстановления адекватного энергетического обмена. На первый план в лечении выступает применение комплекса лекарственных средств, направленных на улучшение транспорта кислорода в ткани и его утилизации, то есть проведение метаболической терапии. На обмен веществ в клетке могут оказывать влияние две группы лекарственных средств: регуляторы экстрацеллюлярной природы (гормональные препараты, блокаторы и стимуляторы центральной и периферической нервной системы) и регуляторы метаболизма интрацеллю-лярной природы (ферменты и антиферменты, витамины, кофакторы, разнообразные метаболиты), оказывающие действие на различные пути обмена веществ. При нарушении процесса окислительного фосфорилирования применяют комплекс витаминов, включающий витамины B1, B2, пантотеновую и липоевую кислоты. Установлено, что введение только одного витамина этой группы не оказывает должного эффекта, поскольку все метаболические системы взаимосвязаны. В прогрессировании метаболической кардиомиопатии ведущую роль играет усиление реакций свободнорадикального перекисного окисления липидов клеточных мембран. Повреждая мембраны, гидроперекиси и свободные радикалы снижают активность липидозависимых ферментативных реакций (к которым относятся основные жизненно важные ферменты ионного транспорта и дыхательной цепи митохондрий), изменяют мембранорецепторные системы клетки с развитием медиаторного дисбаланса, активируют протеолитические и лизосомальные ферменты. В этих условиях применение препаратов с антиоксидантными свойствами предотвращает деструкцию мембран клеток миокарда, сохраняет параметры пластического и энергетического метаболизма, повышает резистентность сердца к различным повреждающим факторам. Из антиоксидантов широко используют витамин Е (токоферола ацетат), который защищает мембраны клеток от окислительных реакций, тормозит распад белков, нуклеиновых кислот и стероидов. Сочетание витамина Е с витамином РР (никотиновой кислотой) способствует улучшению энергетического обеспечения сократительной функции миокарда. Большое значение для нормализации метаболизма миокарда имеет достаточное поступление в организм незаменимых аминокислот: метионина, серина, тирозина, триптофана, являющихся пластическим материалом для синтеза белка, ферментов, коферментов. Поскольку усвоение аминокислот усиливается анаболическими стероидами (метандиенон, нандролон), рекомендуется назначать их в комплексе. При прогрессировании дистрофического процесса показано применение внутрь калия хлорида, калия и магния аспарагината для устранения закономерного дефицита внутриклеточного калия, нарушения баланса кальция и магния. Для комплексной терапии, направленной на активацию синтеза белков и нуклеиновых кислот, используют калия оротат. Препарат содержит небольшое количество калия (20%), его действие осуществляется за счет оротовой кислоты — одного из предшественников пиримидиновых оснований, входящих в состав нуклеиновых кислот, которые обеспечивают синтез белковых молекул. В результате синтез пуриновых и пиримидиновых оснований обеспечивает клетку нуклеотидами, играющими главную роль в процессах анаболизма. Широким спектром терапевтической активности обладают адаптогены растительного происхождения — галеновые препараты из корня женьшеня, плодов китайского лимонника, элеутерококка, левзеи, аралии, заманихи, родиолы розовой. Адаптогены регулируют обмен катехоламинов в ЦНС и миокарде, проявляют выраженный антиоксидантный эффект, активизируют биосинтез нуклеиновых кислот и макроэргических соединений в миокарде, повышают устойчивость клеток к гипоксии, стабилизируют субклеточные структуры, мембраны кардио-миоиитов и проводящую систему сердца, улучшают трофику миокарда. Известно, что элеутерококк способствует утилизации в кардиомиоцитах липидов, активизации синтеза гликогена, что приводит к повышению резистентности миокарда к гипоксии. Средствами метаболической терапии являются и ноотропные препараты с ГАМКергической активностью, к числу которых относят пирацетам. В первую очередь они улучшают процессы высшей нервной деятельности — память, внимание, умственную и физическую работоспособность, на основе антигипоксического и антиоксидантного действия проявляют адаптогенный эффект и повышают качество жизни. Церебропротекторный и психоактивирующий эффекты ноотропных препаратов обеспечивают их положительное влияние на функцию сердечно-сосудистой системы, способствуя оптимальному уровню функционирования центрального звена регуляции сердечной деятельности. Кардиоваскулярные эффекты ноотропных средств обусловлены угнетением центральных адренергических структур на уровне паравентрикулярных ядер гипоталамуса и вазопрессорной зоны продолговатого мозга через ГАМК-рецепторы. Усиление ГАМКергических процессов сопровождается мембраностабилизирующим эффектом и улучшением репаративных процессов в поврежденном миокарде. В последнее время большое внимание уделяют роли серотонинерги-ческой системы в регуляции стрессорной реакции. Интерес представляет никотинамид — конечный метаболит обмена триптофана по серотонино-вому пути превращения. Являясь компонентом ферментов — переносчиков водорода для НАД и НАДФ, он обеспечивает почти все метаболические и окислительно-восстановительные процессы. Активация механизмов энергетического обеспечения предшествует активации процессов синтеза белка. Специфической особенностью никотинамида является его способность стимулировать процессы аэробного окисления и обмен гликогена, тем самым повышая устойчивость кардиомиоцитов к гипоксии. Поскольку нарушение обмена веществ в первую очередь влияет на систему энергообеспечения клеток, проводимая терапия должна быть направлена на повышение генерации энергии и увеличение устойчивости миокарда к гипоксии. Прямое цито- и мембранопротекторное действие на кардиомиоциты в условиях гипоксических состояний оказывает триметазидин. Продолжительность интенсивной метаболической терапии на ранних стадиях у больных с преимущественно функциональными нарушениями составляет 2- 3 нед. При прогрессировании дистрофии миокарда и выявлении органического поражения сердца курс терапии следует повторять несколько раз в год. Независимо от повреждающего фактора принципиальными для метаболических кардиомиопатий могут быть следующие положения: • нарушения метаболизма миокарда при своевременном лечении обратимы; • выраженная сердечная недостаточность развивается сравнительно редко, в основном в конечной стадии заболевания, но возникшая сердечная недостаточность резистентна к сердечным гликозидам и успех терапии целиком зависит от степени восстановления нарушенного обмена веществ в миокарде. Рассмотренные пути формирования метаболических и дегенеративных (дистрофических) поражений миокарда являются лишь общей схемой, которая в значительной мере может быть дополнена особенностями патогенеза основного заболевания. ЭНДОКРИННЫЕ НАРУШЕНИЯ Сердечно-сосудистая система часто вовлекается в патологический процесс при заболеваниях желез внутренней секреции. Функциональные изменения сердца могут превалировать в клинической картине, и пациент с эндокринным заболеванием становится фактически «кардиальным» больным. Поражение сердца при эндокринных заболеваниях в основном обусловлено обменными нарушениями, вызванными недостатком или избытком того или иного гормона в организме. Сахарный диабет Поражение сердечно-сосудистой системы при сахарном диабете обусловлено сложными обменными нарушениями, возникающими в связи с абсолютной или относительной недостаточностью инсулина. Кардиомиопатия, не обусловленная нарушением коронарного кровообращения, возникает у больных молодого возраста с ювенильным сахарным диабетом, для которых не характерно развитие выраженного атеросклероза. Между тем атеросклероз коронарных артерий наиболее часто развивается при длительно текущем (на протяжении 5-10 лет) сахарном диабете, особенно у больных пожилого возраста. Развитие миокардиодистрофии при ювенильном инсулинзависимом сахарном диабете обусловлено действием нескольких факторов. Большую роль играют расстройства обмена веществ в организме и самом миокарде, возникающие вследствие дефицита инсулина и приводящие к существенным отклонениям от нормы параметров гомеостаза. Дефицит инсулина вызывает нарушение утилизации тканями глюкозы и усиливает расщепление липидов и белков. Дефицит инсулина также приводит к выраженным изменениям состава внутренней среды организма — гипергликемии, гиперкетонемии, гиперлипидемии с накоплением в крови жирных кислот, гиперхолестеринемии, диспротеинемии, метаболическому ацидозу. Нарушения обмена веществ в кардиомиоцитах и указанные выше изменения крови, возникающие при дефиците инсулина, являются определяющими факторами изменения структуры и функции миокарда. В патогенезе кардиомиопатий важную роль играет гипоксия. При сахарном диабете могут развиваться все известные формы гипоксии: респираторная, гемодинамическая, прежде всего микроциркуляторная, гемическая и тканевая. Возникновение дыхательной недостаточности и гипоксемии вызвано развитием микроангиопатий сосудов легких и нарушением диффузии кислорода из альвеол в кровь. Микроангиопатий развиваются и в других тканях, в частности в миокарде, обусловливая расстройства микроперфузии и проницаемости капилляров. Важное значение в развитии гипоксии имеет нарушение транспорта кислорода кровью при сахарном диабете. Развитие тканевой гипоксии обусловлено нарушением функции дыхательных ферментов под влиянием выраженного ацидоза. При сахарном диабете потребность тканей, в том числе миокарда, в кислороде повышена. Важным фактором развития миокардиодистрофии при сахарном диабете является нарушение нейроэндокринной регуляции сердца, связанное с преобладанием эффектов контринсулярных гормонов. Можно считать доказанным, что у больных происходит увеличение продукции адренокортикотропного и соматотропного гормона, а также глюкокортикоидов, катехоламинов и глюкагона. Избыток катехоламинов и кортикостероидов приводит к инициации целой группы метаболических и улыраструктурных процессов, вызывающих развитие метаболической кардиомиопатии. Патологическая анатомия. Морфологической основой дистрофии миокарда при сахарном диабете является микроангиопатия, характеризующаяся инфильтрацией тучными клетками и фибриноидным набуханием стенок мелких сосудов. При гистохимическом исследовании в стенках этих сосудов определяются отложения гликопротеинов. На ультраструктурном уровне обнаруживается утолщение базальной мембраны сосудистой стенки. Клиника. Больные с ювенильным сахарным диабетом изредка отмечают колющую боль в области сердца. Размеры сердца в пределах нормы. Некоторое приглушение тонов сердца и систолический шум на верхушке чаще наблюдают у болеющих сахарным диабетом более 5 лет. На ЭКГ отмечаются уплощение или двухфазность зубца Т, нарушение внутрижелудочковой проводимости. Лечение. Наряду с соответствующей диетой и медикаментозной терапией сахарного диабета следует учитывать и метаболические нарушения в миокарде. Больным назначают препараты, способствующие коррекции нарушений обмена в миокарде: поливитамины, триметазидин. Тиреотоксическая болезнь сердца При гипертиреозе обнаруживают метаболические изменения в миокарде, сопровождающиеся нарушениями его функции. Изменения сердечно-сосудистой системы обусловлены воздействием избыточного количества тиреоидных гормонов на обменные процессы и гемодинамику. Одним из важных эффектов тиреоидных гормонов является разобщение окислительного фосфорилирования, что приводит к снижению в сердечной мышце содержания АТФ и креатинфосфата. В результате происходит угнетение анаболических процессов: снижается синтез и усиливается распад гликогена и белка, снижается содержание калия в эритроцитах и других клетках. Потребление кислорода миокардом увеличивается, однако эффективность его утилизации в процессе биологического окисления снижается. При избытке тироксина нарушается проницаемость митохондриальных мембран. Под влиянием тиреоидных гормонов происходит усиление сократительной функции миокарда, вероятно, вследствие активизации стимулирующего влияния на сердце и прямого действия тироксина на сердечную мышцу. Избыток тиреоидных гормонов изменяет симпатические и парасимпатические влияния на миокард. При высокой степени тиреотоксикоза в результате резкого снижения эффективности биологического окисления, преобладания распада белка над его синтезом снижается уровень энергетических ресурсов и пластических процессов, что приводит к угнетению сократительной функции миокарда. Факторы, обусловливающие поражение сердечно-сосудистой системы у больных с диффузным токсическим зобом, вначале вызывают дистрофические изменения, а в дальнейшем — дегенеративно-склеротические. На примере тиреотоксикоза было показано, что дистрофический процесс проходит три стадии: 1-я стадия характеризуется гиперфункцией, появлением первых признаков гипертрофии и дистрофии миокарда; 2-я стадия характеризуется прогрессированием как дистрофии, так и гипертрофии миокарда, присоединяется дилатация полостей сердца, появляются начальные нарушения сократительной функции; эта стадия может быть обратимой: гипертрофия и дистрофия миокарда могут уменьшаться и даже исчезать, однако дилатация левого желудочка сохраняется; 3-я стадия наступает при тяжелой степени тиреотоксикоза: дилатация нарастает, присоединяется выраженное снижение сократительной функции миокарда, что проявляется застойной сердечной недостаточностью, фибрилляцией предсердий. Эта стадия необратима, развивается диффузный миодистрофический кардиосклероз (миокардиофиброз). При тиреотоксикозе происходят резкие изменения гемодинамики: увеличивается минутный объем крови (в основном за счет увеличения числа сердечных сокращений), скорость кровотока и объем циркулирующей крови. Периферическое сосудистое сопротивление в большом круге кровообращения снижается, а в малом — повышается. В результате увеличения минутного объема крови и объема циркулирующей крови, с одной стороны, и снижения периферического сосудистого сопротивления — с другой повышается пульсовое давление. Сердце испытывает диастолическую перегрузку (в результате увеличения минутного объема крови и объема циркулирующей крови), а правые отделы сердца еще и систолическую перегрузку (из-за повышения давления в малом круге кровообращения). Увеличенная работа сердца при тиреотоксикозе происходит в крайне неблагоприятном для него режиме: вследствие изменений гемодинамики левый желудочек работает в условиях постоянной изотонической гиперфункции, а правый — в условиях смешанного типа гиперфункции (нагрузка объемом и сопротивлением), однако при этом отсутствуют условия для развития компенсаторной гипертрофии миокарда (усилен распад и снижен синтез белка, уменьшено количество АТФ и креатинфосфата). Все это достаточно быстро приводит к развитию сердечной недостаточности. Патологическая анатомия. Гистологические изменения миокарда при тиреотоксикозе характеризуются воспалением и дегенерацией вплоть до развития очагов некроза и фиброза. Гистологические изменения в миокарде непостоянны и неспецифичны. Клиника. Существенным симптомом токсического зоба является постоянная синусовая тахикардия, выраженность которой соответствует тяжести токсического зоба. У 10-20% больных диагностируется тахисистолическая форма фибрилляции предсердий. Больные нередко жалуются на боль в области сердца, часто ноющего, колющего, нередко стенокардического характера, а также на сердцебиение, которое возникает в состоянии покоя, но при физических нагрузках неадекватно усиливается. Одышка отмечается как при нагрузках, так и в покое. Сердечная недостаточность, в основном — правожелудочковая, наблюдается в 15-25% случаев. Признаки левожелудочковой недостаточности обычно выражены меньше, так как очень быстро возникает слабость правого желудочка. При осмотре отмечается прекардиальная пульсация и пульсация артерий. В отличие от многих других поражений миокарда, при тиреотоксикозе аускультативно определяется повышение звучности сердечных тонов, особенно первого, почти всегда выслушивается систолический шум на верхушке сердца и легочной артерии. На ЭКГ, кроме синусовой тахикардии или мерцания предсердий, отмечается повышение амплитуды зубца Т, иногда изменения комплекса QRS, снижение сегмента ST и вольтажа зубца Т. Лечение преследует три цели: нормализацию функции щитовидной железы, устранение недостаточности кровообращения и восстановление синусового ритма (при фибрилляции предсердий). С целью уменьшения синтеза гормонов щитовидной железы применяют тиамазол. Для уменьшения синусовой тахикардии нецелесообразно применять сердечные гликозиды, возможно применение блокаторов бета-адренорецепторов. При тахисистолической форме мерцания предсердий проводят комбинированное лечение тиамазолом, сердечными гликозидами и антиаритмическими средствами, в частности, препаратами калия и блокаторами бета-адренорецепторов, добиваясь восстановления синусового ритма или перевода фибрилляции предсердий в нормосистолическую форму Лечение сердечной недостаточности при тиреотоксикозе не имеет специфических особенностей и обязательно должно проводиться на фоне антитиреоиднойтерапии. Следует учитывать, что чувствительность миокарда к гликозидам наперстянки может быть повышена. НАРУШЕНИЯ ОБМЕНА Нарушения обмена веществ в организме всегда отражаются на течении метаболических процессов в миокарде, нередко вызывая нарушение его функции и структуры. При различных заболеваниях первона Нарушение белкового обмена Амилоидоз Среди инфильтративных поражений миокарда, обусловленных нарушением белкового обмена, наибольшее практическое значение имеет амилоидоз сердца, нередко встречающийся улиц пожилого и старческого возраста. Амилоидоз — системное заболевание неизвестной этиологии, характеризующееся внеклеточным отложением в органах и тканях (главным образом в медии артерий, периваскулярной соединительной ткани и в ретикулоэндотелиальной системе) особого белка Р-фибриллярной структуры — амилоида. Термин «амилоид» введен в 1854 г. R. Virchov. Амилоидоз является следствием нарушения белкового обмена и может быть приобретенным или наследственным. В последние годы стала возможной более точная биохимическая идентификация белков, входящих в состав амилоидных фибрилл, на основании чего выделены типы амилоида, определена связь отдельных типов с клиническими формами амило-идоза, изучены белки-предшественники, предположительно участвующие в синтезе белков. Амилоид может быть образован легкими цепями молекул иммуноглобулина, амилоидным А-белком, разновидностью преальбумина (или транстиретина). Обнаружены гены, ответственные за синтез этих белков, и идентифицирован характер генных мутаций. Выделяют несколько вариантов амилоидоза: •первичный, при котором на первый план выступает изолированное поражение сердца: • наследственный семейный, • генуинный, • старческий, • при миеломной болезни, • при В-клеточных опухолях (болезни Вальденстрема); • вторичный амилоидоз, когда поражению сердца предшествует какое-либо другое хроническое заболевание, а именно: остеомиелит, • ревматоидный артрит, • туберкулез, • опухоли, • лимфогранулематоз. При первичном амилоидозе поражение сердца встречается в 85- 90% случаев, при вторичном — у 60% больных, обычно в возрасте 55-70 лет. Этиология и патогенез амилоидоза сердца остаются неясными. Наследственный амилоидоз является аугосомным доминантным заболеванием. Ряд авторов связывают развитие заболевания с изменением свойств белков тканей вследствие аутоиммунных процессов под влиянием комплекса антиген — антитело. Диспротеинемия с накоплением в плазме крови грубодисперсных фракций белка и аномальных белков (парапротеинов) ведет к выходу последних из сосудов ткани с образованием амилоидных субстанций. Патологическая анатомия. Миокард при амилоидозе сердца очень плотный на ощупь, мало поддается растяжению. Объем полостей существенно не изменен или незначительно увеличен. Амилоид откладывается в разных отделах сердца, преимущественно в миокарде предсердий и желудочков, эндокарде, в клапанах, перикарде, нередко в синусном и атрио-вентрикулярном узлах, а также в мелких артериальных и венозных сосудах, включая vasa vasorum коронарных артерий, суживая их просвет вплоть до полной обтурации. При старческом амилоидозе масса сердца увеличивается в меньшей степени, а амилоидоз имеет диффузный характер. Мышечные волокна сердца оказываются «замурованными» в массах амилоида, что приводит к атрофии сократительного миокарда (рис. 2). Клиника. Амилоидное поражение сердца не имеет специфических симптомов, развивается постепенно и может длительное время протекать латентно, даже при обнаружении отложений амилоида в миокарде при биопсии. У некоторых больных возникает боль в области сердца, иногда носящая стенокардический характер. Частыми симптомами амилоидоза сердца являются различные нарушения ритма и проводимости, обусловленные диффузным поражением проводящей системы, которые могут быть причиной внезапной смерти. У некоторых больных отмечается выраженная брадикардия.
Сердечная недостаточность отмечается у 45- 56% больных, причиной ее является дистрофия миокарда, обусловленная диспротеинемией, а также атрофия мышечных волокон вследствие сдавления накопившимся в интерстициальной ткани амилоидом. Недостаточность диастолического расслабления миокарда и наполнения сердца приводит, с одной стороны, к повышению давления в полых венах, с другой — к уменьшению сердечного выброса (закон Франка — Старлинга). У10% больных развивается ортостатическая гипотензия в результате поражения вегетативной нервной системы, сосудов и надпочечников. Несмотря на то, что амилоид откладывается в створках клапанов сердца, их функция обычно не нарушается, хотя могут возникать сердечные шумы. При аускультации на фоне глухих тонов сердца можно выслушать систолический шум митральной регургитации, при развитии сердечной недостаточности — протодиастолический ритм галопа. Изменения на ЭКГ неспецифичны, наиболее типичным признаком считается снижение амплитуды зубцов. Иногда наличие патологического зубца Q и отсутствие зубца R в отведениях V1-3 симулируют инфаркт миокарда, однако эти изменения связаны с диффузной атрофией миокарда при неизмененных коронарных артериях. Может наблюдаться уплощение или инверсия зубца Т, изменения зубца Р. Частыми «находками» являются различные аритмии (синдром слабости синусного узла, иногда узловой ритм, мерцание предсердий, желудочковые аритмии) и нарушения проводимости (вплоть до полной AV-блокады). Брадиаритмии встречаются значительно реже, чем тахиаритмии. При проведении эхокардиографического исследования обычно обнаруживаются следующие признаки: •увеличение толщины межжелудочковой, межпредсердной перегородки, задней стенки левого желудочка и передней стенки правого желудочка; диспропорциональная инфильтрация межжелудочковой перегородки может симулировать гипертрофическую кардиомиопатию; • утолщение клапанов сердца; • нормальные размеры полости левого желудочка; • дилатация предсердий; • снижение систолической функции предсердий; • нарушение диастолического наполнения; • уменьшение систолического утолщения межжелудочковой перегородки при нормальных размерах полости левого желудочка; • увеличение отношения скорости раннего диастолического наполнения к скорости наполнения предсердий; • характерная эхо-структура миокарда с диффузным гранулярным блеском (рис. 3); • гипокинезия миокарда.
При рентгеноскопии наблюдают уменьшение пульсации контура сердца. Размеры сердца рентгенологически увеличены (кардиомегалия) и обычно не соответствуют степени тяжести застойной сердечной недостаточности.
Рис. 3. Амилоидоз сердца; А — парастернальная позиция по длинной оси; Б — парастернальная позиция по короткой оси. Здесь и далее на рисунках: МЖП — межжелудочковая перегородка; ЛП — левое предсердие; АК — аортальный клапан; МК — митральный клапан; ЗС — задняя стенка; ЛЖ — левый желудочек; ПЖ — правый желудочек
Диагноз. Важное значение в диагностике амилоидоза сердца имеет выявление признаков системного заболевания — амилоидного поражения других органов: языка, мышц гортани, иногда легких с развитием гипертензии малого круга, гепато- и спленомегалия. Диагноз амилоидоза, предполагаемый по клиническим признакам, должен быть подтвержден морфологически при изучении биоптатов тканей. К достижениям последних лет относится введение в клиническую практику метода сцинтиграфии с меченным 1231 сывороточным Р-компонентом (SAP) для оценки распределения амилоида в организме. Р-компонент содержится в небольшом количестве (5-10%) в амилоиде всех типов; радиоактивный SAP, введенный больному амилоидозом, специфически связывается с амилоидными депозитами и может быть визуализирован и количественно оценен на серии сцинтиграмм. Метод особенно полезен для контроля за динамикой тканевых отложений амилоида в процессе лечения. Диагноз амилоидоза сердца чаще устанавливают при аутопсии, так как при жизни в ряде случаев не обнаруживают объективных причин, которыми можно было бы объяснить возникновение патологических признаков. Подтверждение диагноза амилоидоза сердца может быть получено при эндомиокардиальной биопсии. Следует указать, что важно не только обнаружить амилоид, но и провести иммуногистохимическое исследование полученной ткани для идентификации его типа. Для диагностики также используют пробу с изотопом технеция 99мТс-пирофосфатом, способным связываться с амилоидом многих типов, однако эта проба оказывается положительной только при значительных отложениях амилоида в сердце, которые можно определить и с помощью эхокардиографии. Течение амилоидоза прогрессирующее, прогноз неблагоприятный, хотя зависит от формы, сроков диагностики и степени вовлечения жизненно важных органов. Летальный исход (приблизительно через 1,5-2,5 года после появления первых признаков поражения сердца) обычно наступает вследствие нарушений ритма и проводимости, а также внесердечных осложнений (легочной или системной эмболии). Самая низкая выживаемость отмечена у больных с рефрактерной к терапии застойной сердечной недостаточностью (в среднем 6 мес), особенностью которой является преимущественно правосердечный или тотальный ее тип с резким набуханием шейных вен и значительным повышением венозного давления, застойным увеличением печени и полостными отеками (гидроторакс, гидроперикард, асцит). Лечение. Специфической терапии не существует. Лечение направлено на устранение нарушений ритма и сердечной недостаточности (которая часто не поддается симптоматической терапии). У больных с сердечной недостаточностью обнаруживается высокая резистентность миокарда к сердечным гликозидам, применение их не оправдано. Антагонисты ионов кальция неэффективны и могут привести к нарастанию симптомов декомпенсации. Блокаторы бета-адренорецепторов могут спровоцировать угрожающие жизни нарушения проводимости. Для уменьшения недостаточности кровообращения с осторожностью применяют диуретики в низких дозах и вазодилататоры, хотя они могут вызвать артериальную гипотензию. Эффективность ингибиторов АПФ не установлена. При резком снижении сократительной способности предсердий, свидетельствующих о массивной инфильтрации, даже при синусовом ритме показано назначение антиагрегантов или антикоагулянтов, что обусловлено повышенным риском тромбообразования. При явлениях полной поперечной блокады и слабости синусного узла эффективна имплантация искусственного водителя ритма. При старческом амилоидозе любая терапия неэффективна. Рецидивы амилоидоза в аллотрансплантате и неуклонное прогресси-рование процесса в других органах и системах ограничивают применение трансплантации сердца и сокращают продолжительность жизни больных. Нарушение обмена пуринов Подагрическое сердце Подагра — заболевание, в основе которого лежит нарушение пуриново-го обмена с избыточным накоплением солей мочевой кислоты в различных тканях организма (преимущественно в костях, хрящах, почках) и развитаем в них воспалительных, а затем деструктивно-склеротических изменений. Возникновение подагры связывают как с алиментарными причинами (переедание, злоупотребление алкоголем, употребление в пищу продуктов, содержащих в избытке пурины), так и с генетической детерминированностью. Подагрой болеютвосновном мужчины (95-98%) обычно старше 30 лет. Первые описания подагры принадлежат Гиппократу. Патогенез подагры изучен недостаточно, но доказана роль наследственной ферментопатии, нарушающей синтез уратов в организме. Имеет значение и нарушение выделения уратов почками. При наследственной форме заболевания обнаруживается снижение активности гипоксантин-гуанин-фосфорибозилтрансферазы и аденинфосфорибозил-пирофосфатсинтетазы, что ведет к повышению синтеза мочевой кислоты. Доказано участие иммунных механизмов в патогенезе подагры, в частности значение иммунных комплексов в развитии подагрического гломерулонефрита. Патологическая анатомия. Кристаллы натрия моноурата обнаруживаются в синовиальных оболочках, хрящах и суставах, сухожилиях, склерах, интерстиции почек, сосудах. Непосредственное поражение миокарда при подагре представляет исключительную редкость, хотя кристаллы мочевой кислоты иногда находят в сердечной мышце и створках клапанов. Отложения уратов у больных с бессимптомным течением подагры обнаруживались в эндокарде, перикарде, коронарных артериях, митральном клапане. В отдельных случаях выявляются отложения уратов в перегородке сердца. Клиника. Отложения кристаллов мочевой кислоты и ее солей в сердце могут быть бессимптомными или клинически проявляться нарушениями сердечного ритма: тахикардией, экстрасистолической аритмией, AV-блокадой различной степени вплоть до полной поперечной блокады. Поражение створок клапанов, в особенности митрального, может приводить к их недостаточности. У многих больных отмечается артериальная гипертензия, как полагают, чаще вторичная вследствие поражения почек. При подагрическом приступе обычно наблюдается тахикардия, иногда экстрасистолическая аритмия, загрудинная боль. Диагноз. Диагностически значимая степень гиперурикемии — более 0,06-0,07 г/л, особенно если она отмечается на фоне соблюдения диеты с ограничением пуринов в течение 3- 5 дней. Лечение. Лечение в первую очередь должно быть направлено на снижение уровня мочевой кислоты в плазме крови. Особое значение имеет правильное питание с обязательным ограничением продуктов, богатых пуринами. Из препаратов, замедляющих синтез мочевой кислоты, предпочтителен аллопуринол. При непораженных почках степень гиперурикемии можно снизить с помощью препаратов, усиливающих выделение мочевой кислоты почками (предпочтительны сульфинпиразон, этебеницид). Успешное лечение урикозурическими препаратами может приводить к исчезновению нарушений сердечного ритма и проводимости. При артериальной гипертензии, сочетающейся с подагрой, хороший урикозурический, гипотензивный и диуретический эффект дает производное этакриновой кислоты — тиениловая кислота. Нарушения липидного обмена Голодание, длительное неполноценное питание, кахексия приводят к нарушениям деятельности сердца, которые сопровождаются уменьшением массы миокарда, обычно пропорционально меньшим, чем уменьшение массы тела вследствие атрофии мышечных волокон, дегенеративным изменениям в миокарде и к сердечной недостаточности. Патологическая анатомия. При голодании микроскопически отмечаются вакуолизация миофибрилл, особенно вокруг ядер, изменения хроматина ядер и митохондрий. В далеко зашедших случаях обнаруживаются бурая атрофия и дистрофические изменения миокарда. Клиническая картина. Основными проявлениями нарушения функции сердечно-сосудистой системы при голодании являются синусовая брадикардия, уменьшение минутного объема крови, снижение венозного и артериального давления (преимущественно систолического), что нередко сопровождается головокружением, а при быстром перемещении из горизонтального положения в вертикальное — обмороком. Часто наблюдаются отеки, обусловленные гипопротеинемией и увеличением объема циркулирующей крови (но не сердечной недостаточностью). На ЭКГ отмечаются отклонение оси сердца вправо, синусовая брадикардия, низкий вольтаж зубцов, иногда изменения зубца Т и комплекса QRS, которые, по-видимому, обусловлены нарушением обмена энергии и электролитов в миокарде. Ожирение и его лечение — одна из актуальных проблем клинической медицины. Часто и рано возникающей патологией при ожирении являются дистрофические изменения миокарда, вызванные метаболическими нарушениями в мышце сердца (cor adiposorum). При высокой степени ожирения нельзя исключить определенную роль гипоксии в изменении нейроэндокринной регуляции кровообращения и в развитии дистрофии миокарда. Включение гилоксического фактора в патогенез дистрофических поражений сердца может стать существенным механизмом не только их возникновения, но и развития сердечной недостаточности. Патологическая анатомия. При ожирении наблюдается увеличенное отложение жировой ткани под эпикардом и в поверхностных слоях миокарда, а также под эпикардом обоих желудочков, нередко жировая ткань распространяется и на интерстиций миокарда. Накопление жировой ткани под эпикардом со временем приводит к атрофии мышечных волокон, даже к замещению их жировой тканью, причем сильнее всего поражается мышца правого желудочка (lipomatosis cordis). Миокард на разрезе имеет желтоватый оттенок. Клиника. Клинически выраженные расстройства кровообращения развиваются редко. Сердце принимает «поперечное положение» из-за высокого стояния диафрагмы, смещаясь влево и несколько кзади. При выслушивании сердца определяется выраженная глухость тонов. Пульс имеет склонность к учащению, артериальное давление — к некоторому повышению. При крайних степенях ожирения иногда наблюдается клинический синдром, проявляющийся сочетанием сонливости, альвеолярной ги-повентиляции и легочной гипертензии с гипертрофией правого желудочка — синдром Пиквика. На ЭКГ обычно отклонение электрической оси сердца влево, снижение сегмента ST b I- II и V5 отведениях, уплощенный и отрицательный зубец Т. У части больных регистрируется низкоамплитудный зубец Р111 и глубокий Q111. При изучении гемодинамических показателей у всех больных отмечается увеличение ударного объема крови и объема циркулирующей крови, у некоторых — и минутного объема крови. Рентгенологическая картина всегда изменена вследствие высокого стояния диафрагмы и скопления жира в области верхушки сердца, что создает картину его кажущегося увеличения. Пульсация вялая, тонус сердца понижен. Лечение. Начальные дистрофические изменения миокарда при ожирении являются в значительной мере обратимыми при нормализации массы тела. При наличии признаков сердечной недостаточности кроме диеты необходимо проводить лечение кардиотоническими и мочегонными препаратами. КЛИМАКТЕРИЧЕСКАЯ (ДИСГОРМОНАЛЬНАЯ) КАРДИОМИОПАТИЯ Климакс как у женщин, так и у мужчин представляет собой закономерный этап эволюции организма. Резкое изменение гормонального статуса у женщин вполне естественно сопровождается разнообразными вегетативными расстройствами, степень выраженности которых довольно субъективна как в оценке пациентки, так и врача. О существовании связи между расстройством деятельности сердца и изменением функции женских половых органов известно давно. В 1874 г. Kirsch выделил климактерическую кардиомиопатию (поражение миокарда, связанное с нарушением функции яичников) в особую нозологическую единицу. Заболевание может развиваться не только в климактерический период, но и у женщин молодого возраста с различными гинекологическими заболеваниями (миома матки, эндометриоз и др.), при посткастрацион-ном и предсменструальном синдромах. Климактерическая кардиомио-патия диагностируется иногда и у мужчин (климакс наблюдается у 10-20% лиц мужского пола). Таким образом, кардиомиопатия при климаксе объединяет близкие по патогенезу поражения миокарда разной этиологии — климактерические и дизовариальные (при предсменструальном синдроме) у женщин и климактерические у мужчин. Не исключено, что механизмы развития поражений сердечно-сосудистой системы при этих состояниях общие. Дата добавления: 2015-02-06 | Просмотры: 1252 | Нарушение авторских прав |
 чально могут нарушаться один или несколько путей метаболизма, что в дальнейшем обязательно отражается на энергообеспечении сердечной мышцы. При некоторых нарушениях обмена в межуточной ткани миокарда и в коронарных сосудах откладываются патологические продукты нарушенного метаболизма белков, углеводов, минералов или накапливаются избыточные компоненты нормального обмена. К таким заболеваниям относят амилоидоз, гликогеноз, гемохроматоз и т. д.
чально могут нарушаться один или несколько путей метаболизма, что в дальнейшем обязательно отражается на энергообеспечении сердечной мышцы. При некоторых нарушениях обмена в межуточной ткани миокарда и в коронарных сосудах откладываются патологические продукты нарушенного метаболизма белков, углеводов, минералов или накапливаются избыточные компоненты нормального обмена. К таким заболеваниям относят амилоидоз, гликогеноз, гемохроматоз и т. д.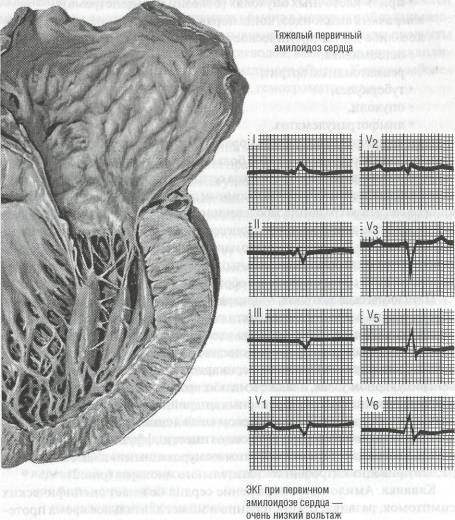
 Рис. 2. Амилоидоз сердца (по F. Netter, 1969, с изменениями)
Рис. 2. Амилоидоз сердца (по F. Netter, 1969, с изменениями)