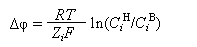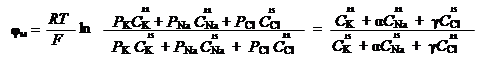|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Транспорт минеральных веществ в клетку
Теперь, когда мы рассмотрели функции минеральных элементов, необходимых для нормального роста растений, следует обсудить механизмы их поступления в растения и структурные элементы, по которым предстоит им двигаться. Минеральные вещества обычно поглощаются из почвы с помощью корней. Они могут поступать в небольших количествах также и через листья, поэтому внекорневое внесение некоторых микроэлементов стало стандартным сельскохозяйственным методом. Минеральные вещества почти всегда поступают в растения в форме ионов. Эти ионы сначала должны пересечь оболочку и плазмалемму, с тем, чтобы попасть в цитоплазму: затем при необходимости пройти и через мембрану, окружающую вакуоль (тонопласт) или какую-либо клеточную органеллу, для того, чтобы оказаться в том или ином внутреннем компартменте. Изучение вопроса транспорта элементов является одним из основных в проблеме минерального питания. Это предопределяется следующими обстоятельствами. Во-первых, суть питания растений состоит в поступлении и включении в метаболизм минеральных элементов в результате обмена между организмом и средой. Во-вторых, изучение процесса транспорта элементов сопряжено с выяснением свойств и функций клеточной оболочки, мембранных образований, связи между клетками и тканями. В-третьих, выяснение вопросов, связанных с транспортом, приближает нас к целенаправленному управлению продуктивностью сельскохозяйственных растений. Гидратированное состояние ионов. Перенос ионов через мембрану связан с определенными трудностями. Одной из трудностей является наличие гидратированной воды, которая окружает ион и значительно увеличивает его объем. Рассмотрим одновалентные ионы, в частности катионы Li+, Na+, K+, Rb+ и Cs+: самое легкое ядро у лития, а самое тяжелое у цезия. С увеличением массового числа растет также и количество электронов, которые окружают ядро и объем пространства, занимаемого электронными орбиталями. Поскольку плотность электронного облака, окружающего ядро мала, можно предположить, что ядро более доступно внешним воздействиям. Эта зависимость находит свое отражение в величинах радиусов гидратированных ионов: Li+ – 0,06; Na+ – 0,095; K+ – 0,133; Rb+ – 0,148; Cs+ – 169 нм. В водных растворах молекулы воды удерживаются около ионов электростатическими силами, источником которых служат заряженные частицы атомного ядра. Чем ближе могут подойти к заряженному атомному ядру молекулы воды, тем сильнее они связываются и тем больше изменяется величина свободной энергии, обусловленная гидратацией. Таким образом, у лития молекулы воды ближе к ядру и это значит, что в гидратной оболочке лития содержится больше молекул воды. Известно, что молекулы воды являются диполями. Около катионов все ближайшие молекулы воды ориентируются отрицательными полюсами внутрь, а около анионов внутрь направлены положительные полюсы молекул воды (рис. 5.1).
Этот внутренний, сильно связанный с ионами структурированный слой молекул воды, называют первичной оболочкой. На некотором отдалении, превышающем толщину первичной оболочки, напряженность электрического поля несколько снижается, что приводит к изменению нормальной ориентации молекул воды. Из-за этого вокруг иона возникает вторичная оболочка (рис. 5.2).
Таким образом, благодаря гидратной оболочке размеры ионов сильно увеличиваются. Между радиусами гидратированных и негидратированных катионов щелочных металлов существует обратная зависимость, т. е. гидратированный ион, имеющий меньший кристаллический радиус, имеет большие размеры. Радиусы гидратированных ионов трудно вычислить; данные разных авторов значительно разнятся. Подвижность ионов дает представление об их относительных размерах (табл. 5.2). Таблица 5.2 Подвижность ионов в водных растворах (25 ОС)
В настоящее время общепринятыми являются представления о том, что ионы и различные вещества преодолевают мембрану несколькими способами, основные из которых: 1. Простая диффузия через липидную фазу, если вещество растворимо в липидах (это не касается ионов). 2. Облегченная диффузия гидрофильных веществ с помощью липофильных переносчиков (транспортеров). 3. Простая диффузия ионов через гидрофильные поры (например, через ионные каналы). 4. Перенос веществ с участием активных комплексов (насосов). 5. Транспорт веществ путем пиноцитоза в условиях существенных изменений архитектуры мембран. Что касается движущих сил мембранного транспорта, то различают два механизма. Пассивный транспорт – перемещение веществ путем диффузии по градиенту электрохимического потенциала без затраты энергии (простая и, в какой-то мере, облегченная диффузия). Активный транспорт – перемещение веществ против градиента электрохимического потенциала с затратой метаболической энергии, как правило в форме АТФ или редокс-цепей. Для того чтобы понять механизмы трансмембранного переноса элементов минерального питания, остановимся на рассмотрении некоторых физико-химических закономерностях, определяющих движение ионов в растворе и мембране. Начнем с процессов пассивного транспорта (в частности вспомним законы диффузии). Согласно первому закону Фика, поток (Ф) прямо пропорционален коэффициенту диффузии D и градиенту концентрации dC/dх в точке х в данный момент времени. Ф = – D |
| dC |
| dх |
| . |
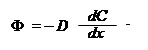 |
| |||
Знак минус в правой части уравнения означает, что, если градиент положителен, т. е. концентрация при увеличении х возрастает, диффузионный поток направлен в противоположную сторону.
Однако при описании диффузии на большие расстояния в непрерывной системе уравнения (5.1) необходимо определить зависимость концентрации не только от расстояния, но и от времени. Поэтому целесообразно преобразовать первый закон Фика в дифференциальные уравнения в частных производных, которые обычно называют вторым законом Фика. В одномерном случае этот закон аналитически выражается следующим образом:
|

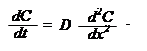


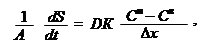
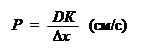

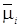 , в величину которого вносят свой вклад химический и электрический потенциалы:
, в величину которого вносят свой вклад химический и электрический потенциалы:

 В реальных условиях описания процесса диффузии ионов в клетку нас интересует разность электрохимических потенциалов (Δφ) по обеим сторонам мембраны, т. е.. Используя уравнение (5.9) можно записать:
В реальных условиях описания процесса диффузии ионов в клетку нас интересует разность электрохимических потенциалов (Δφ) по обеим сторонам мембраны, т. е.. Используя уравнение (5.9) можно записать:
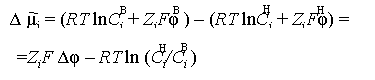
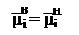 В случае равновесного состояния, когда электрохимический потенциал i-иона одинаков по обе стороны мембраны, т. е., получаем:
В случае равновесного состояния, когда электрохимический потенциал i-иона одинаков по обе стороны мембраны, т. е., получаем: