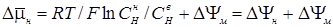|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Активный транспорт
При активном транспорте энергия, которая получается в процессе метаболизма, участвует в переносе веществ через мембрану в направлении возрастания энергии. Таким образом, активный перенос ионов – это перемещение против градиента электрохимического потенциала с затратой энергии. Сама по себе разница в электрохимическом потенциале по обеим сторонам мембраны не обязательно предполагает участие активного транспорта. Когда растворенное вещество не проникает через мембрану, оно не может находиться в состоянии равновесия по обе стороны мембраны и электрохимический градиент может быть не одинаков с обеих ее сторон. В настоящее время рассматривают следующие типы активного транспорта веществ. 1. Первичный активный транспорт – трансмембранный векторный перенос иона происходит непосредственно в ходе энергетического превращения в АТФазных системах или ЭТЦ (используется или энергия АТФ или ОВ реакций): а) электрогенный активный транспорт – первичный активный трансмембранный перенос ионов во время АТФазной или ОВ реакций, которые сопровождаются генерацией электрического потенциала; б) электронейтральный активный транспорт – первичный активный трансмембранный перенос ионов во время АТФазной или ОВ реакций, который не сопровождается генерацией электрического потенциала (например, Н+/K+ обмен при стехиометрии 1:1). 2. Вторичный активный транспорт – происходит, когда в качестве энергетического источника используются градиенты других ионов. Например, электрохимический градиент ионов Н+ для сопряженного транспорта анионов, сахаров, аминокислот и т. д. (симпорт или котранспорт), или, напротив, для вывода ионов Na+ из клетки (антипорт). Каждая из названных систем может функционировать при определенных условиях в качестве переносящего ион механизма. АТФазные помпы. Активная секреция протонов из клеток корневой системы – это фундаментальный процесс, важный для всех трансмембранных потоков в растениях. Ацидофицирующая активность (подкисление среды) растений известна давно: исследования, касающиеся способности растений сдвигать рН питательного раствора в кислую сторону относятся к 20–40 годам прошлого века, когда в практику начали внедряться стеклянные рН-электроды и методы ионометрии. Одной из первых в этом направлении была работа Д. А. Сабинина в 1927 г., в которой он подчеркивал практическую и теоретическую значимость сдвига реакции среды под воздействием корневых систем растений. Изучение феномена Н+-секреции растений потребовали совершенствования методических подходов с учетом особенностей морфологического строения растительных клеток и их функциональной активности в составе органов. Величина рН внутри растительной клетки зависит не только от вида, но и в пределах одной клетки определяется клеточными компартментами: вакуоль, цитоплазмы, органелла и т. д. Величина рН вакуолярного сока варьирует в широких пределах, но в большинстве видов равна 4–6 единицам. рН цитоплазмы более стабильна и находится в пределах от 6,6 до 7,5; более вероятной является величина не ниже 7,0, так как при более низких значениях рН становятся неустойчивыми НАДН и НАДФН. Для поддержания стационарного уровня рН в цитоплазме и других компартментах клетки существуют несколько механизмов: буферные системы (фосфатный, карбонатный, органические кислоты и их соли, аминокислоты), биохимический рН-стат (реакции декарбоксилирования – кислый рН, карбоксилирования – щелочной рН) и биофизический рН-стат функционирование Н+-АТФазной помпы. Нужно отметить, что АТФаза плазмалеммы несколько отличается по своему строению от АТФ-синтазы митохондрий, как и от АТФазы тонопласта. Выход ионов Н+, связанный с работой Н+-АТФазы плазмалеммы является активным процессом. Причем, как отмечалось, система может быть как электрогенной, так и нейтральной.
Схема функционирования электронейтральной помпы представлена на рис. 5. 7.
В случае, когда стехиометрия переноса ионов не равна 1:1 помпа функционирует в электрогенном режиме.
В последнем случае перенос веществ осуществляется в соответствии со схемой, представленной на рис. 5.8.
Н+-движущая сила может создаваться либо путем увеличения Ψн (адицифицирующая способность), либо в результате повышения Ψм (перенос заряда – Н+). На плазматических мембранах растений существуют и другие АТФазы, роль которых связана с переносом минеральных веществ. К таким АТФазам можно отнести Са2+-АТФазу. Считают, что Са2+-АТФаза вместе с Н+-АТФазой и редокс-цепью плазмалеммы может относится к числу систем, которые участвуют в формировании электрогенной компоненты потенциала. Вопрос о Na+/K+-АТФазе остается открытым. Сообщения о наличии Na+/K+-АТФазы у растений появились в начале 1970 г. Они касались как целых органов растений, так и мембранных препаратов. Но, в основном, эта АТФаза, по мнению многих исследователей, характерна для мембран галофитов, т. е. растений, устойчивых к засолению. Таким образом, Na/K-АТФаза активна у тех растений, которым необходимо противостоять сильному засолению и осуществлять удаление Na+ из клеток. Тем не менее сегодня продолжают существовать крайние взгляды на присутствие Na+/K+-АТФазы у высших растений. В соответствии с одной точкой зрения – это ферментативная система отсутствует, с другой – она имеется во всех растениях, но у многих видов находится в скрытом виде и ее функционирование зависит от влияния определенных условий. Редокс-цепь плазмалеммы и роль в переносе ионов. Гипотеза о том, что электрогенный транспорт Н+ через плазмалемму клеток растений идет при участии редокс-цепи (ЭТЦ) хотя высказывалась давно, но исследования в этом направлении получил развитие в 80-е годы ХХ века. В рамках этой гипотезы предусматривается, что начальным звеном редокс-цепи выступают восстановленные перидиннуклеотиды, а конечным акцептором электронов, как и в случае ЭТЦ митохондрий, является О2. Подтверждением такой гипотезы в той или иной степени служат данные о возможности участия восстановленных перидиннуклеотидов в электрогенезе растительных клеток, а также данные гистохимического анализа локализации компонентов редокс-цепи в плазмалемме и некоторые другие. Исследования ЭТЦ плазмалеммы проводились по двум основным путям, которые можно подразделить на структурные и функциональные. Успехом первого направления явились те обстоятельства, что во фракциях плазматических мембран идентифицированы такие составные элементы ЭТЦ, как флавины, цитохромы в и с; выделен белковый комплекс, имеющий НАДН-оксидазную активность. Успехи функционального направления тоже весьма значительны: редокс-реакции выявлены в плазмалемме как фотосинтезирующих, так и гетеротрофных клеток, причем в значительном количестве растительных объектов; при этом есть основания считать, что в плазмалемме даже одного и того же объекта может иметь место целый ряд отдельных редокс- активностей с различной специфичностью к перидиннуклеотидам. Таким образом, считают, что на плазмалемме растительных клеток функционирует редокс-цепь, которая состоит из флавопротеина и цитохрома в 5, субстратом которого является НАДН (у ряда объектов и НАДФН). Что касается участия ЭТЦ в работе электрогенной Н+-помпы плазмалеммы и формирования метаболической компоненты мембранного потенциала, то на этот счет у исследователей нет одного взгляда. Существует точка зрения согласно которой редокс-цепь плазмалеммы является альтернативной Н+-АТФазной электрогенной системе, которая осуществляет активный транспорт протона через плазмалемму. Однако существует и другой взгляд на эту проблему. Считают, что восстановление феррицианида и наблюдаемое при этом подкисление среды обусловлено двумя разными механизмами: первичным транспортом только ē к феррицианиду, который приводит к деполяризации мембраны (за счет увеличения концентрации Н+ в цитоплазме), и последующим выходом Н+, осуществляемой Н+-помпой. Активация Н+-АТФазы происходит за счет внутриклеточного подкисления и деполяризации. Это подтверждается данными по действию ингибиторов Н+-АТФазной активности эритрозином В, который сильно угнетал вызываемое ферриционидом подкисление среды, но мало влиял на процесс восстановления феррицианида (рис. 5.9).
Таким образом, решение вопроса о роли редокс-цепи плазмалеммы растений в дальнейшем связано с изучением механизма его функционирования и анализа взаимоотношений этого механизма с Н+-АТФазой. Пиноцитоз. Процесс пиноцитоза впервые открыл Льюис в 1931 г. Пиноцитоз подразделяется на экзо- и эндоцитоз. Экзоцитоз – это выделение содержимого, например пузырька, в наружную среду. Примером может служить выделение пузырьками Гольджи материала клеточной оболочки. Пузырьки Гольджи, отделялись от цистерн диктиасом, выделяют высокополимерные соединения. В растениях пузырьки Гольджи выделяют разные полисахара, пектины, слизи полисахаридной природы и т. д. Диктиасомы чаще всего выявляются в местах интенсивного роста клеточных оболочек, например в кончиках корневых волосков и ризоидов, при образовании новых оболочек в трахеидах; пузырьки Гольджи переносят материал, который должен быть встроен в клеточную стенку. Эндоцитоз – процесс противоположный экзоцитозу, очень хорошо изучен на уровне световой микроскопии у простейших. В этом случае мембрана выпячивается в сторону цитоплазмы и вещества входят внутрь клетки. Дискуссионность процесса эндоцитоза у растений долгое время обуславливалась следующими причинами: 1. Ограниченная проницаемость клеточной стенки к большим молекулам и частицам; 2. Наличие тургора, особенно для вакуолизированных клеток, что препятствует формированию плазмалемных инвагинаций; 3. Отсутствие потребности в эндоцитозе для жизнедеятельности растений в связи с их автотрофностью. Вот как разрешились эти проблемы: 1. Было показано, что в клеточных оболочках растений существуют водные поры размером до 10 нм. Таким образом, через клеточную оболочку могут проходить молекулы и частицы соответствующих размеров. Экспериментально наблюдали, что клетки корней разных растений, в том числе и корневые волоски, могут образовывать в значительных количествах пиноцитозные инвагинации и пузырьки. Кроме того, корневые волоски, как оказалось, способны поглощать пиноцитозом и органические молекулы, что было показано на примере гемоглобина. 2. Было отмечено определенное влияние гидростатического давления на пиноцитозную активность, однако это влияние значительно меньше, чем считали раньше. Последнее подтверждается количеством образованных пузырьков в клетках поглотительной зоны корней при помещении их в слабо осмотические водные растворы солей, а также экспериментально показано наличие инвагинаций мембраны, как уже отмечалось в первом пункте. 3. Сегодня известно, что растительные клетки, в том числе и корневые, способны поглощать и метаболизировать низкомолекулярные органические соединения, на долю которых приходится значительная часть органических веществ почвы. Как показано во многих исследованиях высшие растения имеют способность, как и к превращению экзогенных органических веществ в формы, которые доступны для поглощения пиноцитозным путем, так и обладают внутриклеточной способностью их метаболизации, т. е. органические вещества могут служить источником питания. В общих чертах механизм пиноцитоза в растительных клетках может выглядеть следующим образом (рис. 5.10).
На первых этапах образование инвагинаций и пиноцитозных пузырьков инициируют сами индукторы пиноцитоза. Как установлено на модельных системах (липосомах), инвагинирование возникает в случае электростатического взаимодействия индуктора с полярными участками мембраны и/или в результате перекисного окисления мембранных липидов. Все эти взаимодействия приводят к конформационным модификациям липидных молекул. Итак, первый этап – электростатическое взаимодействие вещества и мембранных структур. Второй – инвагинация (впячивание или выпячивание) мембраны и образование пиноцитозного пузырька, а далее отрыв его от мембраны с затратой энергии АТФ. Третий – миграция пузырька внутрь или наружу. Четвертый – растворение мембраны пузырька (фермент) или просто разрыв мембраны (под действием осмотических сил). Таким образом, пиноцитоз является преимущественно активным видом транспорта, поскольку необходима энергия, а сам процесс подавляется метаболическими ингибиторами, главным образом ингибиторами дыхания. Есть примеры использования эндоцитоза как способа доставки в протопласты чужеродного генетического материала с целью получения растений с необходимыми полезными свойствами (биотехнологический подход).
Дата добавления: 2014-12-11 | Просмотры: 2020 | Нарушение авторских прав |

 Из полученных результатов в настоящее время становится очевидным, что одна из функций Н+-АТФазы плазмалеммы регуляция внутриклеточного рН, другая – использование созданной протондвижущей силы для вторичного транспорта веществ:
Из полученных результатов в настоящее время становится очевидным, что одна из функций Н+-АТФазы плазмалеммы регуляция внутриклеточного рН, другая – использование созданной протондвижущей силы для вторичного транспорта веществ: