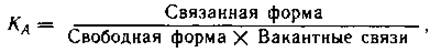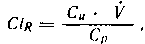|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Общая фармакокинетика
Грамотное применение медикаментозных средств, выбор их дозы, времени, пути и способа введения для получения нужного эффекта требует от анестезиолога-реаниматолога знания и понимания прежде всего основополагающих принципов фармакологии. Чисто прагматический подход приводит к тому, что на первый план выступает интерес к конечному результату — специфическому фармакологическому действию препарата, которое обусловлено его свойствами и созданием в организме (в крови, органах и тканях) определенной его концентрации. Эта зависимость между концентрацией лекарственного средства и вызываемым им эффектом служит предметом фармакодинамики. Но для создания эффективной концентрации необходимо, чтобы в организм поступила определенная доза препарата Зависимость между дозой и концентрацией лекарственного средства в крови и других жидкостях организма является объектом фармакокинетики. Суть фармакокинетики заключается в приложении кинетики (т.е. скорости изменения в любой системе) к фармакону (греч pharmakon лекарство) Иными словами, фармакокинетика — это скорость и характер изменении концентрации медикаментозного средства в биологической системе — организме и его составляющих (органы, ткани, жидкости). Таким образом, фармакология состоит из двух частей — фармакодинамики и фармакокинетики, взаимосвязь между которыми С. Prys-Roberts и С.С. Hug (1983) представляют следующим образом.
Подчеркнем, что если фармакодинамика (пусть даже в эмпирической форме) была руководством к действию, очевидно, на протяжении всей истории существования человечества, то фармакокинетика как раздел науки достаточно молода. Зависимость между дозой лекарства и его терапевтическим или токсическим эффектом была известна уже со времен Парацельса (XVI в.). В 1866 г. О. Шмидеберг свою диссертацию на соискание ученой степени доктора медицины посвятил аналитическому методу определения содержания хлороформа в крови. Но становление фармакокинетики как науки произошло только в первой половине нынешнего столетия. В значительной степени ее прогресс был связан с привлечением математического аппарата (возможно, это обусловило ее меньшую по сравнению с фармакодинамикой популярность у клиницистов). Термин «фармакокинетика» впервые предложил Ф. Дост в 1953 г. Но только в 70—80-х годах появились первые монографии, посвященные фармакокинетике [Соловьев В.Н. и др., 1980; Холодов Л.Е., Яковлев В.П., 1985; Wagner J. G., 1975; Gibaldi M., Perrier D., 1975; Stanski D.R., Watkins W.D., 1982; Prys-Roberts С., Hug С.С., 1983].
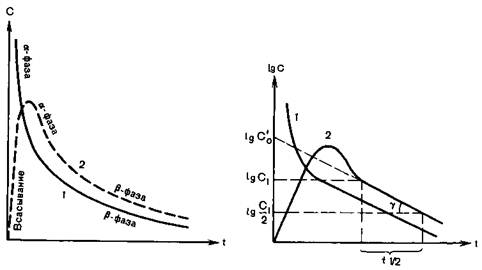
Фармакокинетические факторы определяют скорость изменения концентрации лекарственного соединения в период или после его применения и, следовательно, детерминируют наступление, интенсивность и продолжительность эффекта препарата. Эти факторы включают все процессы, которые могут повлиять на фармакологический препарат: абсорбцию в кровь в области введения, распределение по органам и тканям, элиминацию путем метаболизма или экскреции. Иначе говоря, фармакокинетика изучает судьбу лекарственного препарата, его путь от момента введения (или приема) до полного выделения или распада. Кратко рассмотрим эти процессы. Поступление препарата возможно несколькими основными путями (прием внутрь, введение подкожно, внутримышечно и внутривенно, ингаляционным путем). Учитывая специфику использования лекарственных средств в анестезиологии, особое внимание уделим инъекционному и ингаляционному способам их введения. Скорость абсорбции лекарственного средства при подкожном введении зависит от васкуляризации тканей: вазоконстрикция уменьшает абсорбцию, вазодилатация в месте инъекции — увеличивает. Эти условия действуют также при внутримышечной инъекции, причем абсорбция в этом случае более быстрая, чем при подкожном введении, особенно при использовании водорастворимых препаратов. Темп абсорбции падает в случае применения лекарственных препаратов в виде эмульсии или растворенных в масле. Эти формы фармакологических средств используют специально для обеспечения их медленного постепенного всасывания и длительного эффекта. Та часть препарата, которая попадает в кровоток, получила название доступной фракции. При внутривенной инъекции препарат полностью попадает непосредственно в кровоток. Различия скорости абсорбции препарата в крови обусловливают неодинаковые изменения его концентрации при том или ином пути введения (рис. 8.1). Хотя на рисунке представлены гипотетические кривые, их понимание имеет существенное практическое значение, поскольку они демонстрируют не только изменения концентрации лекарственного средства в крови после введения различными путями, но и соответствующие изменения его эффекта. После приема внутрь концентрация, медленно повышаясь, достигает пика, а затем постепенно снижается. Быстрее и значительнее высокий пик концентрации создается при подкожном введении. Следует обратить внимание на то, что высокая начальная концентрация препарата в крови после внутривенной инъекции быстро падает.
Рис. 8.1. Изменения концентрации препарата в крови после однократного внутривенного (1) или внесосудистого (2) введения [Холодов Л.Е., Яковлев В.П., 1985]. С — концентрация; t — время.
Соответственно изменениям концентрации в крови меняется и интенсивность фармакологического действия. После внутривенной инъекции эффект наступает более быстро, но его продолжительность меньше, чем при любом другом пути введения. Варьируя скорость введения, можно изменить и действие препарата, вводимого внутривенно. При быстрой внутривенной инъекции не успевает произойти разведение препарата кровью, что приводит к поступлению в ткани лекарственного средства в высокой концентрации и быстрому развитию фармакологического эффекта. Последующее столь же быстрое ослабление этого действия обусловлено главным образом падением концентрации в крови в связи со смешиванием, а не быстрым начальным перераспределением в депо. Постоянный уровень препарата в крови может быть обеспечен длительной внутривенной инфузией с определенной скоростью. Ингаляционный путь введения фармакологического средства характеризуется быстрой абсорбцией через легкие, что обусловлено большой поверхностью всасывания и интенсивным кровотоком. Эффективность ингаляционного пути почти столь же велика, как и внутривенной инъекции. Анализируя особенности абсорбции лекарственных препаратов при различных путях введения, мы уже упоминали ряд факторов, которые влияют на концентрацию медикамента и его распределение в организме. Распределение препарата между различными секторами организма начинается фактически с момента его поступления. На этот процесс влияют скорость кровотока и степень кровоснабжения органов и тканей, связывание препарата с белками крови, депонирование в жировых и иных депо, метаболизм и распад, выделение из организма почками, печенью, легкими, с калом. Обсуждение этого вопроса начнем с рассмотрения ряда процессов и понятий, необходимых для понимания кинетики фармакологических средств. После абсорбции из места введения (а после внутривенной инъекции непосредственно) лекарственный препарат попадает в кровоток, где в течение нескольких кругооборотов крови происходит смешивание или растворение медикамента в плазме. Препараты с кислой и основной реакцией находятся в плазме в ионизированной и неионизированной формах, соотношение которых зависит от рН и определяется уравнением Гендерсона—Хассельбальха. Так, при нормальном рН крови (7,4) тиопентал-натрий ионизирован на 30%, а диазепам — только на 0,01%. Это обстоятельство имеет существенное практическое значение, так как только неионизированная форма фармакологического средства проникает через липидные мембраны или растворяется в жировых соединениях, поэтому ее можно считать активной диффундирующей фракцией. Поскольку существует очень чувствительное, быстро восстанавливаемое равновесие между ионизированной и неионизированной формами, ионизация не влияет на распределение препарата между тканями с равным рН, а сказывается только на его скорости. Проникновение в клетки (например, эритроциты) зависит от растворимости в жирах. Так, фентанил, будучи высокорастворимым в жировых субстанциях, свободно проникает в эритроциты, а плохо растворимый в жирах панкуроний не проникает. Многие препараты в крови связываются с белками, главным образом с альбуминами. Это связывание носит динамический обратимый характер. Каждая молекула белка может иметь несколько точек связывания, аффинитет которых к одному и тому же препарату может быть различным. Равновесие между свободной и связанной формами регулируется по закону действующих масс:
где /(А — константа равновесия.
Связывание и диссоциация происходят очень быстро и практически постоянно. По мере увеличения концентрации препарата может произойти насыщение связей с белками, и тогда доля связанного препарата по отношению к общему его количеству начинает падать. Однако обычно концентрация свободного препарата слишком мала по сравнению с количеством вакантных связей, что препятствует существенному уменьшению связывания. Например, отношение связанной и свободной форм фентанила остается постоянным в пределах широких колебаний концентрации. Только при очень высокой концентрации (после болюсной инъекции до достижения полного смешивания) или при конкуренции нескольких препаратов за одни и те же вакантные связи отношение связывания уменьшается. Связанная с белком форма препарата не способна диффундировать в ткани и, следовательно, давать фармакологический эффект. Это может произойти только после диссоциации в свободную форму. Отношение связывания может оказывать выраженное влияние на скорость перераспределения препарата, так как проникновение последнего через мембрану почти всегда пропорционально концентрации свободной формы. Например, лидокаин (30% свободной формы) проникает через мембрану несравненно легче, чем диазепам (3% свободной формы). Связывание препарата приводит к снижению его концентрации в водной фазе плазмы, что может облегчить абсорбцию. Степень связывания значительно влияет также на скорость метаболизма препарата или его элиминацию. Так, связывание тубокурарина с белками плазмы замедляет распределение препарата во внеклеточной жидкости и задерживает его экскрецию с мочой и желчью. Большая растворимость летучих анестетиков в плазме и цельной крови, чем это можно было бы объяснить их растворимостью в воде и жирах, обусловлена связыванием этих препаратов. Предполагается также, что связывание анестетиков белками играет важную роль в механизме общей анестезии на молекулярном уровне. Связывание фармакологических препаратов может происходить не только в плазме, но и в других тканях: жировой, соединительной, костной, эритроцитах. Для того чтобы наступил фармакологический эффект, лекарственное средство должно попасть в ткань или орган в достаточной концентрации. В данном случае речь идет о концентрации в так называемой биофазе, т.е. концентрации медикамента в непосредственной близости от рецептора. В большинстве случаев препарат вводят в области, весьма удаленные от места действия, к которому он должен быть доставлен кровью, а затем через межклеточное пространство. На этом пути лекарственное средство должно пройти через множество барьеров, большинство из которых составляют мембраны. Практически все мембраны в организме имеют общее строение. Они состоят из биомолекулярного слоя липидов, покрытого с обеих сторон одномолекулярным слоем белков. Мембраны не образуют полностью непрерывного слоя: в них имеется множество пор радиусом около 9,4 нм. Существуют четыре основных механизма транспорта лекарственного средства через мембраны: 1) жировая диффузия, при которой фармакологический препарат растворяется в жировом слое мембраны и диффундирует в соответствии с градиентом концентрации в водную фазу по другую сторону мембраны; 2) водная диффузия, при которой жирорастворимые гидрофильные вещества могут проходить через поры мембраны, чему способствует разница гидростатического и осмотического давления по обе стороны мембраны, обеспечивающая ток воды, которая и «протаскивает» лекарственный препарат через поры. Этот вид транспорта ограничен размерами молекулы препарата (у большинства лекарственных средств радиус молекулы значительно превышает 0,4 нм). Клетки капиллярного эндотелия имеют каналы радиусом до 4 нм, которые способны пропускать из плазмы в межклеточную жидкость или гломерулярный фильтрат даже молекулы альбумина; 3) активный транспорт, обеспечивающий движение вещества против концентрационного или электрохимического градиента (примером активного транспорта является широко распространенная в организме «натриевая помпа»); фагоцитоз и пиноцитоз, которые могут обеспечить транспорт лекарственных веществ (с высокой молекулярной массой или существующих в форме молекулярных агрегатов) в виде поглощенных клетками небольших капелек. На транспорт лекарственных препаратов влияет ряд факторов. Укажем основные из них. Чтобы проникнуть через мембрану, медикамент должен прежде всего раствориться в воде и в виде водного раствора войти в контакт с мембраной. Следовательно, скорость абсорбции препарата зависит от его растворимости в воде. Вступая в контакт с мембраной, многие препараты растворяются в жировой составляющей мембраны. Жировая диффузия зависит от разделительного коэффициента растворимости препарата между водной и жировой фазами мембраны. Чем выше этот коэффициент, тем скорее абсорбируется вещество. Большинство фармакологических средств являются слабыми электролитами и содержат кислые или основные группы (или обе разновидности). В водном растворе они образуют ионы. Степень ионизации зависит от константы диссоциации. Поскольку клеточная мембрана почти непроницаема для ионизированной формы любого лекарственного соединения, становится понятной зависимость фармакологического эффекта от зтого показателя, о чем мы уже говорили. Степень ионизации влияет не только на абсорбцию, но и на экскрецию почками. Заслуживает упоминания прохождение лекарственного препарата через мембраны, обладающие особыми свойствами. Мембраны мозговых капилляров напоминают липидные мембраны клеток и значительно менее проницаемы, чем у обычных капилляров. Этим и объясняется существование гематоэнцефалического барьера. Проникновение лекарственного препарата через барьер зависит от степени ионизации, растворимости в жирах, связывания по обе стороны барьера. Такие высокоионизированные препараты, как тубокурарин и гексаметоний, вообще не могут пересечь эту границу. Природное соединение — физостигмин по химическому строению является третичным амином и легко проникает в мозг. Прозерин, близкий по действию к физостигмину, будучи четвертичным амином и высокоионизированным при нормальном рН плазмы соединением, не оказывает действия на ЦНС. Проникновение в мозг неионизированных молекул зависит от растворимости в жирах. Тиопентал-натрий, значительная часть которого находится в плазме в неионизированной форме, будучи хорошо растворимым в жирах, легко проникает в мозг. Другой барбитурат этаминал-натрий (нембутал) из-за низкой растворимости в жире проникает в мозг медленно. Другой пример особых свойств — плацента, которую можно рассматривать как своеобразную липидную мембрану. Прохождение медикаментов через нее зависит главным образом от растворимости в жирах. Помимо растворимости в жирах и степени ионизации, на преодоление плацентарного барьера влияют степень связывания лекарственного соединения с белками плазмы и интенсивность плацентарного кровотока. Такие высокоионизированные препараты, обладающие к тому же низкой растворимостью в жире, как тубокурарин и дитилин, проходят через плаценту крайне медленно. Для ингаляционных анестетиков и тиопентал-натрия быстро устанавливается равновесие между кровью матери и плода. Морфин и другие наркотические анальгетики также легко попадают в кровь плода, что имеет важное значение для понимания путей профилактики депрессии новорожденных непосредственно после родов. Помимо перечисленных факторов, влияющих на распределение и транспорт фармакологических средств, рассмотрим ряд понятий, используемых при оценке кинетики лекарственных препаратов. Реакция (или процесс) первого порядка характеризует скорость изменения содержания препарата, пропорциональную его концентрации. Это означает, что чем выше концентрация лекарственного средства в данном секторе, тем большее его количество покидает сектор за единицу времени, и наоборот. Так ведет себя большинство медикаментов в обычной терапевтической концентрации (например, морфин, тиопентал-натрий). Реакция (или процесс) нулевого порядка происходит с постоянной скоростью независимо от концентрации препарата, что обеспечивает элиминацию из сектора (или организма) постоянного количества фармакологического средства за единицу времени (примером может служить алкоголь). В некоторых случаях при введении слишком высоких доз препарата возможен переход от процесса первого порядка к нулевому. При этом элиминация замедляется и при продолжении поступления таких доз может быть достигнут токсический уровень. Проникновение препаратов через биологические мембраны может происходить в виде процесса как первого, так и нулевого порядка, хотя чаще действует первый механизм. Устойчивое состояние представляет собой динамическое равновесие, при котором поступление лекарственного препарата равно его выделению и содержание в секторе (или организме) остается постоянным. Время «полужизни» (период, или время, полувыведения — Т1/2) — время, требующееся для снижения концентрации лекарственного препарата в плазме на 50% после завершения периода абсорбции. Этот показатель имеет значение только для фармакологических средств, для которых характерен кинетический процесс первого порядка, поскольку при процессе нулевого порядка элиминация постоянного количества медикамента происходит независимо от концентрации. Концентрация в крови препаратов, вводимых внутривенно болюсно и подчиняющихся реакции первого порядка, вначале падает очень быстро. Это распределительная фаза, или а-фаза (Т1/2а), которая имеет значение только для небольшого числа препаратов. Тем не менее она представляет интерес для анестезиологов, часто производящих внутривенные болюсные инъекции (например, барбитуратов). Затем концентрация препарата падает более медленно. Это фаза элиминации — бета-фаза (Т1/2бета), в которой препарат окончательно выводится из организма. Некоторые авторы именно эту фазу определяют как «полужизнь» фармакологического средства. Следует иметь в виду, что период полувыведения отнюдь не идентичен прекращению на 50% фармакологического действия медикамента, хотя в целом длительность эффекта, безусловно, находится в прямой зависимости от периода полувыведения. Условный («кажущийся») объем распределения (Уо) характеризует зависимость между количеством препарата в организме и его концентрацией в плазме после абсорбции и распределения: VD = Xp/C, где XD — доза препарата; С — концентрация в плазме после полного распределения препарата в организме и достижения равновесия. Следует подчеркнуть, что это полностью условная гипотетическая величина, предполагающая равномерность распределения лекарственного соединения по всем секторам организма и отражающая реальный анатомический объем. VD зависит главным образом от свойств медикамента, а не от истинной величины тела и может варьировать в широких границах. Большой объем V d свидетельствует о широком распределении препарата или потреблении его тканями. Условный характер этого показателя и многочисленные допущения приводят к тому, что для некоторых препаратов VD может превышать истинный объем тела, указывая на то, что в некоторых тканях концентрация значительно выше, чем в крови. Наоборот, очень низкий V d означает, что значительная часть препарата осталась в крови, а потребление его тканями невелико. Элиминация (процесс удаления лекарственного препарата из организма) представляет собой сумму двух составляющих — метаболических преобразований и экскреции соединения. Превалирование того или иного компонента или их одновременное сочетание зависит от химических свойств соединений. Часть препаратов выделяется из организма неизмененными, другие должны подвергнуться процессу метаболизма до образования промежуточных продуктов, которые затем выделяются из организма. На первый взгляд, клиницисту безразлично, каким путем и как быстро подвергается метаболическим превращениям фармакологическое соединение. Однако это не так. Понимание механизма и последствий метаболической трансформации лекарственных средств важно не только с точки зрения фармакокинетики, но и с позиций фармакодинамики: 1) образующиеся в процессе метаболизма промежуточные продукты могут обладать фармакологической активностью (например, образующийся при распаде дитилина сукцинилмонохолин способен вызывать релаксацию); 2) метаболиты могут давать токсический эффект (в частности, продукты метаболизма метоксифлурана способны вызывать поражение почек); 3) путем торможения метаболизма лекарственного препарата можно продлить его действие (так, применение антихолинэстеразных средств увеличивает длительность действия дитилина); 4) интенсификация метаболизма медикамента укорачивает длительность его действия (например, барбитураты способны уменьшать продолжительность эффекта непрямых антикоагулянтов). Два последних примера иллюстрируют практическое значение не только метаболизма медикаментов, но и взаимодействия лекарственных препаратов, к чему мы еще вернемся. Забегая вперед, отметим, что одним из главных путей зкскреции лекарственных средств является их выделение почками. Растворимые в жирах вещества легко проходят клубочковый аппарат и поступают в канальцы, где столь же легко реабсорбируются через липидные мембраны тубулярных клеток. Создается замкнутый цикл, выход из которого заключается в метаболических превращениях в водорастворимые (и менее липофильные) соединения. В процессе метаболизма лекарственные средства подвергаются реакциям двух видов — так называемым функционализации и сопряжению (конъюгации). «Функционализация» заключается во введении, раскрытии или модификации специфических химических групп и осуществляется с помощью окисления, восстановления или гидролиза. «Сопряжение» подразумевает соединение самого лекарственного препарата или его главного метаболита, образующегося при «функционализации», с такими эндогенными соединениями, как уксусная, глициновая, сернистая или глюкуроновая кислоты. Получающиеся при этом вещества обычно (хотя и не всегда) обладают выраженной растворимостью в воде. Метаболические преобразования происходят главным образом в печени, хотя могут протекать практически во всех тканях и клетках, особенно в легких, кишечнике, крови. Ферменты, осуществляющие окисление, восстановление, гидролиз или образование соединений с кислотами, располагаются в эндоплазматической сети, пронизывающей клетки и относящейся к микросомальному аппарату. Для метаболических превращений некоторых лекарственных средств требуется один из этих процессов, однако большинство нуждается по меньшей мере в двух. Микросомальная ферментная система окисления фармакологических средств неспецифична и многофункциональна, что создает условия для биотрансформации практически всех лекарственных препаратов. Ее каталитические компоненты включают флавопротеиновые редуктазы, фосфолипиды и гемопротеины с NADPH и молекулярным кислородом в качестве кофакторов. Цитохром бета-450 служит терминальной оксидазой в сложной цепи реакций и принимает непосредственное участие в связывании медикамента с микросомами. Другие реакции — восстановление, отсоединение радикала (например, диметилирование, деаминирование и др.), разрушение кольца ароматического соединения — осуществляются также с помощью микросомальных ферментов, хотя и реже, чем окисление. Довольно частой реакцией является гидролиз эфирных связей (примером служит гидролиз, вызываемый холинэстеразой). В гидролизе принимают участие также микросомальные ферменты. Наконец, большую группу реакций составляет «сопряжение», при котором лекарственный препарат или продукты его метаболизма соединяются с эндогенными веществами (в их число входят производные обмена углеводов и аминокислоты). Укажем наиболее важные реакции «сопряжения»: метилирование, при котором донором метила служит метионин (например, метилирование катехоламинов), ацетилирование (в частности, сульфаниламидов), образование производных глюкуроновой кислоты (довольно распространенная реакция, участвующая в метаболизме таких препаратов, как морфин, стероидные гормоны и др.), соединение с глицином, глутамином и др. Активность метаболических преобразований лекарственных препаратов в организме зависит от множества факторов. Среди них наиболее важными являются особенности метаболизма, генетически присущие данному лицу, возраст больного, эффект внешних воздействий (оперативное вмешательство, анестезия), действие различных заболеваний, в особенности болезней печени и почек, и многие другие. Вторая составляющая элиминации — экскреция, которая происходит через почки, легкие, кишечник. Лекарственные препараты могут выделяться в неизмененном виде или после метаболических превращений. Выделение лекарственного средства с мочой определяется тремя факторами — гломерулярной фильтрацией, тубулярной реабсорбцией и тубулярной секрецией. Гломерулярная фильтрация зависит от молекулярной массы и концентрации свободного препарата в плазме. Через гломерулярные капилляры могут проходить практически все растворы. Однако медикаменты, связанные с белками плазмы, остаются в крови. В целом экскреция препаратов через почки зависит от растворимости в жирах, причем соединения с большим коэффициентом жир/вода и в неионизированной форме легко реабсорбируются из гломерулярного фильтрата через тубулярный эпителий. Ионы не способны переходить через эту границу. Лекарственные средства выделяются также в проксимальных канальцах. Здесь протекает активный транспорт органических кислот и оснований в виде ионизированных молекул. Фармакологические препараты могут попадать в мочу и путем пассивной диффузии через тубулярный эпителий. Физико-химические факторы, влияющие на абсорбцию лекарств из желудочно-кишечного тракта (растворимость в воде, коэффициент жир/вода), воздействуют также на элиминацию этих соединений или их метаболитов в кишечник и дальнейшее удаление с калом. Кроме того, в качестве специализированного транспортного механизма экскреции лекарственных препаратов через желудочно-кишечный тракт действует желчная система. Этим путем выделяются главным образом препараты с высокой молекулярной массой, подвергающиеся метаболическим превращениям в печени. Существует также механизм активного транспорта кислот и оснований из крови в желчь, который напоминает механизмы, действующие в почках. Поскольку элиминацию можно рассматривать как очищение, самой важной ее количественной характеристикой служит клиренс плазмы — скорость, с которой происходит элиминация лекарственного средства на единицу его концентрации в плазме. Клиренс служит также мерой эффективности элиминации и измеряется в литрах в час или в миллилитрах в минуту. Клиренс обратно пропорционален Т1/2(чем меньше Т1/2, тем выше клиренс, и наоборот) и прямо пропорционален V d (при любом Т1/2, чем больше объем распределения, тем больше клиренс). Практическое значение имеет оценка двух путей клиренса плазмы. Почечный клиренс (Сlr) можно определить как скорость выделения лекарственного препарата с мочой в соответствии с формулой:
где Си — концентрация медикамента в моче; V —скорость тока мочи; С,,— концентрация препарата в плазме.
Если лекарственное соединение не реабсорбируется (или не секретируется) в канальцах, его клиренс равен скорости гломерулярной фильтрации (130 мл/мин). Липофильные препараты — слабые кислоты и основания — мало ионизированы и подвергаются интенсивной реабсорбции. В таких случаях почечный клиренс всегда меньше скорости гломерулярной фильтрации. Если препарат выделяется путем активного транспорта (секреции) через канальцы, то клиренс соответствует почечному плазмотоку независимо от гломерулярной фильтрации. Чаще всего (за исключением препаратов, секретируемых в канальцах) почечный клиренс происходит по типу реакции первого порядка. Печеночный клиренс — это объем крови, протекающей через печень за единицу времени, из которого полностью удаляется лекарственное средство. Таким образом, печеночный клиренс является производным печеночного кровотока и способности печени экстрагировать и метаболизировать лекарственный препарат. Иногда печеночный клиренс определяют как фракцию препарата, экстрагируемую из притекающей к печени крови (отношение экстракции — ERh). Если ERh равно 1, то при каждом пассаже крови происходит удаление всего содержащегося в ней количества лекарства, при ER^, равном 0,5, экстрагируется только 50%. Отношение экстракции ER можно считать и фракцией печеночного кровотока, которая полностью очищается от препарата в течение каждого пассажа. Тогда клиренс (С1н) равен этой фракции кровотока: Clh = ERh - Qh, где Qh — печеночный кровоток. Зависимость печеночного клиренса от печеночного кровотока, степени экстракции и метаболической активности печени иллюстрируют следующие примеры. Если печеночный кровоток уменьшается без каких-либо изменений метаболической активности, то препарат с очень высоким печеночным клиренсом удаляется намного медленнее, а удаление препарата с малым печеночным клиренсом почти не изменяется. Наоборот, если способность печени метаболизировать медикамент резко возрастает, то увеличение клиренса более выражено по отношению к лекарствам с исходно низким метаболизмом, чем к препаратам, которые исходно подвергаются интенсивной печеночной экскреции. Говоря о печеночном клиренсе, следует упомянуть о так называемом эффекте первого пассажа. Это понятие характеризует потребление и элиминацию препарата в печени во время первого поступления его (пассажа) в кровоток при приеме внутрь, введении интраперитонеально или в сосуды системы портальной вены. В результате первого пассажа значительная часть принятой дозы препарата не достигает общего кровотока. Этот эффект имеет для анестезиологии и реаниматологии меньшее значение, чем общая концепция печеночного клиренса, поскольку в анестезиологической практике упомянутые пути введения используют сравнительно мало. Завершая рассмотрение вопросов общей фармакокинетики, отметим, что для характеристики и изучения в целом поведения лекарственных препаратов в организме предложены различные модели, поддающиеся графическому и математическому описанию. Они варьируют по сложности. Наиболее простая, односекторная модель предполагает, что лекарственный препарат распределяется мгновенно и равномерно во всех жидкостях и тканях организма. Привлекая простотой, эта модель не способна точно отразить истинное поведение фармакологического средства в организме во времени. Двухсекторная модель подразумевает, что медикамент распределяется между центральными и периферическими секторами. Эту модель используют чаще, и она во многом удовлетворительно «описывает» кинетическую судьбу препарата. Однако для некоторых лекарственных соединений требуется более сложный анализ, что заставляет использовать трехсекторную и даже многосекторные модели. Под центральными секторами обычно понимают кровь и те органы, которые получают большую часть сердечного выброса (мозг, сердце, печень, почки) Однако эти секторы являются абстракцией и не «описывают» истинной кинетики процесса в определенном органе. Периферические секторы обычно обозначают ткани с ограниченным объемом перфузии крови (мышцы, скелет, жировая и соединительная ткань). Применяемые в фармакокинетике модели многие клиницисты рассматривают как экзотические математические игры, ничего или мало дающие практической медицине. Это, конечно, не так. Более того, используемые модели открывают путь к пониманию, а в некоторых случаях и к предсказанию зависимости эффекта препарата от его кинетики. Тем не менее, как и вообще в математическом моделировании, фармакокинетические модели имеют ограничения. В связи с этим за последние годы наметилась тенденция к развитию так называемой физиологической фармакокинетики, которую отличает от классической использование не абстрактных, а конкретных величин, таких как размеры органа, объем кровотока в нем и т.д.
8.2. Фармакокинетика средств, применяемых в анестезиологии
В этом разделе мы обсудим вопросы частной фармакокинетики. Ограниченные рамки главы позволяют сделать это лишь в самом общем виде, рассматривая кинетику отдельных препаратов только в качестве примеров. Начнем с ингаляционных анестетиков, по-прежнему занимающих важное место в практической работе анестезиолога. Ингаляционные анестетики. Описание фармакокинетики ингаляционных анестетиков, как и построение математических моделей, облегчает тот факт, что их потребление, распределение и элиминация с определенными оговорками подчиняются тем же закономерностям, что и движение жидкости в системе цилиндрических контейнеров, соединенных трубками. Объем содержащейся в контейнерах воды представляет количество паров анестетика. Контейнеры соответствуют различным органам и тканям и представляют собой аккумулирующие емкости для анестетиков (их можно рассматривать и как секторы). По трубкам происходит доставка анестетика в легкие (вентиляция) и от легких в ткани (кровообращение). Внутренние органы (сердце, мозг, печень, почки, кишечник) имеют небольшой объем и, следовательно, небольшую аккумулирующую емкость, чему соответствует небольшой контейнер. Но они получают богатое кровоснабжение, что отражено в виде толстой трубки. Мышцы имеют большой объем и умеренное кровоснабжение, чему соответствует узкая трубка. Наконец, жировая ткань имеет умеренный объем, но большую аккумулирующую емкость, так как ингаляционные анестетики лучше растворяются в жирах, чем в воде. Этому соответствует большой контейнер, а плохое кровоснабжение выражено очень узкой трубкой. Используя описанную схему, можно представить себе такую последовательность событий. Когда открывают кран, вода через трубку начинает перетекать в контейнер, соответствующий легким, в котором ее уровень повышается. Аналогично этому при включении испарителя анестетик благодаря вентиляции поступает в легкие, где его напряжение (парциальное давление) начинает повышаться. Из легких анестетик с кровью поступает во все ткани. Благодаря большой трубке в маленьком контейнере («внутренние органы») напряжение анестетика растет быстро параллельно увеличению его напряжения в легких. В отличие от этого большой контейнер («мышцы») снабжается маленькой трубкой, в связи с чем в мышцах напряжение растет медленно и значительно отстает от такового в легких. Эта закономерность еще более выражена при распределении анестетика в жировой ткани. Если бы анестетик не подвергался метаболическим превращениям, то, в конце концов, во всех тканях было бы достигнуто напряжение, соответствующее постоянной вдыхаемой концентрации. Для большинства анестетиков такое уравнивание (или близкое к равновесию состояние) действительно наступает, поскольку метаболическая трансформация ингаляционных анестетиков (за исключением трихлорэтилена) незначительна. На скорость достижения равновесия может влиять величина вдыхаемой концентрации: чем выше концентрация, тем скорее наступает уравнивание. Однако этот эффект становится ощутимым только при очень высокой концентрации, поэтому сказанное практически касается только закиси азота. Определенное влияние на описанный процесс оказывают физико-химические свойства анестетиков, в частности их растворимость в крови и тканях. В соответствии с коэффициентом растворимости Оствальда (он ниже 1 для всех газообразных анестетиков и выше — для всех парообразных) растворимость закиси азота и циклопропана низкая, изофлурана, энфлурана и фторотана — высокая, а хлороформа, трихлорэтилена, метоксифлурана и диэтилового эфира — очень высокая. Растворимость перечисленных анестетиков в воде тканей соответствует или даже выше их растворимости в крови. Растворимость анестетиков в жировой ткани существенно превышает этот показатель для крови. Как же влияет растворимость анестетиков на процессы их потребления и распределения? Анестезиолога интересует не столько факт достижения полного равновесия, сколько напряжение анестетика в мозге и других органах. При применении таких высокорастворимых анестетиков, как метоксифлуран и диэтиловый эфир, равновесие достигается крайне медленно и требует нескольких дней и даже недель до полного завершения. В связи с этим возникает вопрос, как вообще возможно введение в анестезию с помощью препаратов, обладающих такой высокой растворимостью. Ответ достаточно прост: для введения в анестезию используют вдыхаемую концентрацию, которая во много раз выше требующейся мозгу для возникновения состояния анестезии. После достижения необходимой глубины анестезии анестезиолог снижает вдыхаемую концентрацию. Более того, для поддержания постоянной концентрации в крови напряжение анестетика во вдыхаемом газе следует и далее постепенно снижать. Это рассуждение применимо (хотя и в меньшей степени) к таким удовлетворительно растворимым агентам, как фторотан и энфлуран. Влияние растворимости анестетиков и различия в достижении равенства концентраций в отдельных регионах обусловливают и другие явления. При применении высокорастворимых препаратов система обладает выраженной инерцией и изменения вдыхаемой концентрации вызывают лишь небольшие сдвиги напряжения анестетика в легких и мозге. Иная ситуация возникает при использовании анестетика низкой растворимости: изменения вдыхаемой концентрации быстро сопровождаются почти равным сдвигом напряжения в легких и мозге, что позволяет анестезиологу легко контролировать концентрацию в мозге и, следовательно, глубину анестезии. Наконец, при выходе больного из состояния анестезии этот процесс идет быстрее в случае применения анестетиков малой растворимости и, наоборот, весьма продолжителен при использовании препаратов хорошей, особенно высокой, растворимости. Необходимо также указать ряд других факторов, существенно влияющих на фармакокинетику ингаляционных препаратов: питание больного (величина жировых депо), его возраст (при прочих равных условиях введение в анестезию и выход из нее у детей осуществляются быстрее, чем у взрослых), контур наркозного аппарата, изменения вентиляции и кровообращения. Если опустить детали, то можно сказать, что между объемом вентиляции и скоростью изменения концентрации анестетика во внутренних органах (прежде всего в мозге) существует прямая зависимость: при увеличении объема вентиляции ускоряется введение в анестезию, быстрее наступают изменения концентрации в периоде поддержания; при уменьшении объема вентиляции происходит обратное. С другой стороны, любое уменьшение кровотока к внутренним органам и тканям, за исключением мозга, снижает доставку к ним анестетика. Концентрация препарата в легких повышается, что сопровождается увеличением напряжения анестетика в мозге. В связи с этим при синдроме малого сердечного выброса с сохранением мозгового кровотока анестезия наступает быстрее, а в периоде поддержания при той же вдыхаемой концентрации происходит углубление анестезии. Напротив, высокий сердечный выброс, как ни парадоксально, может удлинить период введения. Рассматривая фармакокинетику ингаляционных анестетиков, мы прибегли к значительным упрощениям, не упомянули множество важных обстоятельств и деталей, с которыми читатель при желании может ознакомиться в хорошо иллюстрированной и доходчиво написанной работе W. W. Mapleson (1983). Внутривенные анестетики, снотворные, анальгетики. Барбитураты. Первая версия о коротком действии тиопентал-натрия была основана на его быстрой элиминации из организма. Однако совершенствование метода определения барбитуратов в крови заставило изменить эту точку зрения. Прежде всего было установлено, что период полувыведения тиопентал-натрия после внутривенной инъекции однократной дозы составляет 4,6 ч, что слишком много для объяснения короткого действия препарата. Как было показано в дальнейшем, хорошая растворимость тиопентал-натрия в липидах в сочетании с высокой интенсивностью мозгового кровотока приводит к быстрому проникновению препарата в ЦНС. Быстрое прекращение его действия было объяснено перераспределением препарата из мозга в жировую ткань, обладающую большим объемом для тиопентал-натрия, но со значительно меньшим, чем в ЦНС, кровоснабжением. Описанная интерпретация течения анестезии тиопентал-натрием была одной из первых и удачных попыток фармакокинетического анализа клинического действия лекарственного препарата. Успехи аналитической техники позволили уточнить кинетику тиопентал-натрия. Пик концентрации его в плазме после болюсной инъекции наступает уже в течение одного кругооборота крови. Одновременно вступают в действие две фазы распределения. Полупериод быстрого распределения (Т1/2а) колеблется от 2 до 4 мин, а полупериод медленного распределения (Т12бета) составляет 45—60 мин. С большей долей вероятности можно предположить, что фаза быстрого распределения характеризует уравновешивание центрального сектора, обладающего богатой васкуляризацией, с более медленно уравновешиваемым небольшим сектором (возможно, скелетные мышцы). Именно в этой фазе наступает пробуждение после введения однократной небольшой дозы тиопентал-натрия. Через 12—17 мин начинает преобладать фаза медленного распределения, которая отражает уравновешивание двух упомянутых секторов с третьим, еще более медленно уравновешиваемым (очевидно, жировые депо). Эта фаза длится 2—4 ч до наступления терминальной фазы элиминации. Как показали исследования, период полувыведения тиопентал-натрия составляет 10—12 ч (для доз, не превышающих 2 г), причем элиминация происходит по типу реакции первого порядка. При дозе выше 2 г элиминация препарата идет по типу процесса нулевого порядка, т.е. скорость ее не зависит от дозы. Эти особенности кинетики тиопентал-натрия могут оказаться важными для понимания продолжительности его действия при использовании его в качестве антигипоксанта в больших дозах. Из сказанного очевидна важность для характеристики фармакокинетики тиопентал-натрия учета особенностей его элиминации, которая, как и для других лекарственных средств, определяется двумя факторами — клиренсом и объемом устойчивого распределения. Клиренс препарата почти полностью зависит от метаболизма в печени. Данное обстоятельство объясняется тем, что высокая жирорастворимость тиопентал-натрия ведет к энергичной реабсорбции его в почках. С мочой при этом выделяется лишь незначительное количество неизмененного препарата. Установлено, что общий клиренс тиопентал-натрия колеблется от 1,6 до 4,3 мл/(кг х мин). Происходящие в печени обменные превращения препарата обусловлены главным образом окислением, результатом которого служит образование углекислого тиопентала — фармакологически неактивного соединения. Лишь небольшое количество препарата подвергается десульфуризации с образованием фармакологически активного этаминала, который впоследствии подвергается метаболической инактивации. Через 15 мин после введения 0,5—1,25 г тиопентал-натрия в крови можно обнаружить только небольшое количество этаминала. Однако следует иметь в виду, что использование в течение 2—3 дней больших доз тиопентала (300— 500 мг/кг) может сопровождаться образованием этаминала в довольно высокой концентрации. Следует напомнить, что при однократном болюсном введении тиопентал-натрия прекращение его наркотического эффекта связано главным образом с его перераспределением из мозга в мышцы и жир, а не с метаболической трансформацией, которая через 1 мин после инъекции составляет 14%, а через 15 мин — только 18%. Интенсивное распределение тиопентал-натрия объясняется его высокой жирорастворимостью (устойчивый объем распределения составляет от 1,3 до 3,3 л/кг). Забегая вперед, укажем, что некоторые другие препараты, используемые для внутривенной анестезии, также имеют большой объем распределения (кетамин — 3 л/кг, фентанил и морфин — 3—5 л/кг). Тиопентал-натрий обладает умеренной способностью к связыванию с белками, особенно альбуминами (свободная фракция составляет 15—25%). С одной стороны, увеличение свободной фракции (в частности, при уменьшении количества альбуминов или захвате их связей другими лекарственными средствами) соответственно акцентирует его фармакологический эффект (на мозг) и побочные действия (на сердечно-сосудистую систему). С другой стороны, при увеличении свободной фракции препарата усиливается его перераспределение из мозга в другие ткани и укорачивается анестезия. Понимание описанных особенностей фармакокинетики тиопентал-натрия позволяет усилить или изменить его действие на фоне сопутствующих заболеваний (например, потребность в меньшей дозе для достижения того же эффекта на фоне гипопротеинемии, при нарушениях функции печени, у больных пожилого возраста и т.д.). Фармакокинетика гексенала определяется практически теми же факторами, что и тиопентал-натрия, и отличается лишь в небольшой степени. Так, период полувыведения гексенала составляет 4,5—5,5 ч, клиренс — 3,3— 3,6 мл/(кг х мин), объем устойчивого распределения— 1 —1,25 л/кг. Сопутствующие заболевания оказывают на фармакодинамику гексенала то же влияние, что и на фармакодинамику тиопентал-натрия. Пропанидид. Этот препарат — известный пример анестетика с коротким действием, широко используемого для проведения небольших операций (например, малых гинекологических вмешательств). Выход из состояния анестезии после однократного применения или инфузии препарата обусловлен превращением его под действием псевдохолинэстеразы плазмы в метаболиты, не обладающие наркотической активностью. Однако некоторые данные позволяют считать, что часть препарата все же может подвергаться метаболическим превращениям другим путем или выделяться в неизмененном виде. Распределение препарата играет незначительную роль в прекращении его действия. Скорость метаболизма пропанидида прямо пропорциональна его концентрации, т.е. подчиняется реакции первого порядка. Кетамин. Популярность этого анестетика выдвинула его на одно из первых мест по частоте использования как при кратковременной, так и при длительной общей анестезии. Препарат отличается высокой растворимостью в жирах, превышающей этот показатель тиопентал-натрия в 5- 10 раз, что обеспечивает его быстрое проникновение в ЦНС. Этому способствует и вызываемая кетамином стимуляция кровообращения. Удаление препарата из ЦНС также происходит быстро. Основной причиной прекращения центрального действия кетамина является быстрое перераспределение препарата из мозга в другие ткани. Биотрансформация кетамина осуществляется путем диметилирования печеночными микросомальными ферментами с образованием норкетамина. Затем наступают гидроксилирование ароматического циклогексиламинового кольца в двух различных позициях и «сопряжение», экскреция или дегидратирование до дегидроноркетамина. Известны и другие пути метаболических превращений. Диазепам блокирует некоторые этапы метаболизма кетамина, что может несколько удлинить его действие. После внутривенной инъекции анестетик быстро распределяется по тканям и концентрация его в плазме резко падает (Т1/2 составляет 10—15 мин). Альфа-фаза завершается примерно через 30 мин. В дальнейшем концентрация падает медленно, о чем свидетельствует длительная бета-фаза (Т1/2 = 150—170 мин), которая зависит главным образом от метаболизма кетамина. Препарат только в небольшом количестве (около 2% введенной дозы) выделяется в неизмененном виде с мочой; остальную часть выводимых веществ составляют метаболиты кетамина. После длительной капельной внутривенной инфузии действие препарата прекращается также достаточно быстро. Бензодиазепины находят широкое применение в анестезиологии. Разнообразие препаратов (их число приближается к двадцати) дает возможность анестезиологу выбрать препарат в зависимости от специфических требований и условий. Бензодиазепины имеют незначительные различия в химической структуре, которые, однако, обусловливают существенную разницу физико-химических свойств, фармакологического действия и фармакокинетического поведения. В фармакокинетике бензодиазепинов большую роль играют метаболические превращения препаратов. Биотрансформация этих соединений происходит в печени, и от ее скорости зависит общий клиренс большинства бензодиазепинов. В ряде случаев обменные превращения препаратов, не обладающих фармакологической активностью, приводят к образованию фармакологически действующих метаболитов. Результатом биотрансформации активных бензодиазепинов может быть возникновение активных метаболитов, эффект которых важен для суммарного фармакологического действия. В биотрансформации бензодиазепинов принимают участие два основных пути метаболизма — окислительно-восстановительные реакции и реакции сопряжения (конъюгации). В соответствии с принятой в настоящее время классификацией производные бензодиазепина подразделяются на три группы в зависимости от периода полувыведения. К соединениям, характеризующимся длительной элиминацией (Т1/2бета более 24 ч), относятся хлозепид (хлордиазепоксид, элениум), диазепам (седуксен, реланиум, сибазон), мезапам (рудотель), нитразепам (эуноктин, родедорм). В группу препаратов со средней длительностью элиминации (Т1/2бета=5 — 24 ч) входят нозепам (оксазепам, тазепам) и проходивший в клиническую апробацию флунитразепам. Наконец, представителем препаратов с коротким периодом полувыведения (Г1/2бета менее 5 ч) является завоевавший популярность в западных странах мидазолам. Ограничимся указанием основных фармакокинетических свойств перечисленных препаратов (табл. 8.1). Из приведенных данных привлекают внимание два факта. Во-первых, как уже было указано, диазепам относится к числу медленно выделяющихся из организма препаратов. Естественно, это ухудшает управляемость оказываемым им действием даже в том случае, когда его вводят внутривенно. Отмеченного недостатка почти лишен короткодействующий препарат мидазолам, интерес к которому обусловлен именно возможностью управления эффектом: период его полувыведения в 15—20 раз меньше, чем диазепама, а общий клиренс превышает этот показатель диазепама в 20—30 раз. Во-вторых, продукт метаболической переработки диазепама — десметилдиазе-пам — дает фармакологический эффект и медленно выделяется из организма. На фармакокинетику бензодиазепинов влияет множество факторов: возраст, пол, нарушение работы ферментных систем, заболевания почек, печени и др.
Таблица 8.1. Фармакокинетические свойства бензодиазепинов [Reves J. G., 1983]
Наркотические анальгетики занимают важное место в арсенале средств, используемых в анестезиологии, что, естественно, повышает интерес к фармакокинетике этих препаратов. Изучение их действия осложняется рядом обстоятельств (многообразие путей введения, несовершенство методов определения концентрации анальгетиков и др.), что позволяет представить картину лишь ориентировочно. Мы сосредоточим основное внимание на внутривенном пути введения как наиболее целесообразном при использовании этих средств с целью анестезии. Для иллюстрации кинетики анальгетиков мы выбрали наиболее популярные препараты — морфин и фентанил. Определенные различия в фармакокинетике препаратов объясняются их жирорастворимостью. Обладающий высокой растворимостью в липидах фентанил быстро проникает через мембраны в ЦНС и столь же быстро ее покидает, что проявляется присущим этому анальгетику кратковременным эффектом. Морфин, будучи менее липофильным, проникает в ЦНС медленнее, хотя некоторые центральные проявления действия препарата (например, угнетение дыхания) становятся заметны почти сразу же после внутривенной болюсной инъекции. Вместе с тем хорошая растворимость фентанила в жирах (соотношение жир/плазма для фентанила составляет 35:1, а для морфина только 0,8:1) обусловливает его длительное депонирование в жировых депо, из которых он выделяется довольно медленно. В связи с этим он имеет относительно длительный период полуэлиминации (T1/2бета 2 — 5 ч). Необходимо учитывать влияние на фармакокинетику наркотических анальгетиков еще одного фактора — ионизации. Будучи слабыми основаниями, они подвергаются заметной ионизации (морфин при рН 7,4 ионизирован на 23%, а фентанил — на 9%). Более высокая степень ионизации снижает жирорастворимость, уменьшает связывание с белками (свободная фракция морфина в плазме составляет 70%, а фентанила только 9%), влияет на распределение между плазмой и другими жидкостными секторами организма, уменьшает реабсорбцию в почках и этим способствует выделению части препарата в неизмененном виде. Однако влияние на фармакокинетику всех перечисленных физико-химических свойств анальгетиков в определенной степени ослабляется высоким объемом распределения (VD). Биотрансформация наркотических анальгетиков в печени служит наиболее важным механизмом их элиминации, причем метаболиты выводятся главным образом почками. Так, конъюгация морфина с глюкуроновой кислотой обусловливает основной путь его метаболических превращений. Это соединение фармакологически мало активно и довольно легко выделяется почками. Однако при почечной недостаточности морфина глюкуронат накапливается в организме, может проникать и депонироваться в ЦНС и давать некоторый фармакологический эффект. В отличие от морфина метаболиты фентанила не обладают фармакологической активностью. Фентанил может быть использован без каких-либо последствий у больных с почечной недостаточностью. Особенности распределения, метаболизма и элиминации наркотических анальгетиков представлены в табл. 8.2.
Таблица 8.2. Некоторые показатели фармакокинетики морфина и фентанила [Hug С.С., 1983]
Разброс данных отражает различия в исследованиях, проведенных у здоровых и больных разного возраста в неодинаковых клинических условиях на фоне применения различных доз препаратов. На эти показатели существенно влияют оперативные вмешательства, искусственное кровообращение, колебания гемодинамики (соответственно перфузии органов и тканей), функциональное состояние печени и почек и т.д. Учет всех этих факторов необходим для объективного анализа фармакокинетики наркотических анальгетиков, отражающейся на их фармакологическом эффекте. Мышечные релаксанты. В целом их фармакокинетика подчиняется тем же механизмам, что и этот процесс у других лекарственных средств. Количество миорелаксанта, достигающее нервно-мышечного соединения, зависит от содержания свободной формы препарата в крови. Поскольку мышечные релаксанты вводят внутривенно, их концентрация в крови обусловлена дозой и скоростью введения, связыванием с белками, особенностями распределения и элиминации. Элиминация мышечных релаксантов из организма происходит тремя основными путями. Дитилин — единственный мышечный релаксант, который почти полностью подвергается метаболической трансформации в плазме. Панкуроний метаболизируется частично. Тубокурарин полностью выделяется из организма неизмененным. Как неизмененные формы препаратов, так и их метаболиты элиминируются из организма через почки и с желчью. Существуют и другие малоизученные пути выделения мышечных релаксантов экзокринными железами (главным образом слюнными), депонирования в тканях. На скорость накопления мышечных релаксантов в нервно-мышечном соединении влияет несколько факторов Кровоснабжение нервно-мышечного синапса существенно выше, чем мышц в целом. Переход миорелаксанта из кровотока в нервно-мышечное соединение почти не встречает сопротивления Наконец, достижение мышечным релаксантом постсинаптической мембраны и, возможно, двигательной пластинки требует только распределения во внеклеточном пространстве и не нуждается в прохождении через клеточную мембрану. Быстрая а-фаза падения концентрации миорелаксанта в крови зависит главным образом от распределения его в тканях. Бета-фаза определяется в основном экскрецией препарата с мочой и желчью (для тубарина Т1/2 бета составляет 1,3—2,9 ч, для панкурония — 1,6—2,4 ч). Поскольку мышечные релаксанты высокоионизированы, они с трудом проникают через клеточные мембраны и поэтому имеют небольшой объем распределения (начальный VD равен 0,08— 0,14 л/кг, а при достижении устойчивого состояния Vd составляет 0,2— 0,45 л/кг). Клиренс панкурония достигает 1 — 1,9 мл/(кг-мин), а тубокура-рина — 1,8—3,8 мл/(кг- мин). На клинический эффект мышечных релаксантов влияют такие фармакокинетические факторы, как экскреция с мочой (замедление экскреции при почечной недостаточности), элиминация и биотрансформация печенью (при печеночной недостаточности этот процесс может быть продолжительным), возраст (уменьшение клиренса панкурония из плазмы у пожилых людей и повышенная чувствительность новорожденных к тубокурарину), гипотермия (удлиняет действие антидеполяризующих релаксантов). Фармакокинетика деполяризующих мышечных релаксантов, в частности дитилина, мало изучена. Хорошо известен лишь механизм биотрансформации препарата, псевдохолинэстераза вызывает его распад до сукцинилмонохолина, а затем до сукциновой кислоты и холина. Довольно широко распространено мнение, что нервно-мышечный блок, вызываемый дитилином, прекращается благодаря этому процессу метаболических превращений. Подобная точка зрения ошибочна. В действительности метаболическая трансформация препарата в плазме определяет лишь его количество, которое достигает нервно-мышечного соединения. Прекращение нервно-мышечной блокады происходит главным образом благодаря вымыванию дитилина из нервно-мышечного соединения. Короткое парализующее действие этого миорелаксанта обусловлено быстрым исчезновением его из плазмы в результате как биотрансформации, так и перехода во внесосудистое пространство. Выделение дитилина с мочой составляет менее 10% введенной дозы и мало влияет на кинетику элиминации.
СПИСОК ЛИТЕРАТУРЫ Закусов В.В., Комиссаров И.В., Синюхин В.Н. Общая фармакология // Клиническая фармакология / Под ред. В.В. Закусова.— М., 1978.— С. 22—63. Соловьев В.Н., Фарсов А.А., Фишман В.М. Фармакокинетика.—М.: Медицина, 1980. Холодов Л.Е., Яковлев В.П. Клиническая фармакокинетика: Руководство.— М.: Медицина, 1985. Gibaldi М., Levy G. Pharmacokinetics in clinical practice, a. Applications//J. A. M. A.— 1976.—Vol. 235, N 18.—P. 1987—1992. Hug С.С. Pharmacokinetics and dynamics of narcotic analgesics // Pharmacokinetics of anaesthesia / Ed. C. Prys-Roberts, С.С. Hug.— Oxford, 1983.— P. 187—234. Hull C.J. General principles of pharmacokinetics // Pharmacokinetics of anaesthesia / Ed. C. Prys-Roberts, C. C. Hug.—Oxford, 1983.—P. 1—24. Mapleson W. W. Pharmacokinetics of inhalation anaesthetics. // Pharmacokinetics of anaesthesia / Ed. C. Prys-Roberts, C. C. Hug.—Oxford, 1983.—P. 89—111. Miller R. D. Pharmacokinetics of muscle relaxants and their antagonists // Pharmacokinetics of anaesthesia / Ed. C. Prys-Roberts, C. C. Hug.—Oxford, 1983.—P. 246-269. Moffat J. A, Milne B. Pharmacokinetics in anaesthesia // Canad. Anaesth. Soc. J.— 1983.— Vol. 3, N 3.— Pt. I.—P. 300—307. Nimmo W.S., Clements J.A. Ketamine // Pharmacokinetics of anaesthesia / Ed. C. Prys-Roberts, C. C. Hug.-Oxford, 1983.—P. 235—245 Norman J. The I. V. administration of drugs // Brit. J Anaesth — 1983 Vol 55, N 1 1 P. 1049 – 1052. Prys-Roberts С., Hug С.С. Pharmacokinetics of anaesthesia Oxford' Blackwell Sci Publ, 1983. Prys-Roberts C., Sear J.W. Non barbiturate intravenous anaesthetics and continuous infusion anaesthesia//Pharmacokinetics of anaesthesia / Ed. Prys-Roberts J., Hug С.С.—Oxford, 1983.-P. 128—156. Reues J.G. Benzodiazepines // Pharmacokinetics of anaesthesia / Ed. Prys-Roberts C., Hug C. C.—Oxford, 1983.—P. 157—186. Sear J.W. Effect of renal and hepatic disease on pharmacokinetics of anaesthetic agents // Pharmacokinetics of anaesthesia / Ed. C. Prys-Roberts, C. C. Hug.—Oxford, 1983.—P. 64—88 Stanski D.R. Pharmacokinetics of barbiturates // Pharmacokinetics of anaesthesia / Ed Prys-Roberts C., Hug C. C.—Oxford, 1983.—P. 112—127. Symposium on pharmacokinetic aspects in therapy//Triangle.— 1975.—Vol. 14, N 3/4.-P. 99—160. Vickers M.D., Schnieden H., Wood-Smith F.G. Drugs in anaesthetic practice.—6-th ed.— London: Butterworth, 1984. Глава 9 Дата добавления: 2015-02-05 | Просмотры: 1557 | Нарушение авторских прав |