|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Внутривенная общая анестезия
Внутривенная общая анестезия достигается путем введения общего анестетика в венозное кровяное русло, откуда происходят проникновение его в ЦНС и распределение по органам и тканям с последующим развитием характерных для каждого фармакологического агента центральных и периферических проявлений общей анестезии. Используемые для внутривенной анестезии средства многочисленны и принадлежат к различным фармакологическим группам. В современной анестезиологии практически не существует ситуаций, когда какое-либо средство общей анестезии (в том числе внутривенной) применялось бы в чистом виде (моноанестезия). В большинстве случаев для достижения полноценной внутривенной анестезии применяется комбинация различных общих анестетиков (чаще всего гипнотик и анальгетик), однако даже там, где для общей анестезии применяется единственный агент, например пропанидид при кратковременных хирургических или эндоскопических манипуляциях, вряд ли правомочно говорить о моноанестезии, так как ей обязательно предшествует премедикация, при которой как минимум используют анальгетик (промедол) и ваголитик (атропин), а нередко и психотропные и ангигистаминные препараты. Премедикация, включающая нейротропные вещества, оказывает существенное влияние на основной и побочные эффекты общего анестетика (см. ниже) и потому фактически является компонентом общей анестезии, учет которого необходим при оценке эффекта вводимого на этом фоне общего анестетика. В этом разделе приводится характеристика внутривенных наркотических средств, общей характерной чертой которых является глобальное дезорганизующее действие на ЦНС с развитием потери сознания и снижения реакций на внешние раздражители. Другие средства внутривенной общей анестезии с избирательным диапазоном центрального действия (наркотические анальгетики, транквилизаторы, нейролептики) рассматриваются в разделе, посвященном специальным методам комбинированной общей анестезии. Впервые мысль о введении лекарственных веществ непосредственно в кровяное русло была высказана еще в XVII в. Ч. Вреном, который вводил внутривенно собакам раствор опия. Однако началом эпохи внутривенной анестезии следует, по-видимому, считать 1857 г., когда Н.И. Пирогов впервые внутривенно ввел человеку эфир с целью достижения наркоза. В последующие десятилетия этот способ анестезии был забыт из-за отсутствия безопасных и эффективных фармакологических средств. Внедрение внутривенной анестезии в клинику в начале 1900-х годов связано с именем Н.П. Кравкова, использовавшего для этой цели гедонал. Главным рубежом, повлиявшим на весь ход развития анестезиологии, явились 30-е годы XX в.: был синтезирован и впервые применен для внутривенной анестезии барбитуровый препарат короткого действия эвипан-натрий [Weese H., Scharpff W., 1932]. С тех пор внутривенный наркоз получил широкое распространение в анестезиологии. Примерно в течение двух десятилетий барбитураты считались единственным средством внутривенной анестезии. Клиническая фармакология барбитуратов подробно освещена как в зарубежной, так и в отечественной литературе. В силу своих преимуществ (простота и удобство применения, доступность, легкая управляемость анестезией) барбитураты, как и 40 лет назад, широко используются, но по мере накопления опыта выявились серьезные недостатки, ограничивающие их применение у многих больных и послужившие стимулом к изысканию новых, более совершенных небарбитуровых средств внутривенной анестезии. За полвека, прошедшие со времени открытия барбитуратов, анестезиология обогатилась многими средствами внутривенной общей анестезии разнообразной химической природы и с разным спектром свойств. Среди них препараты короткого и длительного действия, разной степени токсичности и выраженности анестетического эффекта. Несмотря на разнообразие свойств, средства внутривенной анестезии, как и ингаляционной, объединены одной общей закономерностью: главным и непременным проявлением их действия служит выключение сознания, в основе которого лежит обратимая функциональная блокада диффузной активирующей системы — ретикулярной формации среднего мозга, а подавление реакции на внешние раздражители, т.е. развитие общей анестезии как таковой происходит вторично, нередко на фоне глубокой общей наркотической депресси ЦНС. Исключением из этого ряда является кетамин, мощное анальгетическое действие которого проявляется при частично или полностью сохраненном сознании. Нейрофизиологические механизмы действия этого общего местетика своеобразны (см. ниже) и не позволяют поставить его в один ряд с другими препаратами. Многие из некогда популярных внутривенных общих анестетиков в настоящ ее время утратили свое практическое значение и вытеснены новыми, более совершенными. Это относится, например, к наркотическим препаратам так называемого метаболического ряда (т.е. близким по химической структуре некоторым веществам человеческого организма): геминеврину, имеющему слишком слабые анестетические свойства, и виадрилу, применение которого было ограничено вследствие раздражающего влияния его на сосудистую стенку и нередкого развития посленаркозных флебитов. Другие существующие два-три десятилетия внутривенные общие анестетики, прошедшие этап интенсивного клинического изучения, имеют ограниченные показания к применению (пропанидид, натрия оксибутират). Наконец, ряд препаратов последнего поколения (альтезин, кетамин, этомидат) находятся в стадии широкого клинического применения и клинико-экспериментальных исследований. Поиск новых препаратов этого типа продолжается, но не столь интенсивно, как прежде, поскольку в последние 20 лет усилия химиков, фармакологов и клиницистов в значительной степени переключены на создание и внедрение в практику внутривенных анестетиков с селективными свойствами (анальгетики, транквилизаторы, нейролептики). Вместе с тем внутривенные наркотические препараты по-прежнему имеют широкое применение в анестезиологии как для вводной анестезии, так и для самостоятельного обезболивания при ряде оперативных вмешательств и диагностических исследований. Общая анестезия барбитуратами. Среди существующих средств общей анестезии барбитураты наиболее прочно сохраняют свое место в практической анестезиологии на протяжении вот уже полувека, являясь типичными представителями наркотических веществ. Несмотря на создание за этот период многих сотен производных барбитуровой кислоты, не выявлено их существенных преимуществ перед старыми, классическими представителями этого ряда — тиопентал-натрием и гексеналом, которые продолжают широко применяться как в отечественной, так и в зарубежной анестезиологии. Физико-химические свойства и фармакокинетика. Гексенал (натрия эвипан) представляет собой натриевую соль барбитуровой кислоты, а тиопентал-натрий (пентотал) — натриевую соль тиобарбитуровой кислоты. Оба препарата легко образуют нестойкие водные растворы с резко щелочной реакцией (рН более 10,0), которые должны быть использованы в течение 1 ч с момента приготовления. Целесообразно медленное введение слабо концентрированных (1—2%) растворов обоих препаратов для получения менее выраженного наркотического действия, без нарушения жизненно важных функций. Начальная доза барбитуратов колеблется от 3 до 10 мг/кг в зависимости от физического состояния, возраста больного и характера преднаркозной подготовки. Длительность наркотического сна не превышает 20 мин. В связи с небольшой широтой терапевтического действия и значительной кумулятивной способностью барбитуратов разовая доза их не должна превышать 1 г. В развитии эффекта барбитуратов, особенно тиопентал-натрия, большое значение имеет фактор связывания их с белками плазмы, так как только свободная (несвязанная) часть препарата оказывает активное действие, включаясь в распределение между жидкими средами организма, в том числе мозга. Состояние белкового обмена, в частности уровень белка в крови, может непосредственно влиять на глубину и длительность барбитуровой общей анестезии, увеличивающиеся в условиях гипопротеинемии. Связь барбитуратов с белками уменьшается и, следовательно, действие их усиливается в условиях ацидоза и ослабляется при алкалозе (гипервентиляция). Следующей фазой распределения барбитуратов в организме является накопление их в жировых депо, происходящее в течение нескольких часов с момента введения однократной дозы. Из жировых депо они постепенно поступают в кровь, а затем в печень для инактивации. Таким образом, процессы распределения и дезактивации барбитуратов в организме продолжаются много часов после окончания общей анестезии. Опасность кумуляции при введении повторных доз сохраняется более суток даже при полноценной функции печени. Расщепление барбитуратов в печеночных микросомах идет с торможением «печеночного дыхания». Этот процесс нарушается при снижении интенсивности углеводного обмена в печени. Улучшению его способствует преднаркозное введение растворов глюкозы. Продукты расщепления барбитуратов выводятся почками. Методика общей анестезии. Барбитураты применяются главным образом для вводной и кратковременной анестезии при инструментальных эндоскопических исследованиях. Для длительной общей анестезии их применение не показано и даже опасно из-за слабых анестетических свойств и описанных выше фармакокинетических особенностей. Для премедикации перед барбитуровой анестезией целесообразно использовать комбинацию транквилизатора (для устранения эмоционального стресса), ваголитика (для смягчения присущего барбитуратам, особенно тиопентал-натрию, холинергического действия) и анальгетика (для усиления недостаточного анальгетического эффекта барбитуратов). Доступной и действенной является премедикация диазепамом (0,14 мг/кг), промедолом (0,3 мг/кг) и атропином (0,01 мг/кг) за 40 мин до начала анестезии. Включение в премедикацию нейролептика дроперидола может способствовать усугублению депрессии кровообращения в период индукции барбитуратами. Все компоненты указанной выше премедикации обладают потенцирующими свойствами в отношении наркотических веществ и облегчают введение больного в состояние общей анестезии. Индукционная доза барбитуратов, как правило, не превышает 5 мг/кг, у больных старческого возраста — 3 мг/кг, что снижает вероятность депрессии кровообращения. Свежеприготовленный 1—2% раствор тиопентал-натрия или гексенала медленно вводят в вену (каждые 100 мг в течение 30—60 с) под контролем состояния больного. Клиническая и электроэнцефалографическая картина общей анестезии. Первые клинические проявления наступают спустя 1—2 мин от начала введения наркотика и характеризуются снятием психического напряжения, легким головокружением, ощущением опьянения, иногда эйфорией и речевым возбуждением, которые в сочетании с расширением зрачков и появлением на ЭЭГ высокоамплитудной быстрой активности (рис. 14.1) отражают начало стадии возбуждения ЦНС. При медленном введении наркотика на фоне премедикации в этой стадии никогда не возникает двигательных проявлений. Спустя еще минуту наступает помутнение, а затем потеря сознания, которой на ЭЭГ соответствует стадия высокоамплитудных смешанных волн (4—20 Гц), нередко с группами так называемых барбитуровых веретен (14 Гц). Выключение сознания не означает развития стабильной общей анестезии. В этот момент отмечаются чрезмерно живые роговичные и зрачковые рефлексы, децентрация глазных яблок и усиление двигательной реакции на болевые раздражители. Клиническая симптоматика гиперрефлексии в сочетании с повышением интенсивности биоэлектрических процессов головного мозга и увеличением амплитуды неспецифического компонента вызванных потенциалов на все виды раздражителей соответствуют кульминации стадии возбуждения, во время которой нельзя начинать какие-либо манипуляции, в частности интубацию трахеи, так как могут возникнуть патологические рефлексы: артериальная гипертензия, тахикардия, аритмии сердца, ларинго- и бронхоспазм. Дальнейшее введение анестетика приводит к стабилизации общей анестезии со снижением выраженности указанных выше рефлексов, сужением зрачков, центральным расположением глазных яблок на фоне замедления ритмов ЭЭГ до 2—3 Гц. Только после достижения этого этапа можно прекратить введение общего анестетика и перейти к выполнению интубации трахеи или других манипуляций. Bместе с тем даже при соблюдении данною условия выполнение интубации трахеи после предварительного введения миорелаксанта неизбежно сопровождается симпатомиметической реакцией кровообращения: повышением артериального давления и частоты сердечных сокращений, иногда нарушениями ритма сердца. Такая реакция сохраняется и при углублении барбитуровой анестезии до IV—V стадии изменений ЭЭГ, характеризующихся постепенным падением амплитуды биопотенциалов вплоть до изоэлектрической линии и сопряженных с нарастающей депрессией кровообращения и дыхания. Это указывает на слабый уровень анестезии и арефлексии при использовании барбитуратов в чистом виде, что подтверждают данные экспериментальных исследований: барбитураты не только не уменьшают специфические ответы (соматосенсорные вызванные потенциалы) в ответ на внешние раздражители, но способствуют их выявлению на фоне общего подавления спонтанной электрической активности мозга при глубокой анестезии. Многие авторы относят барбитураты к разряду не наркотиков, а «гипнотиков», вызывающих только состояние глубокого сна, в основе которого лежит депрессия коры и ретикулярной формации среднего мозга [Дарбинян Т.М., Головчинский В.В., 1972).
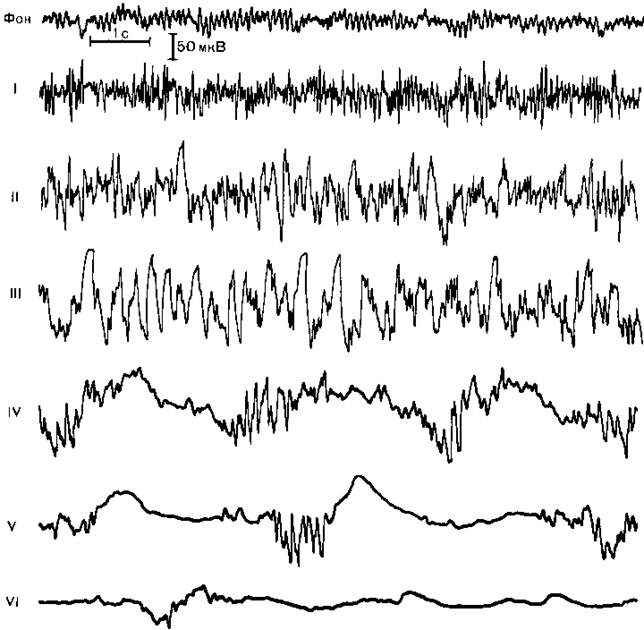
Рис. 14.1. Электроэнцефалографические стадии барбитурового наркоза. I стадия электрической гиперам явности, II стадия высокоамплитудных смешанных волн, III стадия преобладания высокоамплитудной (150—200 мкВ) А активности частотой 3 Гц, IV стадия чередования участков падения амплитуды ЭЭГ длительностью 1—2 с и вспышек волн, имеющих частоту Ь К) Гц и амплитуду 50 100 мкВ, V и VI стадии прогрессирующею падения амплитуды биопотенциалов до 50 и 20 мкВ и увеличения периодов «немых зон» более чем до 5 и 10 с.
В связи с этим применение барбитуратов в чистом виде, особенно у больных с сердечно-сосудистой патологией, нецелесообразно. Эффективность анестезии и арефлексии может быть достигнута при сочетании барбитуратов с фентанилом 2—5 мкг/кг. Необходимую для индукции дозу анестетика при этом уменьшают примерно вдвое [Parker E.О., Ross A.L., 1982]. Изучение нейрофизиологических и нейрохимических механизмов барбитуровой общей анестезии, несмотря на полувековой период существования барбитуратов, не закончено. Есть предположение, что в ЦНС существуют специфические рецепторы связывания барбитуратов (так же, как в отношении анальгетиков и других нейротропных средств), ответственные за реализацию их седативного, гипнотического и анестетического действия [Mark L.С. et al., 1982]. Влияние на организм. В действии барбитуратов на ЦНС важное клиническое значение имеют депрессия дыхательного и сосудодвигательного центров, а также повышение активности центров парасимпатической нервной системы. Барбитураты приводят к значительному снижению активности обменных процессов в клетках мозга и вследствие этого к уменьшению мозгового кровотока, что используется как лечебный фактор при постреанимационной патологии мозга. Действие барбитуратов на функцию дыхания определяется центральной депрессией дыхания, пропорциональной глубине общей анестезии и повышением тонуса бронхиальной мускулатуры, имеющим ваготоническую природу. Последнее редко выявляется клинически, но при недостаточной атропинизации и глубине анестезии у ваготоников и больных бронхиальной астмой может способствовать развитию бронхоспазма при введении интубационной трубки или эндоскопа в дыхательные пути. Действие на кровообращение заключается в значительно выраженной депрессии миокарда [Гологорский В.А. и др., 1979] и умеренной вазодилатации центрального происхождения, результатом которых являются снижение артериального давления, ударного объема сердца и компенсаторное увеличение частоты сердечных сокращений. По данным Т.М. Дарбиняна (1984), у больных ишемической болезнью сердца кардиодепрессорный эффект барбитуратов (даже в 1% растворе) резко выражен. Он сопровождается падением ударного индекса с последующей постинтубационной гипердинамической реакцией кровообращения, что свидетельствует о непригодности барбитуратов для этого контингента больных. Действие барбитуратов на непораженные печень и почки носит характер преходящего функционального ограничения. Однако, учитывая, что эти паренхиматозные органы осуществляют дезактивацию и экскрецию барбитуратов, применять последние при исходно нарушенной функции печени или почек нецелесообразно. Показания. Барбитураты используют для вводной и общей анестезии, при эндоскопических исследованиях, как компонент постреанимационной реабилитации функций ЦНС. Противопоказания: сердечно-сосудистая, печеночная, почечная недостаточность, тяжелая бронхиальная астма. Абсолютным противопоказанием является острая интермиттирующая порфирия, так как барбитураты повышают синтез порфиринов, что может повлечь за собой смертельный исход. Общая анестезия пропанидидом. Пропанидид (эпонтол фирмы «Baier», ФРГ; сомбревин фирмы «Гедеон Рихтер», ВНР) небарбитуровый анесстетик ультракороткого действия. Применяется в анестезиологии с 1964 г. Физико-химические свойства и фармакокинетикa. Пропанидид представляет собой пропиловый эфир фенолуксусной кислоты. Выпускается в ампулах по 10 мл и представляет собой вязкий маслянистый раствор желтовато-белого цвета, приготовленный с использованием специального растворителя кремофора, так как в воде субстанция препарата нерастворима. В ампуле содержится 500 мг препарата. Пропанидид занимает особое место среди наркотических агентов благодаря своему ультракороткому эффекту (3—6 мин). В печени и крови быстро происходит его ферментативное расщепление до наркотически неактивных метаболитов. Через 25 мин с момента введения препарат перестает определяться в крови. Как и барбитураты, пропанидид частично связывается белками плазмы, наркотическое же действие оказывает свободная часть препарата, поэтому необходимая наркотическая доза его снижается при гипопротеинемии. Продукты ферментативного расщепления пропанидида выделяются с мочой в течение 2 ч. Методика общей анестезии. Для премедикации за 30—40 мин до общей анестезии чаще всего используют промедол и атропин в общепринятых дозах в сочетании с антигистаминным средством (димедрол или дипразин в дозе 0,7—0,8 мг/кг) для профилактики реакций, связанных с высвобождением эндогенного гистамина (см. ниже). Для индукции или кратковременной анестезии при эндоскопических исследованиях или хирургических вмешательствах (вскрытие абсцессов, выскабливание полости матки и др.) пропанидид применяют в дозе 6—10 мг/кг, у пожилых и ослабленных больных — 3—4 мг/кг. Для более плавного развития общей анестезии и смягчения присущих препарату побочных эффектов время введения должно составлять не менее 30 с. При этом продолжительность общей анестезии равна 3—5 мин. Увеличения ее можно достичь повторным применением наркотика либо комбинацией его с другими общими анестетиками. Удобна методика введения в одном шприце хорошо совместимых растворов пропанидида и натрия оксибутирата. Вводят по 1 ампуле каждого препарата. При этом доза первого из них составляет 8—10 мг/кг, второго — 20—40 мг/кг. Это позволяет увеличить продолжительность общей анестезии до 6—8 мин и смягчить побочные вегетативные эффекты пропанидида. Широкое применение для целей вводной анестезии имеет метод Дарбиняна. Первоначально вводят фентанил в дозе 4—5 мкг/кг (0,1 мл/кг), а затем пропанидид (5 мг/кг) в сочетании с 10 мл 10% раствора кальция хлорида или кальция глюконата. Вводная анестезия по этой методике характеризуется отсутствием свойственных пропанидиду в чистом виде тахикардии, гипервентиляции, а также реакции сердечно-сосудистой системы в ответ на интубацию трахеи, но сопровождается резко выраженной депрессией дыхания, часто апноэ. При вводной анестезии это не опасно, так как совпадает с периодом введения мышечного релаксанта и последующим выполнением интубации трахеи. В случаях проведения общей анестезии при кратковременных амбулаторных вмешательствах с самостоятельным дыханием больных этот метод использовать нецелесообразно, так как почти всегда необходима ИВЛ. Существуют методы длительного поддержания общей анестезии на основе капельной инфузии пропанидида в сочетании с ингаляцией закиси азота [Dixneuf В. et al., 1973] и малыми дозами фентанила [Полюхов С М. и др., 1981]. При операциях длительностью несколько часов общий расход пропанидида может достигать 20 г. Применение этих методов связано со многими побочными явлениями (тахикардия, гипотензия, судороги, посленаркозное возбуждение, кожные аллергические реакции и др) и потому мало оправдано. Клиническая и электроэнцефалографическая картина общей анестезии. Общая анестезия пропанидидом отличается стремительностью развития При использовании доз 6—10 мг/кг и средней скорости введения спустя 15—30 с от начала введении наркотика внезапно наступает (он Выключение сознания сочетается с возникновением характерного комплекса вегетативных реакций: резкого увеличения частоты дыхания и сердечных сокращений, расширения зрачков до 3—4 мм в диаметре. Этот специфический для общей анестезии пропанидидом вегетативный криз сопровождается более быстрым, чем при использовании барбитуратов, нарастанием на ЭЭГ высокоамплитудной медленной активности (3—6 Гц) и является клиническим выражением фазы возбуждения определенных подкорковых структур, вероятнее всего гипоталамуса — центра вегетативной регуляции [Осипова Н.А и др., 1981]. В последующие несколько секунд происходит стабилизация анестезии: зрачки суживаются, частота сердечных сокращений приобретает тенденцию к нормализации, легочная гипервентиляция прекращается и сменяется гиповентиляцией или апноэ продолжительностью 10—30 с; артериальное давление умеренно понижается (у пациентов старческого возраста возможна значительная гипотензия). Этой клинической симптоматике соответствует картина ЭЭГ, аналогичная IV стадии барбитуровой анестезии (см. рис. 14.1), отражающая дальнейшее замедление биопотенциалов с периодическим снижением их амплитуды. В этой фазе общей анестезии целесообразно приступить к выполнению вмешательств и манипуляций. При использовании препарата в дозе выше 10 мг/кг анестезия может быть доведена до более глубоких уровней, которые в сравнении с барбитуровой анестезией характеризуются не только нарастанием депрессии кровообращения (гипотензия), дыхания и биоэлектрической активности мозга с появлением зон электрического «молчания», но и нередко симптомами мышечной гиперактивности (судорожные подергивания мышц конечностей, диафрагмы по типу икоты или кашля, горизонтальный нистагм). При этом в отличие от барбитуровой анестезии V—VI стадии на ЭЭГ на фоне участков изоэлектрического «молчания» периодически возникают короткие пароксизмы остроконечной активности, пиковые разряды и судорожные комплексы пик—волна, свидетельствующие о распространении на кору судорожного возбуждения из подкорковых структур. Судорожные симптомы при общей анестезии пропанидидом описаны многими авторами, R. Von Sutterlin (1982) подтвердил эпилептоидные свойства этого препарата специальными электроэнцефалографическими исследованиями. По его данным, у больных эпилепсией пропанидид особенно часто провоцировал судорожное возбуждение ЦНС, приводя к появлению судорожной активности на ЭЭГ в виде спайков, острых волн и комплексов пик—волна в сочетании с клинически выраженными судорогами. Оценивая анестетические свойства пропанидида, следует исходить из двухфазности нейрофизиологического механизма его действия. Тотчас после выключения сознания усиливаются реакции на внешние раздражители. При клинико-экспериментальных исследованиях в это время установлено снижение порогов вызванных ответов в проекционной зоне коры и ядрах таламуса, ответственных за передачу болевой импульсации [Дарбинян Т.М., Головчинский В.Б., 1972]. Только при наступлении стабильной фазы общей анестезии развивается торможение передачи болевой импульсации по таламокортикальным путям. Пропанидид принято считать более эффективным общим анестетиком, чем барбитураты. Однако в чистом виде пропанидид не способен защитить организм от мощных болевых и рефлекторных воздействий. Результаты специальных гемодинамических исследований показывают, что только при сочетании его с фентанилом (5 мкг/кг) можно предотвратить артериальную гипертензию и тахикардию, возникающие в ответ на интубацию трахеи [Дарбинян Т.М., Хашман Т.А., 1982] Необходимо подчеркнуть, что главными чертами общей анестезии пропанидидом являются ее кратковременность и быстрое постнаркозное восстановление всех функций ЦНС. Данные специальных исследований [Бажанов Н.Н., Ганина С.С., 1979; Татарский М.Л., Плотников В.В., 1979; Камышов Я.М., 1981, 1985, и др.] свидетельствуют о быстром, в течение нескольких минут, восстановлении психомоторных функций и биоэлектрической активности мозга, что делает пропанидид незаменимым для обезболивания в амбулаторной практике. По мнению большинства исследователей, срок пребывания больного в лечебном учреждении после общей анестезии может быть ограничен 1 ч, а затем без всякого риска его можно отпустить домой. Действие на организм. Описанные выше быстро преходящие, но значительные изменения дыхания и кровообращения, возникающие под влиянием пропанидида, обусловлены начальным подкорковым активирующим действием препарата и сменяются последующей умеренной депрессией этих функций. Практическое значение кратковременной гипервентиляции и последующей гиповентиляции невелико, так как они не отражаются на состоянии газообмена. Действие пропанидида на кровообращение складывается из кратковременной центральной стимуляции частоты сердечных сокращений с одновременным снижением среднего артериального давления и сердечного индекса за счет кардиодепрессивного действия препарата. Многочисленными исследованиями показано, что гиподинамическая реакция кровообращения при вводной анестезии пропанидидом, как и при других видах внутривенной моноанестезии, сменяется резкой гипердинамической реакцией (артериальная гипертензия, тахикардия, повышение сердечного индекса) в ответ на выполнение интубации трахеи [Дарбинян Т.М., Хашман Т.А., 1982; Бунятян А.А. и др., 1983]. Как отмечено выше, смягчения нежелательных центральных эффектов пропанидида можно достичь путем сочетания его с препаратами противоположного центрального действия (фентанил, натрия оксибутират). При вводной анестезии особенно целесообразна комбинация пропанидида с фентанилом, позволяющая избежать центральных вегетативных реакций, кардиодепрессии, а также постинтубационной реакции кровообращения даже у больных гипертонической болезнью. Пропанидид вызывает быстро наступающее и значительное (на 45%) снижение мозгового кровотока с последующим восстановлением его к 10-й минуте после введения наркотика. Это создает ограничения к его применению у больных пожилого возраста с явлениями церебрального склероза. По данным экспериментальных и клинико-биохимических исследований, действие пропанидида на печень незначительно и при использовании обычных наркотических доз биохимически не проявляется. В больших дозах препарат может вызывать преходящие функциональные сдвиги (увеличение концентрации билирубина в крови, угнетение окислительного и углеводного обмена печени). Существенного влияния на функцию почек пропанидид не оказывает. В инструкциях по использованию пропанидида указаны его гемолитические свойства и противопоказания к применению при гемолитической анемии. Способность пропанидида высвобождать эндогенный гистамин может быть причиной тяжелых осложнений по типу гистаминового шока с развитием трудно купируемых артериальной гипотензии, тахикардии, бронхоспазма. Описаны случаи смертельного исхода. В связи с этим целесообразно включать в премедикацию антигистаминные средства. Показания к применению пропанидида обусловлены спецификой его наркотического эффекта. Его используют при кратковременных, в том числе амбулаторных, вмешательствах, инструментальных диагностических исследованиях, а также при вводной анестезии. Особые преимущества этого препарата в амбулатрной практике общеизвестны. Пропанидид не имеет себе равных по быстроте посленаркозного восстановления всех функции организма. Противопоказания: указания в анамнезе на аллергические явления, бронхиальная астма, эпилепсия, гемолитическая анемия, недостаточность кровообращения. Большой осторожности требует применение пропанидида у пациентов старческого возраста. Стероидная общая анестезия. Первым препаратом стероидного ряда, нашедшим применение в анестезиологии, был гидроксидион (виадрил, пресурен, предион), близкий по химической структуре к гормонам коры надпочечников, но лишенный гормональной активности. После синтеза в 1955 г. виадрил широко применялся в США, а затем в Европе и в нашей стране на протяжении около 20 лет. Являясь препаратом метаболического ряда, он отличается минимальной токсичностью и большой терапевтической широтой действия благодаря сходству с естественными метаболитами человеческого организма. Это обусловливает особые преимущества применения его у больных с нарушением функции паренхиматозных органов, при анестезии в родах и при длительной терапии некоторых патологических состояний (столбняк, алкогольный психоз). Однако важным недостатком является местное раздражающее воздействие препарата на ткани, нередко приводящее к развитию флебитов. Это послужило причиной постепенного ограничения клинического использования виадрила. В настоящее время этот вид общей анестезии представляет в основном исторический интерес, несмотря на то что в нашей стране виадрил воссоздан в 1961 г. в лабораториях ВНИХФИ под названием «предион». Медицинской промышленностью он не производится. Альтезин (альфатезин, СТ-1341) — новый представитель наркотических агентов стероидного ряда, синтезированный в Великобритании в начале 70-х годов. Физико-химические свойства и фармакокинетика. Альтезин представляет собой смесь двух прегнандионовых дериватов: стероида I — альфаксолона и стероида II — альфадолона, растворенных в кремофоре — 20% растворе полиоксиэтилированного касторового масла в воде. Стандартный раствор содержит 9 мг стероида I и 3 мг стероида II; рН его близок к нейтральному. Учитывая неоднородный состав препарата, его принято дозировать не в миллиграммах, а в миллилитрах на 1 кг массы тела. Препарат не обладает гормональной активностью. В отличие от виадрила раздражающего влияния на эндотелий сосудов, даже артериальных, не оказывает. По данным фирмы «Glaxo» (Великобритания), альтезин оказывает широкое терапевтическое действие. Его терапевтический индекс в 4,5 раза выше, чем тиопентал-натрия. Он удаляется из кровотока и инактивируется печенью, не перераспределяясь в тканях, чем объясняются кратковременность его действия и отсутствие кумуляции. Методика анестезии. Анестезию целесообразно начинать на фоне эффективной премедикации с использованием транквилизатора (нейролептика), анальгетика и ваголитика. Вводная доза составляет 0,07—0,15 мл/кг, время введения 1—2 мин. Для анестезии во время операций и диагностических манипуляций можно вводить альтезин капельно. Клиническая и электроэнцефалографическая картина общей анестезии. Выключение сознания наступает через 15—30 с от начала введения анестетика при картине высокоамплитудного гиперсинхронного 6-ритма 2,5—3 Гц, аналогичного III стадии изменений ЭЭГ при барбитуровой анестезии (см. рис. 14.1). Предшествующие две стадии — электрической гиперактивности и смешанных волн чрезвычайно кратковременны и клинически не проявляются. Спустя 20—30 с после выключения сознания наступает стабилизация анестезии: фиксация глазных яблок в центральном положении, резкое ослабление роговичного рефлекса, релаксация языкоглоточной мускулатуры, снижение артериальною давления на 10—20 мм рт. Ст.г (при стабильной частоте сердечных сокращений) и депрессия дыхания (поверхностное учащенное дыхание, нередко апноэ, реже периодическое дыхание типа Чейна—Стокса). На ЭЭГ при этом регистрируются медленные 6-волны частотой 1—3 Гц, чередующиеся с участками смешанных ритмов малой амплитуды: IV стадия альтезиновой общей анестезии, аналогичная барбитуровой. При дозе альтезина свыше 0,1 мл/кг общая анестезия достигает более глубоких уровней, характеризующихся резкой депрессией дыхания, часто апноэ, некоторым увеличением частоты сердечных сокращений, нарастанием артериальной гипотензии и релаксации языкоглоточной мускулатуры, углублением депрессии биоэлектрической активности мозга до V—VI стадии. При такой глубине анестезии возможна интубация трахеи без применения мышечных релаксантов. Примерно у трети больных наступление альтезиновой анестезии сопровождается судорожными подергиваниями отдельных групп скелетных мышц, редко – значительным двигательным возбуждением. Продолжительность действия альнмина при использовании средних доз (0,07—0,1 мл/кг) не превышает 10 мин. Предварительное применение диазепама 0,12- 0,14 мг/кг удлиняет амнемезию до 15 -18 мин. Таким образом, по кратковременности действия альтезин больше всего приближается к пропанидиду. По данным N North и соавт. (1973), психомоторные функции после общей анестезии альтензином у 82% больных восстанавливаются в среднем через 33 мин, у остальных позже. Все же в быстоте восстановления функциональной активности ЦНС альтезин уступает пропанидиду [Cailiard В., 1980). Альтезин, как и барбитураты, является слабым анестетиком, мало подавляющим болевые и рефлекторные реакции в ответ на интубацию трахеи и хирургические манипуляции, поэтому большинство исследователей указывают на необходимость сочетания его при вводной анестезии с наркотическими анальгетиками или местной анестезией дыхательных путей, а при оперативных вмешательствах – с наркотическими анальгетиками и и ингаляционными анестетиками: закисью азота, галотаном, энтраном и др. [Lanza V. et al., 1979; Caiilarcl В., 1980. и др.]. Действие на организм. Для общей анестезии альтезином наиболее типичны нарушения дыхания центрального типа гиповенгилнция, апноэ, расстройства ритма, хотя частота и степень их значительно уменьшаются при медленном (более 1 мин) введении препарата. Во время индукции нарушения дыхания существенного значения не имеют, так как сразу после выключения сознания следуют введение миорелахсанта, интубация трахеи и ИВЛ. При альтезиновой же анестезии с самостоятельным дыханием больных во время диагностических исследований и манипуляций необходимо быть готовым к обеспечению вспомогательной или искусственной вентиляции легких. Гемодинамические эффекты альтезина весьма умеренны и проявляются небольшой периферической вазодилатацией, снижением артериального давления и увеличением частоты сердечных сокращений на 10—20% [Бунятян А.А. и др, 1976] в отсутствие изменений ЭКГ и сердечного выброса. Наряду с этим значительно снижается мозговой кровоток. Гипотензивный эффект в сочетании с уменьшением мозгового кровотока является ограничением к применению препарата у больных пожилого возраста с атеросклерозом сосудов головного мозга и при гипертонической болезни. В терапевтических дозах альтезин не оказывает токсическою воздействия на печень и почки. Анафилактические реакции у человека при применении альтезина не описаны, хотя, как и при использовании многих других внутривенных анестетиков, возможна легкая аллергическая реакция в виде эритемы кожи верхней половины туловища в течение нескольких минут после инъекции. Показания к применению альтезина ограничиваются в основном вводной анестезией и мало травматичными кратковременными вмешательствами (ангиография, выскабливание полости матки и др.). При моноанестезии альтезином важным условием является введение его в дозе не менее 0,1 мл/кг, а при меньших дозах — комбинация его с закисью азота или наркотическим анальгетиком. Допустимо использовать альтезин и как базисный анестетик путем длительной инфузии в сочетании с наркотическими анальгетиками, закисью азота при операциях продолжительностью несколько часов. Противопоказания к использованию альтезина относительны Требует осторожности применение его у больных пожилого возраста, при гипертонической болезни и церебральном атеросклерозе. При необходимости сохранения самостоятельного дыхания больного общая анестезия альтезином не оправдана ввиду часто возникающей депрессии дыхания. Нецелесообразно применение препарата при печеночной недостаточности, так как инактивация его полностью осуществляется в печени и является дополнительной нагрузкой на пораженный орган. Анестезия натрия оксибутиратом. Первые сообщения Н.Laborit и соавт. о фармакологических свойствах гамма-гидроксибутирата натрия относятся к началу 60-х годов. Они сразу привлекли внимание клиницистов, поскольку речь шла о препарате со снотворными свойствами, потенцирующем эффект наркотических агентов и практически не оказывающем токсического действия ввиду химического сходства с естественным метаболитом мозговой ткани —гамма-аминомасляной кислотой, которая является тормозным медиатором ЦНС. Впервые натрия оксибутират был применен в невропатологии и психиатрии. Хорошие результаты, полученные при длительной терапии некоторых психических заболеваний, неврозов и судорожных состояний, подтвердили безвредность этого препарата для организма человека даже в больших дозах. С середины 60-х годов началось применение натрия оксибутирата в анестезиологии. Физико-химические свойства и фармакокинетика. Натрия оксибутират представляет собой натриевую соль гамма-оксимасляной кислоты, относящуюся к классу оксикарбоновых кислот жирного ряда. Выпускается отечественной промышленностью в ампулах по 10 мл 20% раствора, хорошо переносимого при любом способе введения в организм (внутривенно, внутримышечно, ректально, внутрь). Являясь фактически энергетическим субстратом, натрия оксибутират включается в метаболизм и после соответствующих преобразований выводится преимущественно легкими в виде углекислого газа [Лабори Г., 1974]. Только 5% его в первые 8 ч после введения выделяется с мочой. При внутривенном введении натрия оксибутирата в дозе 100 мг/кг максимальная концентрация его в крови достигается к 15-й минуте. При приеме внутрь этот срок удлиняется до 1,5 ч. Через 24 ч препарат перестает определяться в крови [Лебеденко В.Я., 1972]. Методика анестезии. Важным условием успешного проведения анестезии натрия оксибутиратом является полноценная преднаркозная подготовка включением психотропного, анальгетического и ваголитического компонентов для смягчения присущих ему побочных эффектов. Более чем двадцатилетний клинический опыт показал нецелесообразность применения натрия оксибутирата для моноанестезии. Для вводной и поддержания анестезии натрия оксибутират вводят в дозе 70-100 мг/кг внутривенно медленно, лучше капельно. Во избежание нежелательных побочных эффектов (судороги, рвота) всю дозу можно развести в 50 мл изотонического раствора глюкозы или натрия хлорида и ввести в течение 5 мин. Сократить время индукции до 1—2 мин и избежать побочных эффектов можно, применяя натрия оксибутират в дозе 40—100 мг/кг в сочетании с барбитуратами короткого действия (тиопентал-натрий в дозе 2—6 мг/кг) или пропанидидом (см выше). У физически крепких людей трудно достичь стабильной нейровегетативной защиты во время интубации трахеи и оперативного вмешательства даже при комбинации натрия оксибутирата (в любых дозах) с другими внутривенными, ингаляционными анестетиками и наркотическими анальгетиками, что связано со своеобразными механизмами центрального действия препарата (см. ниже), поэтому в широкой анестезиологической практике этот вид анестезии практически не применяется. Напротив, у пожилых и ослабленных больных, особенно с нарушением функции паренхиматозных органов и интоксикациями, поддержание анестезии натрия оксибутиратом в дозе 50—70 мг/(кг*ч) в сочетании с закисью азота и малыми дозами фентанила — 1—2 мкг/(кг-ч) — имеет преимущество перед всеми другими видами общей анестезии, поскольку отсутствуют токсичность и депрессия кровообращения. Методики введения натрия оксибутирата внутримышечно, ректально и внутрь описаны в соответствующих разделах. Клиническая и электроэнцефалографическая картина общей анестезии. Наркотическое состояние развивается после длительного латентного периода (10—15 мин), тогда как изменения ЭЭГ возникают через 3—5 мин от начала введения натрия оксибутирата и проявляются доминированием генерализованного гиперсинхронного а-ритма — ритма спокойного бодрствования (рис. 14.2), сочетающегося с развитием седативного эффекта и психомоторного покоя. Это свойство натрия оксибутирата можно использовать для преднаркозной подготовки, особенно в детской анестезиологии, вводя препарат в палате внутрь или ректально и достигая дремотного состояния и полного устранения страха перед операцией. Сон наступает тогда, когда на ЭКГ начинает преобладать высокоамплитудная медленная активность (1—3 Гц), нередко сочетающаяся с элементами, характерными для малого судорожного припадка, пик—волна, быстрая волна—медленная волна (аналогично III стадии общей анестезии пропанидидом) В этом периоде при моноанестезии натрия оксибутиратом клинически отчетливо выражены судорожные явления, нарушения ритма дыхания, возможно непроизвольное мочеиспускание или дефекация. Стадия возбуждения особенно резко выражена при быстром введении препарата и может быть сведена к минимуму при медленном его введении По мере нарастания концентрации препарата в крови наступает стабилизация анестезии. При этом на ЭЭГ преобладают гигантские медленные волны частотой 0,5—2 Гц (по типу IV стадии при барбитуровой и пропанидидовой общей анестезии), что клинически проявляется ритмичным глубоким дыханием, стабильным артериальным давлением и тенденцией к брадикардии. Продолжительность анестезии на таком уровне составляет от 1 до 1,5 ч. Более глубокие уровни развиваются при дозах натрия оксибутирата свыше 150 мг/кг, которые в настоящее время практически не применяются, поскольку даже при таких дозах общая анестезия, достаточная для выполнения оперативною вмешательства, не достигается, а наркотическое состояние становится неуправляемым и продолжается несколько часов. Характерно, что при резкой депрессии биоэлектрической активности мозга с зонами изоэлектрического «молчания» до 10—15 с не происходит существенного угнетения кровообращения и дыхания. Таким образом, типичными чертами использования натрия оксибутирата являются начальная фаза психомоторного успокоения, последующая отчетливо выраженная клинически и элекфоэнцефалографически стадия возбуждения ЦНС, отсутствие полноценной общей анестезии и сохранение функции жизненно важных центров ЦНС даже при глубоком наркотическом состоянии Учет этих особенностей действий натрия оксибутирата необходим для правильного выбора показаний и методики применения препарата.
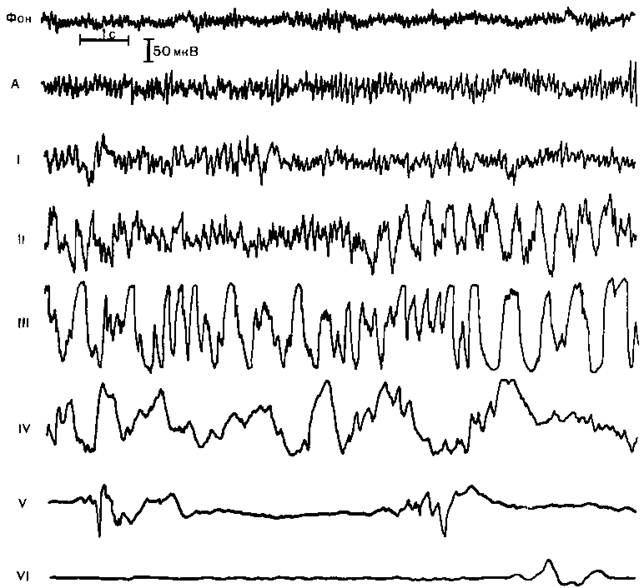
Рис. 14.2. Электроэнцефалографические стадии наркоза натрия оксибутиратом. Рис. 14.2. Электроэнцефалографические стадии наркоза натрия оксибутиратом. А — фаза генерализации гиперсинхронного а-ритма; I — стадия увеличения амплитуды и замедления фоновой активности до 6—10 Гц; II — стадия пароксизмов высокоамплитудных гиперсинхронных волн частотой 2,5—4 Гц с элементами судорожной активности «быстрая волна — медленная волна», III — стадия генерализованной гиперсинхронной (150—200 мкВ) активности частотой 1,5—4 Гц, IV—стадия высокоамплитудных медленных волн частотой 0,5—3 Гц с периодическим снижением амплитуды ЭЭГ до уровня изоэлектрической линии; V — стадия «немых зон» длительностью до 5 с с короткими вспышками медленных волн, имеющих амплитуду 30—100 мкВ, VI — стадия «немых зон» длительностью 10 с и более, дальнейшее уменьшение амплитуды биопотенциалов до 10—30 мкВ и укорочение периодов активности до 1—2 с Действие на организм. Присущие натрия оксибутирату свойства имеют центральное происхождение. Механизмы центрального действия этого препарата наиболее полно освещены в работах М.И. Кузина и соавт. (1978), В.И. Сачкова и соавт., Н.А. Осиповой (1988), W.Winters и соавт., Согласно этим клинико-экспериментальным исследованиям, основной эффект натрия оксибутирата развивается вторично, после стадии судорожного возбуждения ЦНС, особенно ярко выраженного при быстром введении препарата в чистом виде без предварительной медикаментозной подготовки. С этой фазой связаны преходящие расстройства ритма дыхания и замедление ритма сердца При введении натрия оксибутирата происходят стимуляция диуреза и снижение уровни калия в плазме крови, что в сочетании с характерными изменениями деятельности сердца и дыхания укладывается в картину активизации определенных отделов гипоталамуса, являющегося центром вегетативной регуляции. Специфическими анальгетическими свойствами натрия оксибутират не обладает. Более того, некоторые исследователи [Беляков В.А. и др., 1978] указывают на усиление под действием натрия оксибутирата нисходящих активизирующих влияний на сердечно-сосудистую систему, чем объясняется развитие интраоперационной некупирующейся артериальной гипертензии. Это требует комбинации натрия оксибутирата с другими общими анестетиками, но и при этом условии у обычного контингента больных трудно добиться стабилизации гемодинамических показателей. Благодаря своей метаболической природе натрия оксибутират лишен токсических свойств и поэтому безопасен даже при недостаточности функций жизненно важных органов и систем, в том числе при печеночной и почечной недостаточности. Более того, он способен улучшать течение указанных патологических процессов, так как обладает свойствами антигипоксанта, способствуя повышению устойчивости сердца, мозга и печени к гипоксии и другим вредным воздействиям за счет предупреждения нарушения функции ферментных систем и повышения использования глюкозы [Михайлович В.А., 1977; Долгих В. Т., Меерсон Ф. 3., 1982]. Показания. Натрия оксибутират, мало пригодный для рутинной анестезиологической практики, по специальным показаниям применяется в анестезиологии и реаниматологии. К числу таких специальных показаний в анестезиологии принадлежат всевозможные критические состояния, обусловленные недостаточностью функции жизненно важных органов, тяжелыми интоксикациями, гипоксией (геморрагический шок, печеночная и почечная недостаточность, разлитой перитонит), требующие оперативного вмешательства. В отличие от других общих анестетиков натрия оксибутират в этих случаях не только не является дополнительным повреждающим фактором, но оказывает лечебное действие и увеличивает выживаемость организма за счет повышения устойчивости к гипоксии и ацидозу, стабилизации кровообращения и уменьшения выраженности гиперкалиемии. У крайне тяжело больных, находящихся в коматозном состоянии, достаточно применения натрия оксибутирата (60—70 мг/кг) как единственного компонента анестезиологического пособия. В реаниматологии натрия оксибутират применяется в малых дозах (по 30— 50 мг/кг несколько раз в сутки) как средство повышения выживаемости, восстановления функций ЦНС в постреанимационном периоде и как противосудорожное средство, в том числе при нефропатии беременных ввиду полной безвредности для плода. Общая анестезия кетамином. Клиническое применение кетамина началось с середины 60-х годов и сразу вызвало поток противоречивых публикаций. В дальнейшем наступил период трезвой оценки и тщательного экспериментального и клинического изучения этого ценного по основным свойствам, но «трудного» для клинического использования анестетика, дающего массу центральных побочных эффектов. В результате двадцатилетних исследований уточнены механизмы нейрофизиологического действия кетамина, разработаны оптимальные методы его клинического применения. В современной анестезиологии кетамин занимает одно из ведущих мест. Физико-химические свойства и фармакокинетика. Кетамин (С1-581, кеталар, кетанест, кетажект, калипсол) представляет собой производное фенциклидина, близкое по химической структуре к галлюциногенам из ряда лизергиновой кислоты. Выпускается во флаконах по 10 мл 5% раствора, стабилизированного хлорбуталом. Водные растворы кетамина стабильны при комнатной температуре; их рН составляет 3,5 —5,5. Препарат хорошо переносим при внутривенном и внутримышечном введении. В нашей стране используется преимущественно калипсол фирмы «Гедеон Рихтер» (ВНР). Кетамин обладает большой терапевтической широтой действия и ничтожной токсичностью, подтвержденными при длительном применении больших доз в эксперименте и клинике у больных с ожогами. После введения кетамин в силу хорошей жирорастворимости быстро попадает в мозг, а оттуда уже через 10 мин основная его часть перераспределяется в органы с хорошим кровоснабжением. Сбелками крови он связывается мало. Через 2 ч препарат разрушается в печени с образованием нескольких метаболитов, два из которых обладают каталептогенными свойствами, и в течение 2,5—4 ч выделяется с мочой и кишечным содержимым. Бензодиазепины удлиняют действие кетамина за счет торможения расщепления, галогеносодержащие анестетики — за счет замедления перераспределения из мозга [Larsen R., 1985]. Методика анестезии. Основной методический принцип анестезии кетамином — обязательная комбинация с другими фармакологическими компонентами, устраняющими его побочные эффекты. Лучшим базисным агентом для кетаминовой анестезии являются транквилизаторы бензодиазепинового ряда (диазепам), тормозящее действие которых направлено на возбуждаемые кетамином лимбические структуры мозга, ответственные за чрезмерные сердечно-сосудистые и психомоторные побочные эффекты кетамина. Средствами профилактики побочных реакций кетамина наряду с бензодиазепинами могут служить любые общие анестетики и препараты для нейролептаналгезии, но эти агенты значительно изменяют эффект кетамина, не позволяя в ряде случаев использовать его особые преимущества. Для премедикации обязательно использовать транквилизатор типа диазенама (0,2 мг/кг), лучше в комбинации с дроперидолом (0,08 мг/кг). В большинстве случаев целесообразно применять атропин в общепринятой дозе, однако при исходно повышенной возбудимости миокарда, склонности к тахикардии и аритмиям, особенно у пожилых больных, снижение дозы атропина до 1/2—1/3 или полное его исключение из премедикации уменьшает либо полностью предотвращает кетаминовую тахикардию. Использование анальгетика в премедикации не обязательно, а при анестезии с самостоятельным дыханием нецелесообразно из-за возможной депрессии дыхания во время анестезии. Моноанестезия кетамином в настоящее время практически не применяется, так как даже у грудных и новорожденных детей она сопровождается симпатомиметическими сердечно-сосудистыми реакциями [Михельсон В.А. и др., 1981]. Анестезию начинают с внутривенного введения диазепама (0,2—0,3 мг/кг) в течение 1 мин. В большинстве случаев через 1—2 мин это приводит к развитию транквилизации средней или глубокой степени, после чего переходят к введению кетамина. При слабой индивидуальной реакции больного на диазепам целесообразно использовать дополнительный компонент — дроперидол (0,10—0,12 мг/кг) и через 3—5 мин после этого приступать к введению кетамина. Клинический опыт свидетельствует о значительной вариабельности индивидуальной реакции на кетамин, поэтому одномоментное введение традиционной дозы (2 мг/кг), особенно старым пациентам, не оправдано. Первоначальная доза 0,5 мг/кг, вводимая со скоростью 1—2 мг/с, дает возможность оценить выраженность основного эффекта и уловить начальные признаки побочных симптомов, после чего продолжить введение анестетика, при необходимости приняв дополнительные меры (увеличение дозы диазепама, дроперидола). Поданным специальных нейрофизиологических исследований, так называемая субанестетическая доза кетамина (0,5 мг/кг) может быть пригодна для достижения хирургической анестезии [Kochs E. et al., 1988]. У ряда больных, особенно пожилого возраста, для выполнения внеполостной операций достаточны дозы кетамина 0,8—1,0 мг/кг при гладком течении анестезии, адекватном самостоятельном дыхании и сумеречном сознании. В большинстве случаев оптимальная начальная доза составляет 1—1,5 мг/кг; поддерживающие дозы (1/2—1/3 первоначальной) вводят через 15—30 мин. При длительных операциях после начальной болюсной дозы производят непрерывную капельную инфузию 0,1% раствора кетамина в дозе 1,5—2 мг/(кг- ч), сочетая ее с ингаляцией смеси закиси азота и кислорода (2:1) [Гологорский В.А. и др., 1985; Pedersen Т., 1981, и др.]. Инфузию препарата прекращают за 30-40 мин до окончания операции. При особо травматичных операциях диазепам-кетаминовую анестезию дополняют фентанилом и дроперидолом. Таким образом, анестезия становится многокомпонентной [Бунятян А.А. и др., 1981]. При соблюдении описанных методических приемов кетаминовая анестезия может быть успешно применена у любого контингента больных. Клиническая и электроэнцефалографическая картина анестезии. В чистом виде кетамин вызывает бессознательное или ступорозное состояние, нередко при открытых глазах, резкое подавление болевой чувствительности, каталептический мышечный гипертонус, артериальную гипертензию, тахикардию, гиперсаливацию, галлюцинации и делирий, т.е. имеет сходство не с традиционными общими анестетиками, а с галлюциногенами типа ЛСД. Эти явления сопровождаются своеобразной картиной генерализованного гиперсинхронного в-ритма частотой 4—7 Гц на ЭЭГ (рис. 14.3, а, II). Такая форма электрической активности типична для возбуждения лимбических структур мозга (гиппокамп), а появление ее на ЭЭГ означает генерализацию этого возбуждения и распространение его на кору головного мозга. Описанная клиническая и электроэнцефалографическая симптоматика соответствует судорожному уровню возбуждения — так называемому лимбическому припадку. Естественно, что такой вариант общей анестезии не может быть приемлем для клиники, поэтому на практике кетамин не применяют без предварительной медикаментозной блокады лимбического комплекса бензодиазепинами. С учетом этого нами рассмотрена клиническая картина кетаминовой анестезии. Как было показано выше, благоприятным фоном для введения кетамина является состояние диазепамовой транквилизации. Последняя сопровождается картиной ЭЭГ с преобладанием быстрых ритмов (14—22 Гц). Введенный в дозе 2 мг/кг в течение 1 мин кетамин обеспечивает спокойное развитие общей анестезии с выключением сознания, отсутствием реакции на внешние раздражители, без судорожных, психотических и вегетативных проявлений. Вместо типичного для моноанестезии кетамином в-ритма на ЭЭГ регистрируется быстрая активность в диапазоне 25—30 Гц (рис. 14.3, б, III). Дыхание и гемодинамические показатели остаются стабильными: гипертезия и тахикардия не развиваются, не возникает и гипотензия, вызываемая большинством других общих анестетиков. Примечательно, что у больных, не подготовленных атропином, кетамин не только не проявляет симпатомиметических свойств в отношении сердечной деятельности, но может способствовать развитию брадикардии, хорошо поддающейся коррекции атропином. Действие кетамина как общего анестетика лучше всего можно оценить во время операций при самостоятельном дыхании больных, когда дефекты нейро-вегетативной защиты не маскируются искусственным выключением активной реакции больных с помощью тотальной мышечной релаксации. Принято считать, что кетамин более эффективно подавляет соматическую, чем висцеральную, чувствительность. Однако накоплен большой опыт успешного применения диазепам-кетаминовой анестезии и при внутриполостных операциях, причем по степени защиты от операционного стресса этот вид анестезии превосходит традиционные [Шедлих М., 1979; Гологорский В.А. и др., 1985]
Рис 14.3 ЭЭГ и ЭКГ при анестезии кетамином в сочетании с диазепамом.
а – внутривенное введение сначала кетамина а затем диазепама; I фон: а-ритм частотой 9,5 Гц, частота сердечных сокращении 98 в минуту, II – при введении кетамина в дозе 2мг/кг преобладание В-ритма частотой 5,6-6 Гц, увеличение частоты сердечных сокращении до 135 в минуту; III – при введении диазепама в дозе 0,25 мг/кг переход к быстрой электроэнцефалографической активности (20—25 Гц) и нормализация частоты сердечных сокращении; б – внутривенное введение сначала диазепама, а затем кетамина; I — фон и ритм частотой 105 Гц частота сердечных сокращении 75 в минуту; II — при введении диазепама в дозе 0,25 мг/кг преобладание электроэнцефалографической активности частотой 14-18 Гц, частота сердечных сокращении без изменении; III при введении кетамина в дозе 2 мг/кг увеличение частоты биопотенциалов коры головного мозга до 20-25 Гц, частота сердечных сокращении 85 в минуту.
Аналгезия развивается спустя 1—2 мин после внутривенного введения кетамина и продолжается 10-20 мин, тогда как сознание может возвращаться раньше, поэтому нередко во время операции возможен словесный контакт с больными хотя впоследствии они об этом не помнят благодаря развивающейся ретроградной амнезии. Кетамин можно рассматривать как истинный анальгетик, что является его большим преимуществом. При ослаблении аналгезии возникают реакция в виде учащения дыхания, повышения артериального давления и частоты сердечных сокращений, двигательная и словесная реакция. В течение нескольких часов после операции в условиях кетаминовой анестезии аналгезия сохраняется на достаточном уровне и нет необходимости в дополнительном обезболивании. Выход из кетаминовой анестезии обычно бывает спокойным. При нарушении оптимальной методики выход из кетаминовой анестезии может осложниться психомоторным возбуждением, галлюцинациями, бредом. Действие на организм. Для объяснения механизма действия кетамина на ЦНС предложены две концепции концепция «диссоциативной анестезии», предложенная G. Corssen и соавт. (1968) (активация лимбических структур, обусловливающая побочные симптомы кетаминовой анестезии, при торможении таламо-ретикулокортикальной системы, обеспечивающем анестезию), и концепция М.И. Кузина и соавт (1973), W Winters (1972) и др., отрицающая диссоциацию в действии кетамина и рассматривающая его как средство, приводящее к возбуждению всех структур мозга, включая кору, с вторично развивающимся снижением реактивности на болевую импульсацию. Однако бесспорным для обеих концепций является экспериментально обоснованный факт чрезмерного возбуждения лимбических структур, требующего устранения бензодиазепинами, после чего течение кетаминовой анестезии становится стабильным, с минимальным риском побочных эффектов. Анальгетическое действие кетамина как деривата фенциклидина реализуется, вероятно, через опиатные сигма-рецепторы [Звартау Э.Э., 1986]. Действие кетамина на кровообращение носит характер симпатотонического сердечно-сосудистого криза и проявляется резким увеличением артериального давления, ЦВД, частоты сердечных сокращений, работы левого желудочка, коронарного и периферического кровотока, легочного сосудистого сопротивления, потребления миокардом кислорода при одновременном снижении ударного индекса и общего периферического сопротивления [Гологорский В.А. и др., 1979, и др.]. Мозговой кровоток и внутричерепное давление под действием кетамина возрастают, но потребление кислорода мозгом не меняется [Larsen R., 1985]. Наиболее вероятной причиной стимуляции кровообращения кетамином является активация центральных адренергических механизмов [Larsen R., 1985]. Все гемодинамические эффекты кетамина предотвращаются или их выраженность значительно уменьшается с помощью диазепама, общих анестетиков, высокой эпидуральной анестезии или фентоламина. Способность кетамина стимулировать кровообращение удачно используется у больных в состоянии шока. Действие кетамина на дыхание в сравнении с большинством общих анестетиков минимально. На фоне диазепам-кетаминовой анестезии в установленных дозах и в отсутствие превышения скорости введения препаратов дыхание обычно остается адекватным, мышечный тонус и защитные рефлексы верхних дыхательных путей сохранены, поэтому вероятность аспирации при анестезии с самостоятельным дыханием минимальна. Секреция слюны и трахеобронхиальных желез без комбинации кетамина с тормозящими ее средствами (атропин, дроперидол, диазепам) повышена. На функцию печени и почек кетамин не влияет, аллергических реакций не вызывает. Он не только не повышает концентрацию гистамина в крови, но приводит к ее снижению, особенно у сенсибилизированных больных, и дает эффект при экспериментальном гистаминовом шоке [Колосов М.М., 1981]. Кетамин оказывает незначительное действие на иммунную систему организма и может применяться у больных с первичной и вторичной недостаточностью иммунной системы [Гадалов В.П., 1985]. Показания. Кетамин особенно показан и не имеет себе равных при анестезии с сохраненным самостоятельным дыханием при внеполостных и малых внутриполостных (аппендэктомия) операциях, малых гинекологических вмешательствах, хирургической обработке ожоговых поверхностей, для индукции общей анестезии у больных в критическом состоянии, у неконтактных детей (внутримышечно), является средством выбора у больных с отягощенным аллергологическим анамнезом. Эффективен как средство устранения острого болевого синдрома (0,2—0,5 мг/кг внутривенно). Является действенным компонентом любой комбинированной анестезии. Противопоказания: эпилепсия, психические заболевания, феохромоцитома, повышение внутричерепного давления, тяжелая сердечная недостаточность, гипертоническая болезнь. При правильной методике кетаминовой анестезии указанные сердечно-сосудистые заболевания не являются абсолютным противопоказанием. Общая анестезия этомидатом. Этомидат (гипномидат), синтезированный в 1965 г, пополнил арсенал средств для кратковременной анестезии. В анестезиологии применяется с начала 70-х годдов. Физико-химические свойства и фармакокинетика. Этомидат представляет собой карбоксилированный дериват имидазола. Гипномидат выпускается в ампулах по 10 мл раствора, стабилизированного пропиленмиколем и содержащего 2 мг препарата в 1 мл. Максимальная концентрация в крови достигается уже через 1 мин после введения, причем более половины вещества связывается с белками плазмы. В это же время максимум препарата поступает в мозг и другие ткани с хорошим кровоснабжением. Период полураспада этомидата составляет 75 мин [Larsen R., 1985]. Он быстро расщепляется в печени до неактивных метаболитов и в течение 24 ч выводится почками и частично кишечником. В специальном клиническом фармакокинетическом исследовании установлена возможность кумулирующего эффекта этомидата при длительной инфузии (начальная доза 0,2 мг/кг, поддерживающая 2 мг/мин). После 60) мин инфузии действие продолжается в течение 30 мин [Schwilden M. et al., 1981], что требует последовательного снижения почасовых доз препарата при уштельной инфузионной анестезии. Методика анестезии. В связи с чрезвычайной кратковременностью действия и отсутствием аналгезии и арефлексии этомидат целесообразно применять после полноценной премедикации, включающей психотропный, анальгетический и холинолитический компоненты, а в периоде индукции сочетать с препаратами для нейролептаналгезии. С целью моноанестезии препарат практически не используют, исключая анестезиологическое пособие при кардиоверсии, когда требуется не полноценная общая анестезия, а лишь выключение сознания. Доза для индукции составляет в среднем 0,2 мг/кг и вводится в течение 60 с. При введении этомидата примерно в 50% случаев возникают боли по ходу вены. Методика индукции этомидатом в сочетании с препаратами для нейролептаналгезии заключается в предварительном введении дроперидола и фентанила, а затем этомидата (0,2 мг/кг) и миорелаксанта, что обеспечивает общую анестезию достаточной эффективности и длительности для выполнения интубации трахеи без существенной реакции кровообращения. Во избежание сочетанного гипотензивного эффекта этомидата и дроперидола последний лучше вводить после индукции, непосредственно перед началом операции. Введение фентанила перед этомидат Дата добавления: 2015-02-05 | Просмотры: 1472 | Нарушение авторских прав |