|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
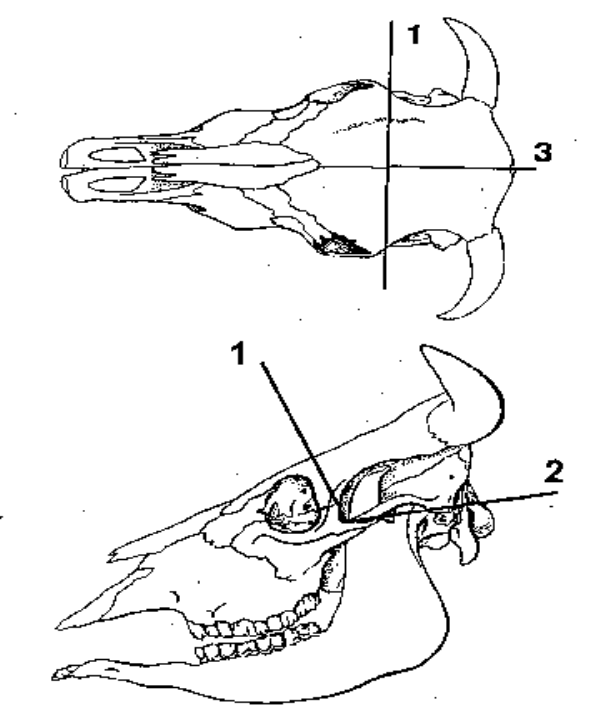
Диагностика губкообразной энцефалопатии крупного рогатого скота.Установление диагноза на губкообразную энцефалопатию крупного рогатого скота включает: - изучение клинических признаков; - изучение эпизоотологической ситуации; - проведение патогистологических исследований; - проведение электронно-микроскопического исследования; - проведение иммунохимических исследований (иммуноблотинг); - проведение биопробы на лабораторных животных. Для диагностических исследований в специализированную лабораторию по изучению губкообразной энцефалопатии крупного рогатого скота посылают: -мозг крупного рогатого скота после исследования на бешенство и другие вирусные инфекции после неподтверждения диагноза; -мозг крупного рогатого скота из мясокомбинатов (0,01% от забитых животных старше 3-х лет). Порядок отбора проб мозга для диагностических исследований. Диагностика губкообразной энцефалопатии крупного рогатого скота проводится только после гибели или вынужденного убоя животных. В этой связи важным условием является правильный отбор проб, их фиксация, транспортировка и хранение. Патологический материал (головной мозг) берут от животных с клиническими признаками поражения центральной нервной системы). При этом мозг для гистологических, электронно-микроскопических и иммунохимических исследований необходимо брать у животных сразу после их убоя или гибели до наступления лизиса тканей или размножения другой сопутствующей микрофлоры. Животных с клиническими признаками губкообразной энцефалопатии умерщвляют различными способами: введением избыточной дозы барбитурата – 2-3 г барбамила (в растворе), внутримышечным введением 1-2 г гемоспоридина (в растворе), 20-30 мл 25% раствора сернокислой магнезии транстаракально в области сердца. Голову отделяют от шеи по атланто-затылочному сочленению. Труп животного сбрасывают в забетонированную яму Беккари глубиной не менее 3-х метров и засыпают хлорной известью. Наиболее эффективным способом утилизации трупов является их сжигание. Отделенную от трупа голову упаковывают в металлическую пленку, помещают в металлический контейнер, желательно со льдом, транспортируют при температуре +2 +15оС в ветеринарную лабораторию или специализированную лабораторию по изучению губкообразной энцефалопатии крупного рогатого скота. Работу выполняют с соблюдением Санитарных правил 1.2.011 от 04.05.1994 г. РФ “Безопасность работы с микроорганизмами 1 и 2 групп патогенности”. При проведении работ по отделению, упаковке и транспортировке головы, а также при закапывании или сжигании трупа животного необходимо исключить травмирование рук и попадание брызг крови на кожу. Чтобы избежать этого, надевают халат, прорезиненный фартук, анатомические перчатки из плотной резины, резиновые сапоги, водонепроницаемый капюшон и защитную маску из оргстекла, закрывающую лицо от брызг крови. По окончании работ инструменты, которыми проводили отделение головы, укладываются стерилизатор с 2% раствором гипохлорита натрия не менее чем на 1 час (инструменты должны быть погружены в раствор полностью). Сапоги, фартук, капюшон, маску и перчатки также обрабатывают с 2% раствором гипохлорита натрия. Халаты обрабатывают автоклавированием при 134-138оС в течение 20-30 минут. Горючие отходы сжигают. Голова должна быть доставлена в исследовательскую лабораторию в течение 12-36 часов, поскольку в результате размножения микроорганизмов в тканях мозга или автолиза мозг становится непригодным для гистологического исследования. Замороженный при транспортировке или при хранении в холодильнике мозг также непригоден для проведения анализа, т.к. в результате замораживания возникают артефакты, мешающие диагностике. При длительной транспортировке или в жаркую погоду целесообразно в контейнер положить лед. Сразу после доставки в исследовательскую лабораторию с дорсальной части головы крупного рогатого скота удаляют кожу. Имеется два способа извлечения головного мозга из черепной коробки (Рис.1). При первом способе голову зажимают в тиски, а при втором – проводят ручную фиксацию на столе на листе бумаги, который ложится для предотвращения скольжения. После фиксации осторожно, чтобы не повредить мозг, распиливают лобную кость с помощью анатомической пилы. Затем производят надрезы лобной кости с каждой стороны от точек, находящихся на оси глазных ям, продлевая их каудально до наружных слуховых проходов. Продлевают эти разрезы каудально до большого затылочного отверстия также осторожно, чтобы исключить повреждение мозга. Делают сагитальный разрез посредине лобной и затылочной костей до большого затылочного отверстия. Затем разделяют и удаляют распиленные левую и правую части черепной коробки. Рассекают и снимают твердую мозговую оболочку. Затем необходимо перевернуть голову, чтобы под действием силы тяжести мозг отделился от основания черепа. Продолжить работу, продвигаясь от каудального надреза вперед; для перерезания нервов вентральной стороны черепа использовать скальпель. После извлечения мозга его целиком необходимо поместить в фиксирующий раствор или путем фиксации несплошных разрезов мозга на пластины (Рис.2,3).
Рисунок 1. Схема распилов черепа крупного рогатого скота
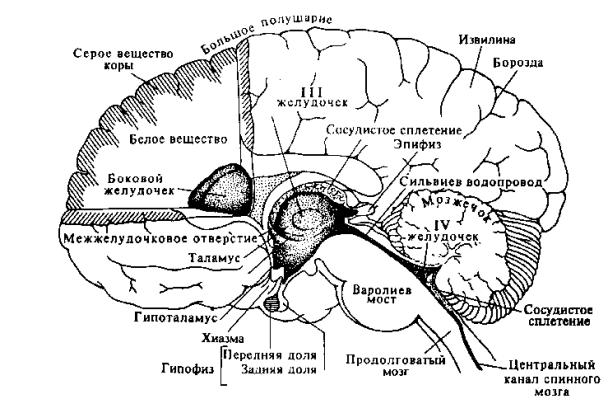
Рисунок 2. Схема участков головного мозга животных
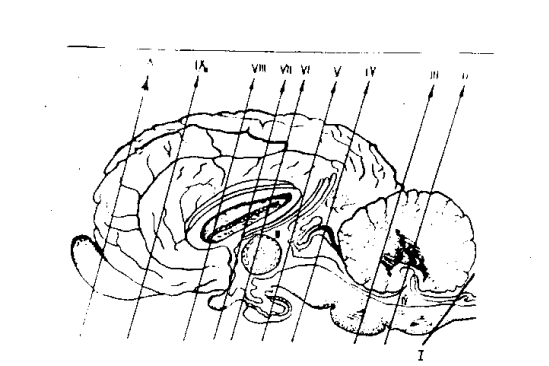
Рисунок 3. Схема разрезов головного мозга Примечание: Ромбовидный мозг: I – срез продолговатого мозга на уровне верхнего отдела; II – срез стволовой части на границе продолговатого мозга и варолиевого моста; III – срез варолиевого моста на кровне начала верхних ножек мозжечка. Средний мозг: IV – срез четверохолмия на уровне появления красных ядер. Промежуточный мозг: V – срез в области эпиталамуса на уровне раскрытия сильвиева водопровода в III желудочек мозга; VI – срез в области таламуса на уровне эпителиальных бугров и залегающих в них ядер; VII – срез в области гипоталамуса на уровневые воронки. Концевой мозг: VIII – срез бокового желудочка на уровне головки хвостатого ядра; IX, Х– срезы полушарий большого мозга в области моторных полей туловища, грудных и тазовых конечностей.
Для фиксации мозга целиком готовят фиксирующий раствор по следующей прописи:
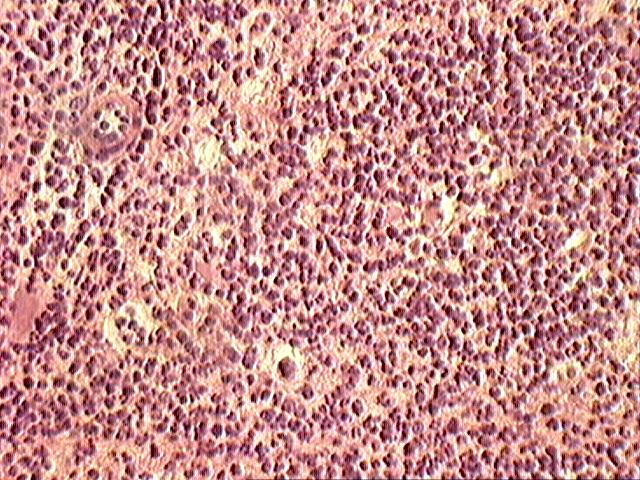
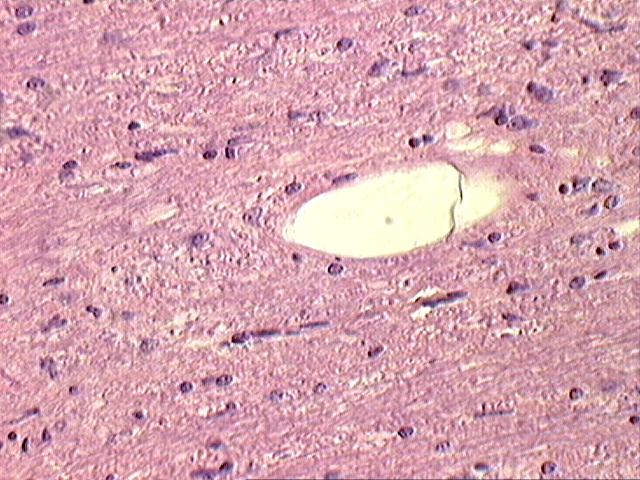
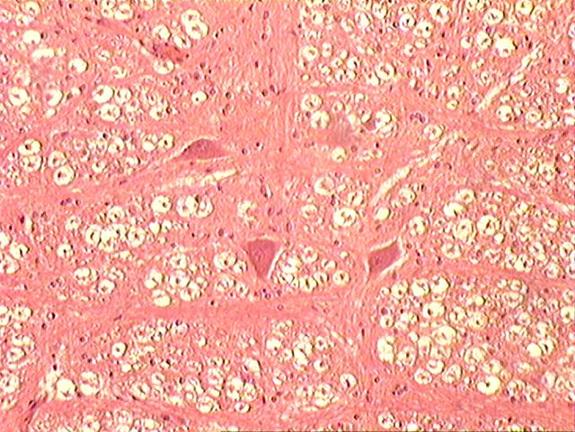
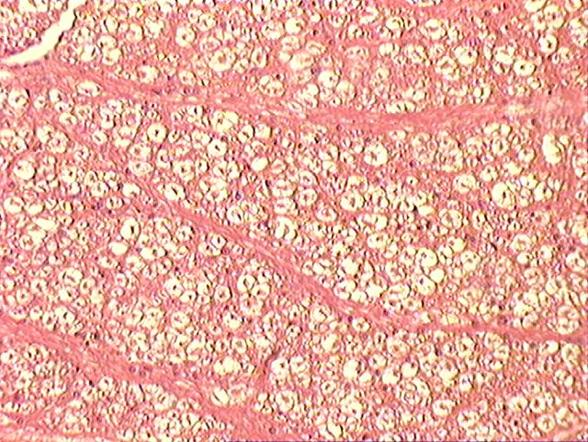
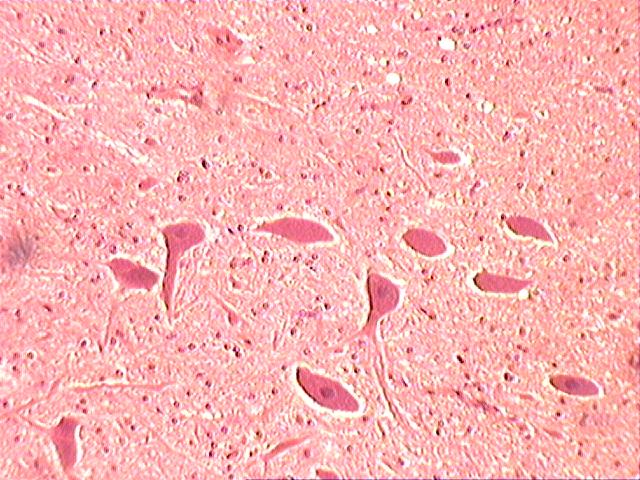
Растворить соли в воде, добавить формалин и размешать, При этом рН раствора должен быть нейтральным, около 7,0. Фиксация мозга путем использования несплошных поперечных разрезов. Учитывая особенность проявления губкообразной энцефалопатии (отечность и расплавление нейроглии), фиксация мозга должна быть экстренная и жесткая, позволяющая исключить артрефакты и обеспечить максимально достоверную диагностику. Для достижения этого на извлеченном головном мозге необходимо сделать несплошные поперечные разрезы в виде пластин толщиной 5-8 мм. Более толстые пластины делать нельзя, т.к. формалин проникает и фиксирует ткани только на толщину не более 8 мм. Между пластинами ткани проложить гигроскопический материал (вату, марлю, фильтровальную бумагу) Для фиксации головного мозга, разрезанного на прордольные полосы рекомендуется использовать 15-20% раствор нейтрального формалина (150-200 мл формалина и 800 – 850 мл воды, параформа – соответсвенно в 2,5 раза меньше. Срок фиксации – 3-4 суток. Зафиксированный мозг помещают в ударопрочную емкость, при этом объем фиксирующего раствора должен быть в 10 раз больше объема мозга. В таком виде материал должен храниться не менее 2 недель, после чего его необходимо доставить в диагностическую лабораторию. Патогномоничными для губкоообразной энцефалопатии крупного рогатого скота являются следующие критерии (рис.4-7): - диффузная вакуолизация и расплавление нейроглии (в виде множественных разной формы и величины сот) (рис.4, 5): - каогуляция цитоплазмы в нейронах, проявляющаяся в виде плотного сгустка с повышенной оксифильностью (красного цвета); - наличие пикноза, рексиса и частичного лизиса ядер нейронов, иногда криброза цитоплазмы (множественные мелкие вакуоли)(рис.6); - гипертрофия эндотелия кровеносных сосудов я вялениями кариопикноза и репсиса); - наличие периваскулярных круглоклеточных астроцитных и макрофагальных элементов типа негнойного энцефалита (напоминающие “висна” у овец); - явления вакуолизации нейронов (перстневидные клетки) встречаются редко и слабо выражены, тогда как у “скрепи” овец это более выражено; - наличие вокруг нейронов явлений отека и вакуолизации.
Рисунок 4.
Рисунок 5
Рисунок 6. Подтвержденным на для губкоообразную энцефалопатию крупного рогатого скота диагноз следует считать только на основании комплексного анализа эпизоотологических, клинико-анатомических и патогистологических исследований. При этом следует сравнивать гистопрепараты отделов головного мозга, полученных от заведомо здоровых животных (контроль). Сомнительным считается диагноз при наличии ассиметричных признаков вакуолизации в нейроглии или в нейронном околоядерном пространстве. Отрицательный диагноз ставится в случае отсутствия гистологических изменений в основных участках головного мозга, необходимых для диагностики, а при подозрении и остальных участков мозга. Примечание: В настоящее время в странах мира применяются следующие методы иммунологической диагностики губкообразной энцефалопатии: иммуноблотинг (тест-система «Прионикс-Чек»), -иммуноферментный анализ (тест-система «Биорад»); -иммунолюминисцентный методы (тест-система «Прионикс-Лиа»); - метод иммунострипов (тест-сситема «Прионикс-стрип»); -электронно-микроскопический метод; -иммуногистохимический метод выявления патологических PrP sc- белков в обычных фиксированных в формалине срезах; -биопроба (заражение подозрительнам материалом хомяков и мышей). Дифференциальный диагноз. Губкообразную энцефалопатию крупного рогатого скота необходимо дифференцировать от бешенства, листериоза, болезни Ауески, нервной формы инфекционного ринотрахеита, злокачественной катаральной горячки, а также отравлений фосфорорганическими, хлорорганическими, ртутьорганическими соединениями, фосфидом цинка, мышьяком, поваренной солью. Основным отличительным признаком от губкообразной энцефалопатии крупного рогатого скота является короткий латентный период (от 5 до 15 дней) острое или подострое течение, повышение температуры тела, отказ от корма и другие симптомы, присущие указанным заболеваниям, биопроба, данные вирусологических, бактериологических и токсикологических исследований. Бешенство – острая контагиозная болезнь различных видов животных и человека, характризующаяся параличами, агрессией, водоборязнью. Возбудитель - рабдовирус. Бешенство крупного рогатого скота чаще протекает в буйной форме и характеризуется возбуждением, извращением аппетита, расширением зрачков, обильным слюноотделением. Агрессивность по отношению к человеку и животным наблюдается редко. К концу болезни развиваются параличи –спазм гортани и глотки, затем передних и задних конечностей. Смерть наступает на 3-6 день. При тихой форме бешенства симптомы возбуждения выражены в незначительной степени, но очень рано развиваются параличи. Необходимо отметить, что прижизненная дифференциальная диагностика губкообразной энцефалопатии крупного рогатого скота и бешенства, несмотря на всю ее значимость, имеет лишь ориентировочное значение. Основное практическое значение имеет посмертная диагностика, основанная на данных морфологического, серологического исследования и биопробы. Гистологические изменения головного и спинного мозга при бешенстве характеризуются рассеянным энцефаломиелитом, проявляющимся воспалительными изменениями сосудов и поражением нервных клеток. Указанные изменения для бешенстве неспецифичны и при диагностике играют второстепенную роль. Специфическим является обнаружение в цитоплазме нейронов головного мозга особых образований, названных тельцами Бабеша-Негри, наиболее часто они обнаруживаются в клетках аммонова рога, реже – в других отделах. Тельца Бабеша–Негри представляют собой полиморфные образования со сложной внутренней структурой: в середине одно или несколько плотных гранул, по периферии – более мелкие зернышки. Размеры телец колебаются от 0,25-1 до 20-25 мк. В одной клетке может быть одно или несколько телец различной величины и формы (рис.7)
Рисунок 7. Тельца Бабеша-Негри у больного животного в головном мозге. Для обнаружения телец Бабеша-Негри в гистосрезах, мазках и отпечатках мозга предложено множество способов окраски последних: по Михину, Муромцеву, Манну, Ленцу, Адуцкевичу и др. Из серологических методов исследования наиболее специфичным при бешенстве является метод флюоресцирующих антител, позволяющий выявлять при наличии вируса в мозге специфическое свечение (разной величины и формы гранулы яркого желто-зеленого цвета в величиной от едва заметных образований до 15-20 мк. При отрицательных результатах, полученных морфологическими и серологическими методами, для окончательной постановке диагноза проводится биологическая проба, основанная на заражении исследуемым материалом лабораторных животных, главным образом белых мышей. С этой целью суспензией мозга 1:10 с добавлением антибиотиков заражают в мозг в дозе 0,03 мл 5-6 белых мышей весом 4-6 г. Наблюдение за животными проводят в течение 14 дней. В случае падежа животных их мозг исследуют на наличие телец Бабеша-Негри. Если в течение 14 дней у зараженных животных не будут выявлены тельца Бабеша-Негри, то результат считается отрицательным. Болезнь Ауески (псевдобешенство) – контиагиозная болезнь домашних и диких животных, в том числе и крупного рогатого скота, сопровождается поражением центральной нервной системы и органов дыхания. Возбудителем является герпесвирус. Вирус обладает пантропностью, Инкубационный период от 1 до 15 дней. У крупного рогатого скота вначале повышается температура тела до 41,9оС, прекращается жвачка, появляется сильный зуд в области ноздрей, губ, щек или глаз, реже – на других участках тела. Животные вялые, отказываются от корма, беспокоятся, непрерывно лижут зудящие места, трутся об окружающие предметы. Возбуждение нарастает, глаза выражают испуг, животное мычит, стонет, рвется с привязи (агрессивности не проявляет). Нередко наблюдаются судорожные сокращения жевательных и шейных мышц. При вскрытии у животных расчесы в области головы, спины, конечностей. На месте расчетов кожа гиперемирована, края раны отечные, подкожная клетчатка геморрагически инфильтрирована. При гистологическом исследовании в мозге отмечается картина негнойного менингоэнцефалита. Он характеризуется образованием диффузной и очаговой пролиферации клеток глии, периваскулярной инфильтрацией, клетками ретикулоэндотериального типа, вакуолизацией и пикнозом ганглиозных нервных клеток, нейрофагией, многорядовой пролиферацией клеток мозговых оболочек и боковых желудочков (Рис.8.)
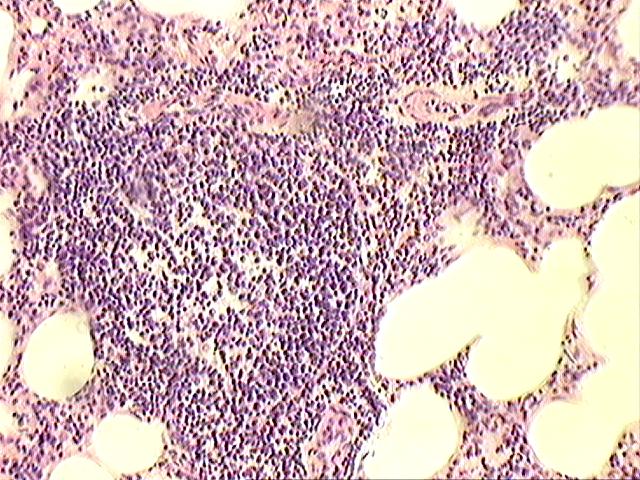
Рисунок 8. Негнойный энцефалит у больных болезнью Ауески животных. Лабораторная диагностика болезни Ауески заключается в обнаружении и идентификации возбудителя болезни в патологическом материале (РИФ или ИФА), выделении вируса на культуре клеток с последующей его типизацией, в также обнаружении противовирусных антител в сыворотке крови от больных и переболевших животных в РНГА, ИФА, РН. Листериоз – инфекционная болезнь, протекающая с признаками сепсиса, поражения центральной нервной системы, половых органов и молочной железы. Возбудителем инфекции является Listeria monocytogenes. Инкубационный период длится 1-4 недели. Течение болезни бывает острое, подострое и хроническое. Листериоз может проявляться несколькими формами: нервной, септической, смешанной, бессимптомной или выражаться в виде поражения половых органов и молочной железы. У крупного рогатого скота и овец отмечается преимущественное центральной нервной системы. Их первых признаков характерно угнетение, снижение аппетита, в дальнейшем - (1-7 дней) проявляются некоординированность движений, круговые движения, потеря равновесия, судороги, парезы отдельных групп мышц, потеря зрения, конъюнктивит, стоматит, оглумоподобное состояние, иногда приступы буйства. В начальной стадии болезни температура тела может быть несколько повышена или не превышать физиологической нормы, длительность болезни 7-10 дней и большинстве случаев животные погибают. При вскрытии у крупного рогатого скота отмечают острую венозную гиперемию и отек легких, гистогнойный энецефалит (стволовая часть головного мозга и шейная часть спинного мозга) (рис. 9).
Рисунок 9. Гнойный энцефалит у больного животного Диагноз на листериоз устанавливают на основе эпизоотологических, клинических, патологоанатомических и лабораторных методов исследований. Основание для постановки диагноза является выделение возбудителя на питательных средах, его идентификация, биопроба на белых мышах и кроликах. Для серологической диаоностики используют сыаороки крови от больных и переболевших животных. Наличие антител выявляют в РА, РСК, ИФА. Для ускорения диагностики используют люминисцентную микроскопию с использованием гипериммунной антилистериозной сыфоротки, меченой флюорохромами. Злокачественная катаральная горячка крупного рогатого скота – острая инфекционная болезнь крупного рогатого скота, характеризующаяся поражением слизистой оболочки головы, глаз и нервной системы. Возбудитель – герпесвирус. Начальная стадия заболевания характеризуется высокой температурой в течение 1-2 дней, воспалением слизистых оболочек ротовой и носовой полостей. Из носа появляются истечения слизистого, затем гнойно-кровянистого секрета. Повышенная температура тела (40-42оС) держится на постоянном уровне на протяжение болезни. Смерть может наступить через 24 часа, иногда длится до 2-х недель и более. Летальность – 90%. Патологоанатомические измерения зависят от тяжести и продолжительности заболевания и характеризуются катарально-гнойным конъюнктивитом и кератитом, некрозом эпидермиса носового зеркальца и слизистой оболочки ротовой полости, гнойно-фибринозным ринитом, ларингитом, крупозно-геморрагическим или дифтеретическим колитом. При гистологическом исследовании головного мозга – негнойный менингоэнцефалит. Методы диагностики основаны на выделении и идентификации вируса на культуре клеток и обнаружения специфических антител в РИД, РНГА или ИФА. Инфекционный ринотрахеит – острое инфекционное заболевание крупного рогатого скота, характеризующееся поражением органов дыхания и пищеварения у молодняка и половых органов у взрослых животных, также менингоэнцефалитом у телят. Возбудитель – герпесвирус. Заболеваемость животных инфекционным ринотрахеитом зависит от локализации вируса, его вирулентности, возраста, пола и физиологического состояния животного. Отмечены респираторная, энтеральная, генитальная, конъюнктивальная и нервная формы течения инфекционного ринотрахеита. Наиболее часто встречается у новорожденных телят энтеральная форма, у телят старше 1 месяца - респираторная, конъюнктивальная, реже – нервная формы, у взрослых – генитальная форма. Нервная или менингоэнцефалитная форма инфекционного ринотрахеита возникает у животных после проникновения вируса через гематоэнцефалический барьер. Ее наблюдают редко и, как правило, у молодняка 2-6 месяцев.. Она характеризуется расстройством двигательных функций и нарушением равновесия. Болезнь сопровождается мышечным тремором, мычанием, скрежетом зубов, конвульсиями, слюнотечением. На вскрытии у животных с менингоэнцефалитной формой инфекционного ринотрахеита в головном мозге гиперемия сосудов, отечность тканей и мелкие кровоизлияния. При гистологическом исследовании – хорошо выраженный лимфоцитарный менингоэнцефалит. Ему сопутствуют периваскулярная лимфоцитарная инфильтрация в различных отделах полушарий и мозжечка, сильная инъекция сосудов и отечность вещества мозга. У животных, которые погибают, в веществе мозга преобладают кровоизлияния, а при затяжном течении болезни – дегенеративные изменения нервных клеток и клеточно-пролиферативные процессы глиальных элементов. Диагноз на инфекционный ринотрахеит ставят путем выделения и идентификации вирусов на культуре клеток, обнаружении противовирусных антител в сыворотках крови больных и переболевших животных в РН, РНГА, ИФА. Отравления мочевиной характеризуется сильным угнетением. Потливостью, атаксией, слюнотечением, клоническими и тетаническими судоргами. Отравлению подвержены в основном взрослые животные. Температура тела в норме. Заболевают едничные животные до 30-40%-го поражения стада. На вскрытии – геморрагический гастроэнтерит, вздутие рубца (при разрезе ощущается резкий запах аммиака), зернистая (жировая) дистрофия печения и некрозы в ней. Основанием для постановки диагноза являются лабораторные исследования содержимого рубца на наличие в нем мочевины. Отравление ртутьорганическими соединения характеризуется резким угнетением, сильной саливацией, поносом, полиурией, угнетением сердечной деятельности, атаксией, парезами, параличами. Температура тела в норме. Заболевают едничные животные до массовых случаев поражения стада. На вскрытии серозно-катаральный гастроэнтерит, некротический некроз, зернистая (жировая) дистрофия миокарда и печени, крупозно-дифтеретический колит, кровоизлияния в серозных оболочках пищеварительного тракта. Основанием для постановки диагноза являются лабораторные исследования содержимого рубца на наличие в нем соединений ртути. Отравление хлорорганическими соединениями - характеризуется резким угнетением или возбуждением, сильной саливацией, поносом, полиурией, судоргами, сердечной недостаточностью, парезами, параличами. Температура тела в норме. Заболевают едничные животные до массовых случаев поражения стада. На вскрытии – катарально-геморрагический гастроэнтерит, кровоизлияния в слизистой оболочке бронхов, плевре, под эпи- и эндокардом, зернистая дистрофия и венозная гиперемия в миокарде, печени, почках, венозная гиперемия и отек легких. Основанием для постановки диагноза являются химико-токсикологические лабораторные исследования содержимого рубца на наличие в нем хлорорганических соединений. Отравление фосфорорганическими соединениями - характеризуется расстройством нервной системы, повышенной возбудимостью, затем угасанием рефлексов, атаксией, сильной саливацией, поносом, судоргами, сердечной недостаточностью. Температура тела в норме. Заболевают едничные животные до массовых случаев поражения стада. При вскрытии – обильная саливация в ротовой полости, цианоз слизистых оболочек глаз и ротовой полости, венозная гиперемия печени и легких (отек легких), гиперемия и отек головного мозга, сужение зрачков, кровоизлияния под эпи – и эндокардом, в слизистой оболочке очевого пузыря, щитовидной и поджелудочной железах, головном мозге. Основанием для постановки диагноза являются химико-токсикологические лабораторные исследования содержимого рубца на наличие в нем хлорорганических соединений. Наряду с поражением крупного рогатого скота губкообразной энцефалопатией, аналогичные изменения отмечаются и у овец при скрепи, аденоматозе, висна. При аденоматозе овец наряду с головным мозгом поражаются и легкие. При этом отмечают метаплазию альвеолярного эпителия в виде онкоподобных аденом на фоне расплавления межальвеолярных перегородок и образования эмфизематозных полостей. При заболевании овец висна отмечают периваскулярный инфильтрат крупноклеточных элементов в стволовой части продолговатого мозга. При скрепи овец имеются различные стадии поражения головного мозга. Отмечают кариопикноз, каогуляцию и пониженную оксифилию цитоплазмы нейронов, цитокариолизис нейронов, хроматолизис ядра и вакуолизация цитоплазмы нейронов, лизис цитоплазмы и оттеснение остатков ядра к периферии нейрона. Иногда отмечают наиболее характерный патогномоничный признак – перстневидный нейрон (рис.10).
Рисунок 10. Перстневидный некроз в мозге овец. При меди овец отмечается пролиферация круглоклеточных элементов в интерстициальной ткани легких, перибронхим, расплавление межальвеолярных перегородок и образование эмфиземоподобных полостей (рис.11).
Рисунок 11. Поражение легких у больных овец. При проведении гистологических исследований в нормальных участках головного мозга преобладают волокна нейроглии, заметны нейроны. При микроскопии гистосрезов из мозжечка здоровых животных при микроскопии видны грушевидные клетки Пуркинье, зернистый слой с мелкими нейронами, модекулярный слой (немиелизированные волокна) нейроны. Установление окончательного диагноза на губкообразную энцефалопатию крупного рогатого скота. Подтвержденным на для губкоообразную энцефалопатию крупного рогатого скота диагноз следует считать только на основании комплексного анализа эпизоотологических, клинико-анатомических и патогистологических исследований. При этом следует сравнивать гистопрепараты отделов головного мозга, полученных от заведомо здоровых животных и от животных с различными поражениями центральной нервной системы. Подтверждением диагноза на губкообразную энцефалопатию крупного рогатого скота является заключение Региональной референтной лаборатории Международного Эпизоотического Бюро, расположенной во Всероссийском НИИ защиты животных (г.Владимир, Российская Федерация) путем исследования иммуногистохимическим методом наличия патологических PrP- белков в обычных фиксированных в формалине срезах участков головного мозга крупного рогатого скота с наиболее характерными патогномоничными признаками, характерными для этого заболевания, выявленными после патогистологических исследований Меры безопасности при работе с патологическим материалом при проведении диагностических исследований. При работе с патологическим материалом, содержащим возбудитель губкообразной энцефалопатии крупного рогатого скота необходимо учитывать высокую устойчивость возбудителя к физико-химическим факторам и в этой связи строго соблюдать правила техники безопасности. Все работы, связанные с распиловкой головы, извлечением головного мозга, отбору проб для патогистологических, бактериологических и вирусологических исследований следует проводить в соответствии с требованиями Санитарных правил 1.2.011 от 04.05.1994 “Безопасность работы с микроорганизмами I и II групп патогенности” которые являются до настоящего времени действующими на территории государств СНГ. Специалист, который проводит исследования, должен иметь халат, прорезиненный (лучше хлорвиниловый) фартук с нарукавниками, анатомические перчатки, резиновые сапоги, водонепроницаемый капюшон, защитную маску из оргстекла для исключения попадания на лицо или глаза брызг крови, осколков костной ткани и интрацеребральной жидкости. По окончании работ необходимо обработать настойкой йода или бриллиантовой зелени ногти и различные царапины или травмы рук. Также по окончании работ инструменты, которыми проводили отделение головы, укладываются стерилизатор с 2% раствором гипохлорита натрия не менее чем на 1 час (инструменты должны быть погружены в раствор полностью). Сапоги, фартук, капюшон, маску и перчатки также обрабатывают с 2% раствором гипохлорита натрия. Халаты обрабатывают автоклавированием при 134-138оС в течение 20-30 минут. Горючие отходы сжигают. Труп животного, а также и голову (после отбора мозга) рекомендуется утилизировать в яме Беккари, или обильно засыпав хлорной известью сжигать. Неиспользованные участки головного мозга целесообразно сжечь в муфельной печи, а при ее отсутствии утилизировать как труп животного. Инфекционный ринотрахеит крупного рогатого скота (Rinotracheitis infectiosa bovinum) Определение. Инфекционный ринотрахеит (пузырьковая сыпь, инфекционный вульвовагинит, инфекционный некротический ринотрахеит, инфекционный ринит, красный нос, инфекционный катар верхних дыхательных путей) — остро протекающая контагиозная болезнь крупного рогатого скота, характеризующаяся поражением дыхательных путей, лихорадкой, общим угнетением и конъюнктивитом. В некоторых случаях появляется пустулезный вульвовагинит и баланопостит при попадании вируса в половые органы животных. У беременных животных неизбежны аборты. Историческая справка. Впервые болезнь зарегистрирована в США в 1950 г. у откормочного скота N.G.Miller (1955). Вирус выделен H.Madin et al. (1956) из носовых истечений телят с острым респираторным заболеванием. После этого инфекционный ринотрахеит (ИРТ) обнаружен в различных странах мира. В бывшем СССР сходное по клиническим и патологоанатомическим признакам заболевание наблюдал в 1938 г. Ф.М.Пономаренко (1940). Вирус впервые выделил Н.Н.Крюков в 1969 г. от больных телят из хозяйств Тамбовской области. В результате проведенных исследований установлено, что ИРТ имеет тенденцию к более широкому распространению в животноводческих хозяйствах мясо-молочного направления и особенно в хозяйствах с высокой концентрацией сборного поголовья. Эпизоотологические данные. В естественных условиях инфекционным ринотрахеитом болеет крупный рогатый скот, особенно тяжело - телята и молодняк на откорме. Кроме того, генитальная форма заболевания установлена у беловежских зубров. При серологическом обследовании различных видов копытных жвачных антитела к вирусу ИРТ установлены в Танзании у взрослых буйволов. Лабораторные животные к вирусу не чувствительны, однако в ВИЭВ были проведены исследования по адаптации вируса инфекционного ринотрахеита к белым мышам (Н.Н.Крюков, А.Г.Глотов, 1987). При этом у них отмечались характерные клинические признаки. Источником возбудителя инфекции являются больные и переболевшие животные, выделяющие вирус 6—12 мес. после выздоровления. Очень опасны быки-производители, переболевшие генитальной формой и длительное время содержащие вирус в сперме. Из организма животных вирус выделяется с секретом из носа и глаз, истечениями из половых органов, со спермой, молоком, мочой, калом. Заражение происходит аэрогенным, контактным путем и при случке. Факторами передачи возбудителя инфекции служат инфицированные воздух, корма, подстилка, предметы ухода за животными, одежда и руки обслуживающего персонала, инструментарий и др. Нами (П.А.Красочко, П.П.Фукс и соавт., 1994) установлено, что одним из путей сохранения в природе и передачи чувствительным животным являются бактерии, в частности, Bacillus alvei — возбудитель европейского гнильца пчел, который в своем геноме содержит нуклеиновую кислоту вируса ИРТ. Инокуляция телятам убитой и дезинтегрированной бактериальной массы вызывает заражение, подтверждающееся клинически и серологически. Заболевание не имеет выраженной сезонности. На комплексах по выращиванию крупного рогатого скота (нетелей или откорму бычков) инфекционный ринотрахеит проявляется в виде периодических вспышек, возникающих на 5—7-й день после завоза сборного поголовья телят, предназначенных для комплектования групп животных в помещениях комплексов и ферм. Вначале заболевают отдельные животные, затем количество их быстро нарастает, достигая максимума на 9—14-й день. Вспышка заболевания длится до 21—24 дней, в течение которых подвергается заражению до 95% животных. При инфекционном ринотрахеите летальность достигает 25%. Для ИРТ характерным является осложнение секундарной микрофлорой, что обусловливает более тяжелое течение заболевания и более высокую летальность (до 40%). В неспециализированных хозяйствах и мелких фермах инфекция протекает значительно слабее и бессимптомно. К вирусу инфекционного ринотрахеита чувствителен плод крупного рогатого скота: внутриутробное заражение приводит к его гибели или возникновению иммунологической толерантности. Нами (П.А.Красочко, 1985—1999; И.А.Красочко, 1989—1997) проведено серологическое обследование крупного рогатого скота и овец из животноводческих хозяйств Республики Беларусь и беловежских зубров на наличие антител к вирусу ИРТ. Результаты исследований представлены в табл. 6.
Таблица 6 Результаты исследования сывороток крови от копытных жвачных на наличие антител к вирусу инфекционного ринотрахеита
Представленные в таблице данные свидетельствуют о достаточно широком распространении инфекционного ринотрахеита в Беларуси и его роли в заболеваемости животных с различной патологией. Биологические свойства возбудителя. По современной классификации возбудителем ИРТ является ДНК-геномный вирус, принадлежащий к семейству Herpetoviridae, роду Herpesvirus I. Свойства вируса ИРТ общие для всех представителей рода Herpesvirus и включают: центральное ядро двухцепочнонй ДНК, окруженное икосаэдрическим капсидом, состоящим из 162 камсомеров; формирование капсидов в ядре клетки-хозяина и почкование их на ядерной мембране при созревании; наличие трехслойной оболочки, состоящей из компонентов вируса и клетки-хозяина; продуцирование внутриядерных телец-включений; способность к длительной персистенции, латенции и рецидивам заболевания. Вирусные частицы имеют следующие размеры, установленные различными способами: 175 нм — метод фильтрования; 148—210 нм — метод ультрацентрифугирования; 100—300 нм — электронная микроскопия. Диаметр нуклеотида — 36—45, молекулярный вес ДНК — 92—102´106 дальтон, диаметр нуклеокапсида — 82—110 нм. Константа седиментации зрелого вириона 1630—1830 S; плавучая плотность в градиенте плотности сахарозы — 1,248—1,267. Культивирование возбудителя. Для культивирования вируса ИРТ применяют различные культуры клеток из тканей крупного рогатого скота, овец, коз, лошадей, реже — свиней и кроликов. Этот вирус обладает широчайшим тканевым тропизмом. Он может инфицировать клетки надпочечников, вилочковой, щитовидной и поджелудочной желез, семенников, легких, лимфатических узлов, почек как крупного рогатого скота, так и других видов животных. При изучении ЦПД в неокрашенных препаратах в клеточном монослое заметно округление клеток, зернистость, расположение их кучками в виде скоплений, конгломератов — в виде гроздьев винограда. В связи с тем, что вирус ИРТ вызывает разнообразные клинические симптомы у крупного рогатого скота, были проведены многочисленные исследования по дифференциации штаммов герпесвирусов I, вызываемых различные формы заболевания. Были использованы многие методы, такие, как нейтрализационная кинетика, термолабильность, электронное микроскопирование, размножение в тканевых культурах, плавучая плотность, величина бляшек в клеточных культурах, устойчивость к трипсину, зональный электрофорез, рестрикционный анализ, позволившие установить некоторое различие между штаммами вирусов, вызывающих ИРТ и пустулезный вульвовагинит. Однако эти различия не обнаруживают зависимости между клиническими признаками заболевания и геномным анализом данных штаммов. Это позволило предположить, что только путь инфицирования и тип хозяйства могут быть более важным фактором для клинического проявления заболевания, чем штамм вируса. Патогенез инфекционного ринотрахеита. Особенностью вируса ИРТ является то, что он имеет тропизм к клеткам органов дыхания, размножения, конъюнктивы, желудочно-кишечного тракта, почек. В результате репродукции вируса в чувствительных клетках наступает их дегенерация, теряется их функция. При этом угнетается иммунная система и нарушаются обменные процессы организма. В зависимости от локализации возбудителя в организме, места его репродукции отмечают и разнообразные клинические признаки болезни. Клинические признаки болезни. В зависимости от локализации патологического процесса различают несколько форм болезни — респираторную, конъюнктивитальную, нервную, генитальную, абортивную, кожную, стомальную, энтеральную. В патологии крупного рогатого скота наибольшее распространение получили респираторная, генитальная, абортивная формы, которые и наносят большой экономический ущерб животноводству. Ряд исследователей установили взаимосвязь течения энтеральной, генитальной и респираторной форм ИРТ у крупного рогатого скота различных половозрастных групп. Генитальная форма проявления ИРТ у коров протекает с признаками воспаления слизистой оболочки с последующей некротизацией эпителия с образованием пустул и язв. Локализация процесса во влагалище не всегда приводит к нарушению репродуктивной функции. Если же вирус проникает в более глубокие части полового аппарата, например, при осеменении инфицированной спермой, возникают цервициты, эндометриты, сальпингиты, оварииты, которые носят временный характер, хотя могут наблюдаться случаи продолжительного бесплодного периода, который выражается в многократных перегулах. У стельных животных вирус ИРТ может вызывать гибель эмбриона, на более поздних стадиях стельности — гибель плода и аборт или же рождение нежизнеспособных, гибнущих в первые сутки телят. Действие вируса на плод выражается в постепенном прекращении плацентарного кровообращения и последующей дегенерации плаценты, что сопровождается абортами или поражением плода без патологических изменений в плаценте. Это говорит о том, что плод может быть местом первичного размножения вируса. Установлено, что у плодов 90—100-дневного возраста вырабатываются противовирусные антитела, относящиеся к Ig G1, Ig G2, Ig M и Ig А классов. В защите плода принимают участие и неспецифические факторы — интерферон и фагоцитоз. Респираторная форма заболевания наиболее часто встречается у молодняка, хотя могут поражаться и взрослые животные. Заболевание клинически проявляется повышением температуры тела, застойной гиперемией, воспалением слизистых оболочек носа, выделением вначале серозного, а затем слизисто-гнойного экссудата. Воспаление слизистой оболочки гортани, трахеи вызывает повышенную секрецию в этих участках, сужение щели гортани и просвета трахеи, закупорку бронхиол, что сильно затрудняет дыхание и усиливает дыхательный шум. В результате этого возникает кашель. При тяжелом течении ИРТ болезнь часто заканчивается гибелью животного. От инфицированных вирусом инфекционного ринотрахеита коров телята рождаются нежизнеспособными. У них болезнь протекает в генерализованной форме с поражением желудочно-кишечного тракта. Так, вирус инфекционного ринотрахеита крупного рогатого скота вызывает у животных клиническое проявление заболевания с различным течением — генитальным, респираторным, энтеральным, которые взаимодействуют и создают цепь: плод—теленок—взрослое животное. Диагноз на инфекционный ринотрахеит ставят комплексно на основании клинико-эпизоотологических данных, патологоанатомических изменений и лабораторных исследований. Клинико-эпизоотологические данные. Для постановки диагноза с учетом клинико-эпизоотических данных необходимо учитывать следующие моменты: —тип хозяйства, характер комплектации помещений; —время возникновения заболевания от начала комплектования помещения; —характеристика заболеваемости в данном хозяйстве за последних 3—5 лет; —клинические признаки заболевания; —характеристика заболевших животных. Патологоанатомические изменения при инфекционном ринотрахеите. Патологоанатомические изменения характерны для той формы заболевания, от которой животное пало или вынужденно убито. При респираторной форме болезни устанавливают катаральное воспаление и отек слизистой оболочки носовой полости, гортани, трахеи, скопление серозного или гнойного экссудата в носовых ходах и трахее.Иногда на слизистой оболочке носа обнаруживают очаги некроза, кровоизлияния, серозно-фибринозные пленки. Конъюнктива отечна, гиперемирована, легкие увеличены в объеме, просветы бронхов и альвеол заполнены пенистой жидкостью или слизисто-гнойным экссудатом. В случаях, когда ИРТ осложняется секундарной микрофлорой, на слизистой носовой полости и трахеи выявляют очаги некроза, дифтеретические наложения, эмфизему легких, катарально-гнойную бронхопневмонию. При генитальной форме у крупного рогатого скота выявляют гиперемию слизистых оболочек преддверия вагины у коров, препуция и пениса у быков, появление на них кровоизлияний, пустул, а в более поздние сроки - эрозий и язв. Иногда обнаруживают некротические очаги слизистой оболочки, покрытые дифтероидной пленкой. При патологоанатомическом исследовании некротического баланопостита у зубров, вызванного вирусом инфекционного ринотрахеита, выявляют хроническое катаральное воспаление препуциального мешка, проявляющееся набуханием кожи и подкожной клетчатки. Крайняя плоть набухшая, отечная, сужена с наличием в просвете тягучего экссудата с примесью гнойной жидкости зеленоватого цвета, выход пениса затруднен. Иногда отмечают флегмонозные изменения от пениса до промежности. При некротическом баланопостите отмечается уроцистит. При конъюнктивальной форме при вскрытии обнаруживаются неровности с серыми наложениями, которые придают слизистой оболочке зернистый вид. Иногда отмечается кератоконъюнктивит с помутнением роговицы. При энцефалитной форме, которая проявляется одновременно с респираторной, видимых поражений головного мозга не отмечается. Однако имеется гиперемия мозговых оболочек. При гистологическом исследовании обнаруживают негнойный энцефалит. При энтеральной форме инфекционного ринотрахеита на вскрытии отмечают обезвоживание организма, катаральное воспаление тонкого кишечника, поражение почек. Лабораторные исследования при инфекционном ринотрахеите включают в себя: —выявление вируса или вирусного антигена в биологическом материале; —выявление антител у больных или переболевших животных; —гистологические исследования. Материалом для выделения вируса или вирусного антигена служат экссудат из носа, влагалища, конъюнктивы, препуция, пораженные ткани респираторных органов, кишечника, а также кровь от больных животных. Вирусовыделение из биологического материала от больных животных проводят на первично-трипсинизированных клетках почки эмбриона коровы (ПЭК), тестикул бычка (ТБ), перевиваемых клетках почки теленка (ПТ-80 или МДБК). Для вирусовыделения проводят 3 слепых пассажа на культуре клеток и затем проводят идентификацию вируса в одной из иммунологических реакций: нейтрализации (РН), иммуноферментном анализе (ИФА), непрямой гемагглютинации (РНГА), торможения непрямой гемагглютинации (РТНГА). Выявление вирусного антигена осуществляют из биологического материала — мазков отпечатков из пораженных органов — трахеи, слизистой носовой полости, легких, почек, желудочно-кишечного тракта в в одной из иммунологических реакций: иммунофлуоресценции (МФА), иммуноферментном анализе (ИФА). Серологические исследования проводят путем исследования сывороток крови, молока, молозива, носовых секретов на обнаружение специфических противовирусных антител. Для подтверждения диагноза обычно используют парные сыворотки крови, взятые от животных в начале заболевания и через 2—3 недели. Также исследуют и одинарные пробы крови. Но при этом необходимо учитывать следующее: наличие антител в сыворотках крови от телят до месячного возраста свидетельствует о состоянии колостральной защиты молодняка; наличие антител у телят старше 4—5-месячного возраста свидетельствует о наличии постинфекционных антител. Наличие антител у взрослых животных в крови, молоке или молозиве свидетельствует о циркуляции возбудителя в стаде и о степени инфицирования животных; наличие антител в носовых секретах свидетельствует о местной иммунной защите животных (у переболевших животных — о постинфекционном иммунитете, у вакцинированных животных — о наличии поствакцинальных антител). Для выявления антител к вирусу инфекционного ринотрахеита используют следующие иммунологические реакции: нейтрализации (РН), иммуноферментный анализ (ИФА), непрямой гемагглютинации (РНГА), задержки гемагглютинации (РЗГА), связывания комплемента (РСК). Вирусная диарея крупного рогатого скота (Diarrhea vizalis bovum) Определение. Вирусная диарея крупного рогатого скота (болезнь слизистых оболочек, мукозальная болезнь, инфекционная диарея крупного рогатого скота, инфекционный энтерит крупного рогатого скота, диарея новорожденных телят) — контагиозная болезнь преимущественно молодых животных, характеризующаяся эрозивно-язвенным воспалением слизистых оболочек пищеварительного тракта. Зачастую возникает синдром респираторного заболевания, эрозивно-язвенный стоматит с хромотой, а также латентная инфекция коров, приводящая к острой инфекции плодов, вызывая их мумификацию, аборты, врожденные дефекты и диарею новорожденных телят. Историческая справка. Впервые вспышку вирусной диареи (ВД) описали в Северной Америке в штате Нью-Йорк в 1946—1947 гг. Olafson et al. Ими установлено, что среди взрослых коров до 90% могут иметь противовирусные антитела без клинических признаков болезни. Вирусная диарея крупного рогатого скота широко распространена во всех странах мира с развитым промышленным животноводством. Вспышки ВД отмечены в ФРГ в земле Шлезвиг-Гольтшвейн, Ирландии, Великобритании, США, Молдове, России, Беларуси, на Украине и т.д. Эпизоотологические данные. Наряду с крупным рогатым скотом в естественных условиях к вирусной диарее восприимчивы буйволы, олени, косули, козы, овцы. У свиней инфекция протекает бессимптомно. Серологические исследования показали, что в полевых условиях вирус диареи инфицирует свиней, коз, буйволов, оленей, косуль, овец, беловежских зубров, красных оленей. Вирус диареи выделен от человека при наличии у него специфических антител. Имеются сообщения о возможности экспериментального заражения овец, коз, поросят и кроликов. Лабораторные животные — белые мыши, крысы, морские свинки, хомячки, собаки, кошки, цыплята, голуби устойчивы к заражению. Нами проведено серологическое обследований различных чувствительных к вирусной диарее животных (табл.7). Приведенные в таблице данные показывают, что вирус диареи широко распространен в природных условиях. Наряду с поражением сельскохозяйственных животных (крупного рогатого скота, овец, коз), вызывая у них заболевание, вирус циркулирует в стадах диких животных (зубры и маралы), а также у человека. Основным источником возбудителя инфекции являются больные животные, выделяющие вирус во внешнюю среду со слюной, слезами, носовыми истечениями, мочой, фекалиями, спермой и молоком. Большую опасность представляют животные-вирусоносители с хроническим и латентным течением болезни. В клетках лимфоидной ткани переболевших животных вирус может персистировать (находиться) от 120 до 200 дней. Перезаражение происходит воздушно-капельным путем, при прямом контакте здоровых животных с больными, а также при поедании инфицированного корма. Установлено внутриутробное заражение, а также через молоко больных матерей. Вирусная диарея регистрируется в любое время года, но более тяжело она протекает поздней осенью и зимой. Возникновению болезни способствуют факторы, понижающие резистентность организма: переохлаждение, неполноценное и несбалансированное кормление, транспортировка и др.
Таблица 7 Результаты исследования сывороток крови от различных видов животных на наличие антител к вирусу диареи крупного рогатого скота
Вирусная диарея чаще всего проявляется в виде энзоотических вспышек среди молодняка на животноводческих фермах и комплексах. Заболеваемость колеблется от 10 до 100%, летальность - от 5 до 95%. Это зависит от вирулентности штамма вируса, резистентности организма животных, уровня иммунитета, зоогигиенических условий содержания. Биологические свойства возбудителя. Возбудителем вирусной диареи крупного рогатого скота является РНК-геномный вирус, относящийся к семейству Тogaviridaе, роду Pestivirus. Плавучая плотность вируса диареи (штаммы “NADL”, “Oregon C24-V”, C-1220) в градиенте плотности хлористого цезия составляет 1,15 г/см3.; 1,115 г/см3 (для вируса Oregon C24-V”) в градиенте плотности тартрата калия; 1,075—1,115 (средняя 1,092) для штамма NADL в градиенте плотности сахарозы. Вирус диареи к.р.с. имеет родственные растворимые антигены с вирусом чумы свиней. Культивирование возбудителя. Вирус диареи в значительной степени обладает пантропностью, т.е. репродуцируется в различных органах и тканях крупного рогатого скота и других видов животных. Вирус размножается в первичных культурах клеток ПЭК, семенников теленка, почки ягненка, перевиваемой культуре клеток селезенки эмбриона коровы, макрофагах и лимфоцитах крупного рогатого скота. Имеются сведения о возможности культивирования вируса в перевиваемой культуре почек свиньи РК-15, почек хомяка (линии НАК), человеческих клетках линий ЕРК-1, Не1а. Цитопатический эффект в инфицированной культуре обычно начинает развиваться на 3—5-е сутки инкубации и выражается в появлении мелкозернистой инфильтрации в клетках фибробластического типа. По мере развития инфекции клетки постепенно отторгаются от поверхности стекла. Но некоторые долго сохраняются, образуя островки распластанных по стеклу истонченных клеток эпителиодного типа. В конце концов на стекле остается сеть зернистого материала. A.L.Fеrnelius изучал динамику накопления вирусного антигена в культуре клеток методом иммунофлуоресценции и установил, что развитие вируса начинается в ядре через 6—8 часов после заражения, затем вирусный антиген перемещается в перинуклеарную зону и обнаруживается в области аппарата Гольджи (12—24 часа), а затем — в цитоплазму клеток, вызывая яркое гранулярное свечение (48—71 час), а затем диффундирует по всей цитоплазме (96 часов). Сроки наступления ЦПД не соответствуют скорости размножения вируса, максимальное накопление которого в инфицированной культуре клеток ПЭК происходит обычно через 96 часов инкубации (титр 106,5 ТЦД 50) мл, а наибольшее развитие ЦПД обнаруживают в более поздние сроки (на 4—6-е сутки). Патогенез вирусной диареи. Учитывая то, что вирус диареи имеет тропизм к клеткам органов дыхания, размножения, иммунной системы, желудочно-кишечного тракта, почек, его воздействие на организм различно. В результате репродукции вируса в чувствительных клетках наступает дегенерация и нарушается их функция. Особенно это касается иммунной системы. Из-за переболевания животных вирусной диареей отмечена сильная иммунодепрессия. По этой причине иммунная система организма не в состоянии отвечать на другие вирусные и бактериальные антигены. Кроме того, после болезни отмечаются нарушения обменных процессов организма. В зависимости от локализации возбудителя в организме, места его репродукции отмечают и клинические признаки заболевания. У животных, у которых развивалась персистентная инаппаратная инфекция вирусной диареи, очень часто поражались почки и мозг. При микроскопическом исследовании отмечались диффузные и фокусные утолщения гломерулярных мембран, в глорумелах — значительное увеличение мезенхимальных клеток и небольшое количество нейтрофилов. В коре головного мозга наблюдалась дегенерация нейронов, окруженных небольшим количеством астроцитов и макрофагов. В мозжечке лишь редкие клетки Пуркинье содержали флуоресцирующий антиген, так же, как и в спинном мозге (затылочной части). Клинические признаки заболевания. При переболевании крупного рогатого скота вирусной диареей наблюдаются различные формы течения болезни: энтеральная, респираторная, генитальная, абортивная, что зависит от вирулентности штамма, возраста и чувствительности животных, наличия неблагоприятных факторов внешней среды. Ряд авторов отмечали течение вирусной диареи с поражением кожи в виде дерматита в области межкопытной щели и вокруг венчика, струпьев на лицевой части головы и по всей поверхности тела. Установлена связь между инфекцией вирусной диареи с абортами у коров, диареей новорожденных и респираторных заболеваний у телят старше 3—4-месячного возраста. Как и при инфекционном ринотрахеите, чаще всего при вирусной диарее регистрируют энтеральную, генитальную, абортивную и респираторную формы инфекции, которые наносят большой экономический ущерб животноводству. Энтеральная форма вирусной диареи встречается как у новорожденных телят, так и у взрослых животных. Вначале у телят наблюдается сильная диарея, а в фекалиях — значительное количество слизи. Через несколько дней отмечается обезвоживание организма различной степени тяжести. Лечение животных антибиотиками и вяжущими средствами неэффективно. У коров основными признаками заболевания бывает лихорадка, затяжные поносы, кашель, поражение слизистой оболочки носовой и ротовой полостей, желудочно-кишечного тракта. Смерть наступает от обезвоживания. У телят до 6 мес. заболевание имеет тенденцию к длительному хроническому течению (до 10 мес.) с периодическими ремиссиями. Летальность достигает 80%. Основными клиническими симптомами являются: понос, обезвоживание, потеря аппетита, снижение живой массы. После переболевания новорожденных телят энтеральной формой вирусной диареи у них через 2—3 мес. можно отметить поражение респираторных органов. При этом наблюдается повышение температуры, кашель, истечение из носовой полости. У взрослых животных вирусная диарея протекает в основном в хроническом и субклиническом проявлениях и сопровождается абортами, иммуносупрессией, персистентной инфекцией, появлением на свет слабого потомства. Одним из путей передачи вирусной диареи и внутриутробного заражения является трансплантация эмбрионов. При этом поражаются как плоды крупного рогатого скота, так и репродуктивные органы коров. У телят, трансплацентарно инфицированных вирусом диареи, установили гипоплазию мозжечка и водянку головного мозга. Молодняк, полученный от коров, вакцинированных между 90 и 118 днями стельности, имел поражения центральной нервной системы: атаксию, искривление шеи, астазию, опистотонус. При абортивном течении вирусной диареи у недоношенных плодов раннего возраста наблюдают геморрагические изъязвления слизистой оболочки, некроз легких, кожи, головного мозга, воспалительные поражения околоплодных оболочек и кожного покрова. Диагноз на вирусную диарею ставят комплексно на основании клинико-эпизоотологических данных, патологоанатомических изменений и лабораторных исследований(см.главу “Инфекционный ринотрахеит”). Патологоанатомические изменения при вирусной диарее. Патологоанатомические изменения характерны для той формы заболевания, от которой животное пало или вынужденно убито. Характерные патологоанатомические изменения обнаруживают на слизистых оболочках желудочно-кишечного тракта и дыхательных путей. Эрозии и язвы находят на слизистой оболочке губ, щек, десен, на боковых поверхностях языка, на небе и у основания гортани. Аналогичные изменения обнаруживают в рубце и сычуге. В тонком кишечнике отмечают изменения, характерные для катарального, фибринозно-некротического или геморрагического энтерита. При генитальной форме заболевания, возникающей у взрослых животных, на вскрытии у павших или вынужденно убитых животных не обнаруживают характерных патологоанатомических изменений. На абортированных плодах имеются характерные для вирусной диареи изменения — геморрагические изъязвления слизистой оболочки, некроз легких, кожи, головного мозга, воспалительные поражения околоплодных оболочек и кожного покрова. Иногда можно наблюдать гипоплазию мозжечка и водянку головного мозга. Комплекс лабораторных исследований при вирусной диарее такой же, как и при ИРТ - выявление специфического антигена из биологического материала с использованием иммуноферментного анализа (ИФА) или иммунофлуоресценции (МФА), выделение вируса на культуре клеток и его идентификация в реакциях нейтрализации (РН) и торможения непрямой гемагглютинации (РТНГА). Сюда же входит реакция связывания комплемента (РСК), иммуноферментный анализ (ИФА), а также ретроспективная диагностика с помощью реакции непрямой гемагглютинации (РНГА), иммуноферментного анализа (ИФА), нейтрализации (РН), связывания комплемента (РСК). Респираторно-синцитиальная инфекция крупного рогатого скота (Bovine respiratory suncytial disease) Определение. Респираторно-синцитиальная инфекция к.р.с. (заразный кашель, пульмональная эмфизема) - контагиозная, остро протекающая болезнь, преимущественно телят. Она характеризуется лихорадкой и катаральным воспалением слизистых оболочек органов дыхания, сильным кашлем, потерей аппетита, поражением легких. Историческая справка. Респираторно-синцитиальный вирус впервые изолирован в 1956 г. от шимпанзе с клиническими признаками поражения верхних дыхательных путей и назван “возбудителем насморка шимпанзе”. В следующем году R.M.Chanock et al. выделили антигенно-родственный изолят от двух детенышей с симптомами заболевания нижнего отдела органов дыхания. С учетом специфики развивающегося в инфицированной культуре клеток цитопатического действия вирус был переименован в “респираторно-синцитиальный”. Впервые в 1968 г. J.E.Dagget et al. сообщили об обнаружении вируснейтрализующих антител к респираторно-синцитиальному вирусу человека в сыворотках крови крупного рогатого скота. Это позволило им предположить присутствие у к.р.с. антигенно-родственного человеку респираторно-синцитиального вируса. Дата добавления: 2015-11-25 | Просмотры: 1725 | Нарушение авторских прав |
 .
.