 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
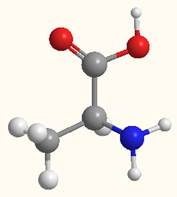
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТФИЗИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ a-Аминокислоты – твердые кристаллические вещества, вследствие ионного строения имеют высокие и нечеткие температуры плавления, обычно хорошо растворимы в воде, плохо в спирте и совсем не растворяются в эфире. На рисунке показаны структурные модели L- и D-аланина.
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
1. Амфотерность. В водных растворах молекулы аминокислот находятся в виде биполярных ионов, проявляющих как кислотные, так и основные свойства:
2. Образование пептидов:
Аланилфенилаланин (дипептид) 3. Реакции по карбоксильной группе 3.1. Реакции солеобразования – взаимодействие с металлами, основными оксидами, щелочами: 2H2N–СН2–СООН + Mg ® (Н2N–СН2–СОО)2Мg + Н2 H2N–СН2–СООН + NаОН ® H2N–СН2–СООNа + Н2О 2H2N–СН2–СООН + CuО ® (Н2N–СН2–СОО)2Сu + Н2О 3.2. Образование сложных эфиров (этерификация): t° H2N–СН2–СООН + Н3С–СН2–ОН ⇄ H2N–СН2–СО–О–СН2–СН3 + Н2О H2SO4 3.3. Образование галогенангидридов: H2N–СН2–СООН + РСl5 ® H2N–СН2–СО–Сl + РОСl3 + НСl 3.4. Образование амидов: H2N–СН2–СООН + NН3 ® H2N–СН2–СО–NН2 + Н2О 3.5. Декарбоксилирование: H2N–СН2–СООН 4. Реакции по аминогруппе 4.1. Взаимодействие с кислотами: H2N–СН2–СООН + НСl ® Сl–×N+Н3–СН2–СООН 4.2. Ацилирование: H2N–СН2–СООН + Сl–СО–СН2–СН3 ® Н3С–СН2–СО–NН–СН2–СООН + НСl пропионилглицин 4.3. Алкилирование: H2N–СН2–СООН + СН3I ® Н3С–NН–СН2–СООН + НI метилглицин 4.4. Реакция с азотистой кислотой: H2N–СН2–СООН + НNО2 ® N2 + Н2О + HО–СН2–СООН 4.5. Дезаминирование (ферментативное): – Гидролитическое: H2N–СН2–СООН + Н2О ® HО–СН2–СООН + NН3 – Восстановительное: H3С–СН(NН2)–СООН + 2Н ® H3С–СН2–СООН + NН3 – Окислительное: H3С–СН(NН2)–СООН – Внутримолекулярное: H3С–СН(NН2)–СООН ® H2С=СН–СООН + NН3 5. Свойства за счет радикалов Радикалы аминокислот способны к разнообразным взаимодействиям: – реакции солеобразования (по группам NH2– и –СООН); – реакции окисления и восстановления (по группам НS– и –SS–); – реакции алкилирования, ацилирования и этерификации (по группам NН2–, ОН–, НО–С6Н4–, –СООН); – реакции амидирования (по группам –СООН); – реакции нитрования и галогенирования (по ароматическим ядрам); – реакции дезаминирования (по группам –NН2); – реакции декарбоксилирования (по группам –СООН); – реакции фосфорилирования и сульфатирования (по группам –ОН); – реакции азосочетания (по ароматическим и гетероциклическим ядрам) и т. д. Дата добавления: 2015-12-15 | Просмотры: 631 | Нарушение авторских прав 12 |

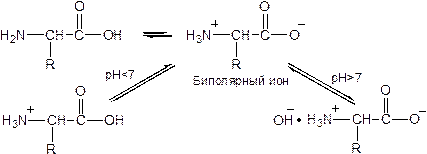

 H2N–СН3 + СО2
H2N–СН3 + СО2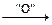 H3С–СО–СООН + NН3
H3С–СО–СООН + NН3