|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ВЕРТЕБРОНЕВРОЛОГИЧЕСКОГО 4 страницаЯдра — центры питания, располагаются по оси волокна между фибриллами. Ядерный аппарат особенно богат в местах расположения нервных окончаний — в двигательной пластинке. Соли, кислоты, щелочи и алкалоиды в малых дозах, равно как и охлаждение, понижают, а те же вещества в больших дозах, так же как и нагревание, повышают возбудимость мышцы. Ацетилхолин в малых дозах повышает возбудимость, а в больших дозах, давая сильное контрактурное сокращение, угнетает ее (Беритов И.С., 1947). Под влиянием нервного импульса происходит кратковременная деполяризация мембраны нервного окончания, увеличивается проницаемость кальция внутрь окончания, что способствует резкому увеличению частоты выделения квантов ацетилхолина в синаптическую щель. Это приводит к увеличению проницаемости сарколеммы для ионов натрия и калия, к возникновению потенциала концевой пластинки. Мышца сокращается тем скорее и интенсивнее, чем меньше она растянута, чем больше она отдохнула и чем выше ее температура. Растяжение происходит тем больше, чем сильнее ее тетаническое сокращение и чем больше ее утомление. Принято судить о функции контрактильного аппарата по скорости развития изометрической тетанической активности. Считают, что это показатель скорости скольжения акти-новых и миозиновых нитей, т.е. скорости образования их мостиков (Богданов Э.И., 1989). Однако указанные показатели связаны с функцией не одних лишь мышечных фибрилл. Кроме активных контрактильных элементов в мышце имеются, как упомянуто выше, соединительнотканные упругие части — оболочки: эпимизий, перимизий и эндоми-зий (см. рис. 3.14). Подробнее на роли этих элементов мы остановимся в главе о патогенезе. Электронное микроскопирование с одновременной регистрацией силы тяги и длины саркомера показало, что сила активных компонентов максимальна при наибольшем перекрытии активных участков актиномиозиновых фила-ментов и падает при уменьшении или при увеличении обшей длины мышцы, когда уменьшается или увеличивается расстояние между ее концами, т.е. когда уменьшается соответственно число поперечных мостиков, образующихся между миозиновыми и актиновыми нитями. Как может миофибрилла передать в концах сарколеммы силу тяги большую, чем это позволяет ее механическая прочность? Два Z-диска соседних миофибрилл связаны продольными промежуточными миофиламентами. Они растяжимы. Тем не менее они не растягиваются, тогда как более прочные сухожилия удлиняются. Если бы механическая тяга передавалась вдоль мышечного волокна от саркомера к саркомеру, эти филаменты должны были бы подвергаться растяжению. Механическое напряжение сетки кол-лагеновых волокон при сокращении миофибрилл в случае передачи усилий вдоль саркомеров должно бы падать, а оно увеличивается в ходе сокращения. Кроме того, нет морфологически установленного перехода миофибрилл в сухожилие. Поэтому эстонский исследователь А.А.Вайн (1990) предложил принципиально новую функциональную модель скелетной мышцы (см. рис. 3.15). Автор подтвердил, что в результате скольжения актиновых и миозиновых нитей повышается внутримышечное давление и увеличивается периметр мышечных оболочек (Henkelom В. et al., 1979). Эти соединительнотканные структуры (сарколемма, пери-и эпимизий) содержат коллагеновые волокна. Волокна сарколеммы имеют решетчатую ориентацию, которая не позволяет увеличиться объему мышцы (Заалишвили М.М., 1971; Гурфинкель B.C., Левин Ю.С., 1985). Тяга устремляется вдоль мышцы пропорционально увеличению ее периметра. Она передается сухожилию не от малопрочного саркомера, а через эндо-, пери- и эпимизий, т.к. прочность соединительной ткани на порядок выше прочности миофибрилл. Т.к. сеть коллагеновых волокон в эндо-, пери- и эпимизий не позволяет увеличить объем, а содержимое, окруженное этими оболочками, можно рассматривать как несжимаемую вязкую жидкость, то в этих структурах возникает механическое напряжение, которое передается через эндо-, пери-и эпимизиум к сухожилию мышцы (см. рис. 3.15). Прежняя функциональная модель мышцы не объясняет ее биомеханические свойства: жесткость, демпферность, релаксацион-ность и ползучесть. Эти свойства нереальны за счет поперечных мостиков. Новая же модель объясняет эти черты благодаря включению факторов эластичности соединительнотканных структур мышцы. Они аккумулируют энергию упругих деформаций при рекупурации (частичном возврате) энергии во время движения. Данная модель дала основание пересмотреть и некоторые стороны понятия мышечного напряжения, тонуса в условиях нормы и патологии, варианты сокращения (изометрического, кон- и эксцентрического) и пр. На этом мы остановимся после рассмотрения вопросов иннервации мышцы. Здесь же отметим, что R.Alexander, H.Bennet-Clark еще в 1977 г. отметили, что в ахилловом сухожилии может накапливаться потенциальной энергии упругой деформации больше, чем в икроножной мышце. Нам представляется, что имеются косвенные данные о роли реализации и синкинетических реакций при вынужденных позах, при неблагоприятных двигательных стереотипах. Так, в норме при глубоком вдохе синкинетически напрягаются сгибатели шеи (голова как бы тянется к источнику кислорода). Оказалось, что временные показатели этой реакции нарушаются, если меняется упругость, плотность («гистерезис») выйной связки (JiroutJ., 1993). Кривая сила-время может быть разделена на 4 зоны: 1) с медленным нарастанием напряжения (гофрированная структура коллагена — растяжение при растягивании); эта зона составляет 1-4% от начальной длины волокна; 2) с линейной зависимостью между приростами напряжения и удлинением — 2-5% от начальной длины сухожилия и 20-40% — у связок; 3) с первым повреждением волокон — Ортопедическая неврология. Синдромология
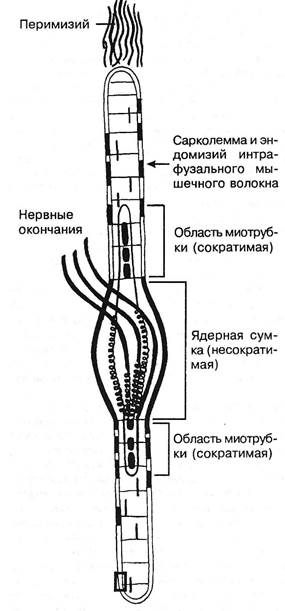
Рис. 3.16. Схематическое изображение мышечного веретена. нарушение линейной зависимости; предел прочности; 4) с резким падением напряжения из-за разрушения препарата. Препарат продолжает удлиняться, это удлинение называется ползучестью. Модуль упругости Юнга изменяется по мере растяжения препарата. Механические свойства связок и сухожилий за- висят от скорости растягивания: чем оно медленнее, тем меньше предельная нагрузка и энергия разрыва; при быстром растягивании развивается последующая релаксация. В процессе разминки теплопотери в сухожилиях уменьшаются, тренировки увеличивают сопротивление разрыву. Чем больше растянута мышца, тем менее она удлиняется при увеличении силы растяжения. При растягивании целой мышцы основное сопротивление оказывают соединительнотканные элементы. В активной мышце сила тяги равна сумме сил контрактильного и параллельного упругого компонентов. Еще ученик Галилея G.Borelli (1680) в книге «De motu animalium» показал, что сила сгибателей колена при разогнутом суставе составляет 51 фунт, при согнутом — 21 фунт: в активно растянутой мышце выступает действие соединительной ткани (чем длиннее мышца, тем больше сила, как и в пассивно растянутой мышце). Длина пассивной мышцы в покое (упругих сил нет) — это длина равновесная или свободная. Она чуть меньше естественной длины в живом теле. Мышца иннервирована не только эфферентными, но и афферентными нервными окончаниями. Более 100 лет назад, в 1863 г., Kiihne дал детальное гистологическое описание органов афферентной иннервации скелетной мускулатуры, назвав их нервно-мышечными веретенами (рис. 3.16). По свидетельству A.Ruffini (1898), рецепторы были впервые открыты Hassal в 1851 г. Вскоре C.Golgi (1870) сообщил о сухожильных рецепторах, после чего последовала серия работ о мышечных и других рецепторах (Чирьев С.И., 1870; Догель Е.С., 1897 и др.). Морфологические данные получили блестящее подтверждение и были развиты далее в трудах И.М.Сеченова (1863), C.S.Sherrington'a(1894). Нервными окончаниями наиболее богато брюшко мышцы. В обычных условиях и сокращение начинается в лучше иннервированных отделах, а затем уже в других. Запуск сокращения мышечного волокна происходит вследствие деполяризации его поверхностной мембраны. Затем деполяризуются его узкие инвагинации, образуемые мембранными ретикулярными выростами. Это служит сигналом для освобождения ионов Са2+ из саркоплазматичес-кого ретикулума, что ведет к увеличению концентрации в саркоплазме свободных ионов кальция, которые связываются с тропонином С. Это снимает блокирующее действие тропонин-тропомиозинового комплекса на актомиозино-вую систему волокна. Освобождаемый Са2+ откачивается обратно, реутилизируется в цистерны саркоплазматическо-го ретикулума в результате работы Са-АТФазы. Поэтому в миоплазме концентрация ионов кальция уменьшается, он удаляется из тропомиозинового комплекса, и мышца расслабляется. Активность сокращения зависит не только от кальциевой регуляции, но и от уровня фосфорилирования и дефос-форилирования легких цепей миозина. Непосредственным источником энергии сокращения мышцы является анаэробное расщепление АТФ (АДФ, Р). Ресинтез АТФ обеспечивается креатинфосфатом через окисление. Для восстановления креатинфосфата требуется расщепление гликогена до молочной кислоты. В момент расслабления мышцы прекращается расщепление фосфорной и молочной кислот, причем молочная восстанавливается в гликоген. Глава III. Методики вертеброневрологического обследования
О механизме раздражения мышечных рецепторов можно судить по рис. 3.17. Из веретен, деформирующихся под влиянием сокращения и растяжения экстрафузальных волокон поперечно-полосатой мышцы, следует информация, направляющаяся через задний корешок в различные отделы центральной нервной системы. Все эти данные послужили основанием для развития представления о собственных рефлексах мышцы, о стрэч-рефлексах. В последующем, с учетом данных о рецепторах сухожилий, периартикулярных и артикулярных тканей, возникло учение об артрогенных мышечно-тонических реакциях и контрактурах. Взгляды эти были широко использованы в клинике (Charcot J., 1886; Vulpian А., 1886; Корнилов А. А., 1895; Даркшевич Л.О., 1907; Вельяминов М.Я., 1924; Илютович Г.Е., 1951; Емельянов Л.Н., 1958; Лауцевичус Л.З., 1950, 1967, 1971 и др.). После того, как P.Hoffman (1922) описал собственный рефлекс мышцы, это учение в 40-е годы обогатилось важными данными. Оказалось, что до сокращения мышцы, т.е. до механических воздействий на веретено, последнее получает по тонким волокнам — у-эфферентам L.Lexel (1945) — предварительную информацию о предстоящем сокращении. Опережая импульс, следующий по толстым волокнам переднего корешка к нервно-мышечной пластинке, к веретену «спешат» импульсы-курьеры, импульсы-предвестники. Когда же мышца сократилась, сигнал из афферентных окончаний веретена поступает в центр, неся информацию об этом. Мнение о том, что ct-малые нейроны заканчиваются на красных мышечных волокнах, а сс-большие — на белых, фа-зических, оспаривается рядом авторов (Юсевич Ю.С., 1958 и др.). Если состояние у-эфферентов — важный периферический фактор формирования рефлекса на растяжение и рефлекторного тонуса, состояние а-малых нейронов — центральный фактор мышечного тонуса. Серое вещество спинного мозга содержит большое количество поперечно расположенных аксонов афферентных и эфферентных волокон и их коллатералей, объединяющих как одноименные ядерные образования, так и другие группы нейронов. Именно эти структуры играют значительную роль в распространении процессов возбуждения и торможения по всему спинному мозгу (Микеладзе А.Л., 1965). Обнаружено небольшое число афферентных волокон, вступающих через передние корешки, которые оказались симпатическими. Проприоспинальные связи обеих сторон поясничного и шейного утолщений осуществляются не только комиссу-ральными клетками 8 пластины Рекседа, но и клетками с длинными аксонами (Shimamura M., 1973). Описанные выше прямые и обратные связи мышцы обеспечивают не только проприоцептивную глубокую и другие сложные виды чувствительности, но и ряд рефлекторных процессов с участием разных уровней: сегментарных, ствола мозга, мозжечка, больших полушарий. Уже центральные нейроны первого порядка представляют собой своеобразные усилители афферентного потока — они генерируют разряды большей частоты и длительности, чем исходные (Костюк П.Г., I960 и др.). Благодаря их «спонтанной» активности, особенно в условиях благоприятствующих супраспинальных поли-синаптических влияний, кратковременная афферентная
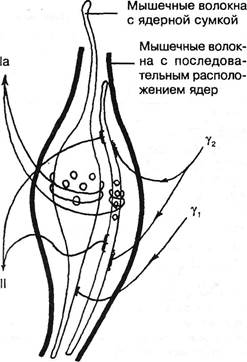
Рис. 3.17. Схематическое изображение мышечного веретена с двумя типами интрафузальных мышечных волокон. Слева — афферентные, справа — эфферентные нервные волокна (по Y.Korten, 1972). импульсация, поступающая из мышцы, способна вызвать не только фазический, но и длительный тонический центральный эффект. Этому, естественно, будут препятствовать как супраспинальное полисинаптическое торможение, так и торможение в первых звеньях тормозного устройства (Schmidt R., 1969; Сафьян В.И., 1976). Супраспинальные нисходящие тонические импульсы поступают по медленно проводящим кортико-руброспинальным волокнам, по ре-тикуло- и вестибулоспинальным путям. Когда прекращаются облегчающие влияния из ретикулярной формации ствола и ослабевают рефлексы на растяжение, наступает атония спинального центра (Сорох-тин Т.Н., 1961). С прекращением же угнетающих влияний на эти рефлексы последние усиливаются, и тонус нарастает. Это происходит как за счет импульсов а-малых клеток, так и веретена: чертик из табакерки выскакивает не только потому, что снята крышка, но и потому, что действует внутренняя пружинка. Изменения тонуса протекают различно в мышцах преимущественно белых и преимущественно красных. Существование двух типов мышц известно со времени L.Ranvier (1880). Одиночное сокращение в красной мышце продолжается в течение 100-120 мс, тогда как в белой — 20-60 мс. Сокращение в красных мышцах в энергетическом отношении экономичнее, чем в белых. У амфибий такое деление весьма обоснованно: существуют красные волокна, специализированные на медленной тонической деятельности, и белые волокна, специализированные на фазной деятельности. У человека такое деление имеет значение относительное. При его рождении все во- Ортопедическая неврология. Синдромология
локна медленные. Дифференциация начинается в первые недели жизни. У взрослого можно говорить о преобладании преимущественно белых мышц и о наличии отдельных красных, например камбаловидных, и смешанных. Красный цвет обусловлен миоглобином, кровью сети капилляров и митохондриями, повышающими оптическую плотность. В такой мышце ритмическая стимуляция вызывает локальную деполяризацию — развиваются медленные напряжение и расслабление. Малые низкопороговые мотонейроны, иннервирующие медленные мышцы, работают уже при небольшом возбуждающем влиянии. Они способны к длительной ацетилхолиновой контрактуре (Kuffer S. et al, 1953; Сагдеев СБ., 1971) и обеспечивают слабое, но малоутомительное сокращение. В белой мышце даже одиночный импульс вызывает распространяющийся потенциал действия и сокращение. Для ее неэкономных волокон требуется большая частота раздражения. S.Cooper, J.Eccles (1930) установили в экспериментах на кошках, что при ритмической стимуляции слияние сокращений для камбало-видной мышцы составляет 30 импульсов в секунду, а для икроножной — 100. Согласно H.Henneman, C.Olson (1965), частоты раздражения, при которых наступает максимальное напряжение, т.е. гладкий тетанус, в медленной и быстрой мышце соответственно составляют 5-10 и 150 Гц. Я.М.Коц (1972) рекомендует определять характер мышцы человека (медленная или быстрая) с помощью слабого тетанического электрического раздражения. Время от начала движения до момента достижения максимальной амплитуды, т.е. период восходящей части кривой сокращения, равно как и время полурасслабления, указывает на «медлительность» или «быстроту» мышцы. Разделение мышечных волокон на 3 типа: А, В и С основывается на результатах исследований H.A.Padykula и его сотрудников (1958, 1962). Такое разделение удалось благодаря окраске волокон на гликоген, АТФ-азу, неспецифическую эстеразу и, в особенности, на сукци-натдегидрогеназу (СДГ). В темном спектре волокон красных мышц преобладает аэробный гликолиз, метаболизм, зависящий от кислорода, при низкой способности расщеплять гликоген и высоком липидном обмене. В светлом спектре волокон в белых мышцах преобладает анаэробный гликолиз. В медленной мышце весьма высока вязкость. Это препятствует проявлению силы при больших скоростях сокращения. Соответствующая кривая сила-скорость (Ward А., 1938; Wells J., 1965) показывает, что в такой мышце с нарастанием скорости сокращения сила падает значительнее, чем в быстрой мышце. Схематические различия красных и белых мышц представлены в табл. 3. 1. Кроме фазных, в мышце имеются и тонические волокна. Иннервация красных мышц осуществляется тонкими нервными волокнами, что было установлено еще в 1901 г. (Hay J.). Значительно позже, когда была проведена рубри-фикация и нервных волокон — А, В, С (ErlangerJ., Gasser H., 1937), выяснилось, что красные мышечные волокна иннер-вируются а-малыми нервными волокнами (Eccles J., 1937, 1957). Чем толще нервное волокно, т.е. чем больше скорость проведения импульсов, тем больше скорость сокращения соответствующей мышцы (Bessou P. et al., 1963). В а-малых нейронах, согласно D.Kernell (1966), больше общее сопротивление мембраны. Это означает, что под действием одних и тех же токов в них тоническая возбудимость больше, чем в крупных нейронах. У красных мышц, например камбаловидной, более низкий порог рефлекса на растяжение, чем у белых, т.е. у них более низкий порог на раздражение веретен. У спинальных животных активация мотонейронов медленных мышц вызывается легче, чем активация быстрых. Она происходит даже при раздражении аффе-рентов соседних мышц (Eccles J., Eccles R., 1957). Удецереб-рированного животного красная камбаловидная мышца в ответ на растяжение дает напряжение, равное 90% своей максимальной тетанической активности, а икроножная — лишь 10% (Denny-Brown D., 1929). Известно, что в скелетной мышце имеются не только рабочие экстрафузальные волокна, обеспечивающие движение и позу, но и интрафузальные волокна веретен, управляющие частотой их импульсного разряда. Эти последние, считавшиеся медленными, тоже оказались неоднородными: они бывают быстрыми и медленными (Smith К., 1966; Diete-Spiff К., 1967). Механическая реакция на небольшое напряжение быстрого интрафузального волокна млекопитающего сводится к значительному противодействию, а реакция медленного волокна выражается в смещении и медленном Глава III. Методики вертеброневрологического обследования
восстановлении длины. Речь идет о поведении веретена с эластической сумкой, соединенной последовательно с весьма вязкой средой. Также и на тетаническое электрическое раздражение медленное интрафузальное волокно отвечает сокращением и расслаблением более медленным, чем быстрое интрафузальное. В веретенах выявляются и волокна с ядерной сумкой (ЯС) и с ядерной цепочкой (ЯЦ). Они различаются по длине лишь в крупных мышцах конечностей: около 7,5 мм в ЯС- и около 4 мм в ЯЦ-волокнах. После деафферентации ЯЦ-мышечные волокна веретен атрофируются, причем совершенно так же, как обычные экстрафу-зальные волокна. Следовательно, эти элементы рецепторов обладают и моторной иннервацией, которой не обладают никакие другие типы рецепторов. Что касается моторной иннервации медленных и быстрых интрафузальных волокон, то еще Cipollone (1897-1898) утверждал, что сокращение интрафузальных мышечных волокон происходит под влиянием идущих к ним нервных импульсов, а не внешнего давления на капсулу. Вследствие же сокращения интрафузальных мышечных волокон, располагающихся в полярных частях веретен, последние и приходят в состояние возбуждения. Автор наблюдал дегенерацию тонких миелиновых волокон, направляющихся в составе передних корешков к интрафузальным мышечным волокнам. Здесь они заканчиваются кустовидно или концевыми пластинками. Особенностью расположения нервных волокон в икроножной мышце является малокалиберность и рассеянность пучков (Абдуллаев М.С., 1960). Камбаловид-ная мышца богата кислыми митохондриальными ферментами, сукцинатдегидрогеназой, а икроножная — фосфори-лазой. При блокировании нервно-мышечной передачи трехглавой мышцы голени сублетальными дозами ботули-нического токсина камбаловидная мышца оправляется от пареза быстрее, чем икроножная. В последней гистологические изменения в нервно-мышечных окончаниях остаются на несколько месяцев. Она надолго лишается окраски на фосфорилазу, тогда как камбаловидная реагирует на первых порах даже быстрее, чем в норме (Duchen L., 1970). Импульсы у-волокон предшествуют двигательным импульсам а-толстых волокон. Классические эксперименты L.Lexel (1945) показали, что такое раздражение тонких миелиновых у-волокон и сокращение интрафузальных волокон вызывает разряд в задних корешках. R.Granit (1973) допускает, что медленно нарастающее интрафузальное сокращение связано с активацией у-кустовидных окончаний. Мышечные веретена являются сенсомоторными регуляторами, и эта реакция, видимо, осуществляется дифференцированно через медленные и быстрые волокна. Каким образом под влиянием нервных импульсов в самой мышце реализуется процесс сокращения? Как следует из приведенной выше функциональной модели скелетной мышцы, ее соединительнотканные структуры находятся в состоянии определенного растяжения, внутримышечного давления. С приходом нервного импульса к имеющемуся напряжению прибавляется механическое напряжение в зависимости от количества преобразованной биохимической энергии в механическую. Известны три формы мышечного сокращения: 1) изометрическая, когда мышца сохраняет свою длину; 2) концентрическая или миометрическая, изотоническая, с укорочением, выполнением положительной работы, в условиях, когда внешняя нагрузка меньше напряжения мышцы; 3) эксцентрическая или плиометрическая, когда мышца удлиняется, т.е. выполняется отрицательная работа, внешняя нагрузка больше напряжения мышцы, при этом чем больше вытянута мышца, тем менее она удлиняется при увеличении груза. Чаще имеет место смешанная форма — ауксотоническая, причем фаза напряжения короче фазы расслабления приблизительно вдвое. Демпфирование (глушение за счет потери энергии) выражено резко в сократительных элементах и слабо—в пассивно упругих. Что касается прочности связок и сухожилий, то она зависит от скорости их растягивания: чем выше эта скорость, тем больше нагрузка, требуемая для их разрыва. При растягивании целой мышцы наибольшее сопротивление оказывают соединительнотканные элементы. Эти механизмы срабатывают при повышении тонуса всей мышцы. Они важны для понимания преходящего и устойчивого гипертонуса, контрактуры и отдельных участков мышцы. На первых порах представления о мышечных уплотнениях складывались в понятиях коллоидной химии. Позднее стадии затвердения понимались как изменения коллоидов мышечного белка, переход от золя к гелю с консистенцией отвердевшего студня (миогелоз Schade Н., 1920; Lange М., 1931). Хотя оба автора описали эти образования независимо друг от друга, они дали общую оценку обнаруженным зонам мышечной резистентности. С помощью специального склерометра Н.Schade установил, что в норме различные мышцы отличаются по степени их плотности не более чем на 10%, тогда как в зонах миогелоза — до 50%. Уплотнения оставались и после новокаинизации и даже после смерти больных, отчетливо пальпируясь до наступления трупного окоченения. М.Lange пытался воспроизводить миогелозы в эксперименте путем стимуляции мышц бедра кролика и при местном замораживании. H.Strauss (1928) вслед за Гольдшейдером считал, что изменения эти связаны с холодом косвенно: холод вызывает вазомоторные сдвиги, анемию, затем венозный стаз. A.Schmidt (1910) определял в пораженных кусочках мышц повышенное кровенаполнение. Вследствие этого меняется и химизм мышцы. В ней накапливаются недоокисленные продукты, отмечается ацидоз (Good M., 1941, 1958), повышается содержание сукцинатде-гидрогеназы (Веселовский В. П., 1978; Хабиров Ф.А., 1991), повышается содержание хлоридов с относительным снижением содержания калия (Brendstrup Я. etai, 1957), накапливаются кинины (Kellenneyer F., 1968). В условиях гипоксии происходит раздражение тучных клеток соединительной ткани, усиливается выделение ими гистамина и, следовательно, повышается проницаемость капилляров. Перицеллюлярные пространства увеличиваются. Тучные клетки выделяют гепарин, нейтрализующий ги-алуронидазу, — накапливаются гиалуроновые кислоты (Drennan Y., 1951). Видимо, существуют различные стадии развития и в самой группе «миогелозов». Нам приходилось наблюдать их переход в плотные образования бугристой консистенции, не поддающиеся разминанию. В таких случаях, наоборот, боли после массажа усиливались, что вполне понятно при обызвествлении очага миогелоза. Возможность перехода миогелоза в оссифицирующий миозит, как нам представляется, говорит в пользу того, что введение гипертонического раствора (видимо, не только натрия, но и кальция) патоло- 74 Ортопедическая неврология. Синдромология
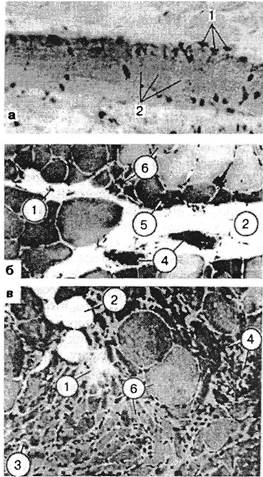
Рис. 3.18. Биоптаты из зон болезненного уплотнения, окраска гематоксилин-эозином: а — лестничная мышца, увеличение количества мышечных ядер (1), расщепление на отдельные диски (2); б и в — икроножная мышца больного остеохондрозом: 1 — участки фиброза перимизия; 2 — жировое замещение; 3 — группы и одиночные атрофированные волокна; 4 — участки воспаления вокруг некротизированных волокон; 5 — группа атрофированных волокон на площади целого фасцикула; 6 — дефицит волокон II типа. гически видоизменяет мышцу, нарушает состояние ее рецепторов и создает в ней триггерные зоны (см. ниже данные об экспериментальном формировании склеротомных болей). Миофиброз, возникающий по тем же причинам, является наиболее частым вариантом завершающей стадии развития дистрофического процесса. Умеренная болезненность возникает при растяжении и меньше — при пальпации мышцы. Прощупываются плотные тяжи продолговатой формы. Тяжистость определяется во всей толще мышцы. Активное расслабление затруднено. Т.к. снижается эластичность, в отдельных случаях несколько ограничивается объем движений. Атрофии и снижения силы нет, т.к. необратимые изменения в одних фибриллах компенсируются гипертрофией других. Возможно осложнение надрывом мышц. В отличие от периартрозов, болезненность тканей незначительна, она возникает не при всех движениях в суставе. При миогелозах M.Lange (I931) находил разрастание соединительной ткани, дегенерацию и разрежение мышечной. G.Glogowski, J.Wollraff(1951) проводили биопсию у 20 больных с миогелозами и выявили восковидную дегенерацию мышечных волокон, их деструкцию, увеличение количества ядер, скопления их, жировую инфильтрацию. Авторы утверждали, что это определенная клинико-морфологическая форма. Различные результаты морфологических исследований определяются, по-видимому, не только выбором участка мышцы для биопсии, не только методикой исследования, но и стадией развития мышечных изменений. В нашей клинике были подвергнуты гистологическому исследованию кусочки девяти передних лестничных мышц больных со скаленус-синдромом. Парафиновые срезы окрашивали гематоксилин-эозином и по ван Гизону (Кипер-вас И.П., Зайцева О.Л., 1967). При пальпации эти мышцы были плотны, болезненны и увеличены. Это подтверждалось и на операционном столе. Как показало гистологическое исследование, среди нормальной мышечной ткани имелись мышечные пучки неравномерной толщины и окраски. Часть их была гипертрофирована, часть — атрофична. Некоторые волокна были набухшими, гомогенными, без поперечной исчерченности, иногда со стертым фибриллярным строением. В ряде волокон, наоборот, миофибриллы были видны отчетливо, но расщеплены по длине с образованием узких щелей между отдельными пучками их. Встречались и волокна с явлениями очагового миолиза, глыбчатого и зернистого распада. В некоторых волокнах определялось поперечное расщепление на отдельные диски с увеличением количества мышечных ядер, в некоторых — вакуольная дистрофия. Дата добавления: 2015-12-16 | Просмотры: 657 | Нарушение авторских прав |