 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
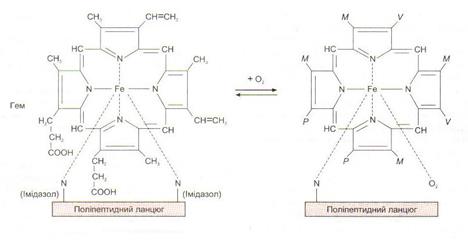
Структура гемоглобінуГемоглобін (Нb) – це червоний пігмент, хромопротеїн, який знаходиться в еритроцитах і переносить кисень. В організмі людини масою 70 кг міститься близько 900 грамів гемоглобіну. В одному еритроциті знаходиться близько 400 млн молекул гемоглобіну (або приблизно 29 пг). Молекулярна маса гемоглобіну – 64 450. Гемоглобін має глобулярну молекулу, утворену чотирма субодиницями. Кожна субодиниця містить гем. Гем – це залізовмісна сполука, похідна порфірину. Молекула гемускладається з 4 пірольнихкілець. У центрі неї розміщений іон Fе2+ .
Дезоксигенований гемоглобін Оксигенований гемоглобін Рисунок 6
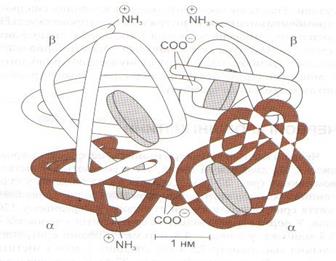
Гем зв’язаний з поліпептидом. Комплекс поліпептидів називають глобіновою частиною молекули гемоглобіну (глобіном). У кожній молекулі гемоглобіну є дві пари поліпептидів (ланцюгів). Кожний ланцюг містить більше 140 амінокислот. Залежно від кількості і послідовності амінокислот розрізняють 4 типи ланцюгів: α, β, γ, Δ (α – 141, β - 146, γ - 146 амінокислот).
Рисунок 7 -Схематичне зображення молекули гемоглобіну А. Показано 2α- і 2β-ланцюги, кожний із яких з’єднаний з гемом. Гем зображено у вигляді дисків
Основні форми і сполуки гемоглобіну
Залежно від виду білкових ланцюгів розрізняють такі форми гемоглобіну в нормі;
При деяких спадкових захворюваннях виникає дефект генів, що кодують α- або β – ланцюги, і синтез Нb порушується. Ці захворювання називають талаcеміями. При α-таласемії порушується синтез α-ланцюгів. Еритроцити нагадують форму мішеней, тому а -таласемію називають мішенеподібною анемією. При β-таласемії порушується синтез β - ланцюгів (хвороба Кулі). До патологічних змін Нb відносять також і порушення первинної структури ланцюгів гемоглобіну. Мутантні гени, які продукують аномальні гемоглобіни, досить поширені. У людей описано багато форм аномальних гемоглобінів. Наприклад, якщо в β- ланцюгу глютамінова кислота заміщується на валін, утворюється патологічний HbS. У відновленому стані його розчинність зменшується в 100 разів, і він випадає в осад. Утворюються кристали, які деформують еритроцит.Він набуває серпоподібної форми, важко проходить через вузькі капіляри і фагоцитується макрофагами. Ця патологія – серпоподібно-клітинна анемія.
Основні фізіологічні сполуки гемоглобіну: 1) НbО2 (оксигемоглобін) - сполука Нb з киснем. Має яскраво-червоний колір, що визначає колір артеріальної крові. Оскільки при взаємодії Нb з О2 окиснення не відбувається і ступінь окиснення заліза не змінюється, реакція називається реакцією оксигенації (неокиснення); 2 ) Нb (відновленийНb або дезокси Нb) - Нb, який віддав кисень. Маєтемно-вишневий колір, що й визначає колір венозної крові. Реакція від'єднання кисню від Нb називається дезоксигенацією; 3) НbСО2 (карбгемоглобін) - сполука Нb з СО2.
Патологічні сполуки Н b: 1) НbСО (карбоксигемоглобін) - сполука Нb з чадним газом (СО). Хімічна спорідненість гемоглобіну до СО у 300 разів вища, ніж до О2. Тому монооксид вуглецю витісняє О2 з гемоглобіну, зменшуючи киснезв’язувальну здатність крові. Навіть незначна кількість СО призводить до суттєвого зростання утворення НbСО. При концентрації СО в повітрі 0,1% - 80% Нb з'єднуєтьсяне з О2, аз СО. При концентрації СО в повітрі 1% через декілька секунд настає смерть. Небезпека полягає в тому, що сполука НbСО є стійкою і Нb вже не може переносити кисень. Слабкі отруєння СО є процесом зворотним, і при диханні свіжим повітрям СО поступово від'єднується. Позитивний ефект дає дихання чистим киснем. За нормальних умов частка НbСО становить 1% від усього Нb. У курців цей показник дорівнює 3%, після глибокої затяжки - 10%; 2) Меt Нb (НbОН - метгемоглобін) - гемоглобін, який містить Fе3+ і має коричневий колір. Окиснення Fе2+ у Fе3+ у гемоглобіні відбувається при взаємодії з сильними окислювачами (КМnО4, анілін, бертолетова сіль), а також при введенні в організм ліків з окисними властивостями. Незначне окислення гемоглобіну до метгемоглобіну відбувається і в нормі. Однак за допомогою ферментних систем еритроцита (зокрема, системи НАДН-метгемоглобінредуктази) метгемоглобін знову перетворюється на гемоглобін. Уроджена відсутність ферментів цієї системи є однією з причин спадкової метгемоглобінемії. За патологічних умов при утворенні метгемоглобіну в організмі циркулює кров з високим вмістом кисню, який, однак, не переходить у тканини.
Кількість гемоглобіну в крові здорової людини дорівнює 140 - 160 г/л -для чоловіків, 120 - 140 г/л - для жінок, 200 г/л - для новонароджених. Визначення вмісту гемоглобіну: 1 Визначення кількості зв’язаного кисню (1г Нb може приєднати 1,34 мл О2). 2 Аналіз рівня заліза в крові (вміст заліза в гемоглобіні становить 0,34%). 3 Колориметрія (порівняння кольору крові з кольором стандартного розчину) – метод Салі. 4 Спектрофотометрія. Перший і другий методи вимагають складної апаратури. третій є неточним. Дуже популярним сьогодні є четвертий метод. Кров змішують з розчином залізосинеродистого калію, ціаністого калію, бікарбонату натрію. Під дією цих речовин еритроцити руйнуються, НЬ перетворюється на ціанметгемоглобін (НbСN). На відміну від Нb НbСN -стабільний, може зберігатися декілька тижнів. Розчин опромінюють монохроматичним світлом з
Важливими показниками, які дозволяють оцінити еритропоез і провести диференціальну діагностику різних видів анемії є такі:
1 Середній вміст гемоглобіну в одному еритроциті (СГЕ) - показник, який характеризує абсолютну кількість Нb в еритроциті. СГЕ = Нb / Э. В нормі СГЕ= 26 – З6 пікограмів. Якщо СГЕ в нормі, еритроцити (і анемію) називають нормохромними. Якщо СГЕ менший за норму, - гіпохромними, Якщо СГЕ більший за норму, - гіперхромними.
2 Кольоровий показник (КП) -показник, який характеризує відносний вміст Нb в 1 еритроциті. КП = Нb / перші три цифри кількості еритроцитів. У нормі КП = 0,85- 1,15. Якщо КП у нормі, еритроцити (і анемія),– нормохромні. Якщо КП менший за норму, - гіпохромні. Якщо КП більший за норму,- гіперхромні.
3 Киснева ємність крові (КЄК) - кількість О2, яка переноситься 1л крові. 1г Hb може зв'язати 1,34 мл О2 – це число Хюфнера. КЄК = ЧХ · Hb (в г/л). Дата добавления: 2015-12-15 | Просмотры: 1357 | Нарушение авторских прав |
 - і 2∆- ланцюги. Становить 5% гемоглобіну дорослої людини.
- і 2∆- ланцюги. Становить 5% гемоглобіну дорослої людини. = 546нм, визначають екстинцію. І за спеціальними калібрувальними шкалами визначають вміст НЬ.
= 546нм, визначають екстинцію. І за спеціальними калібрувальними шкалами визначають вміст НЬ.