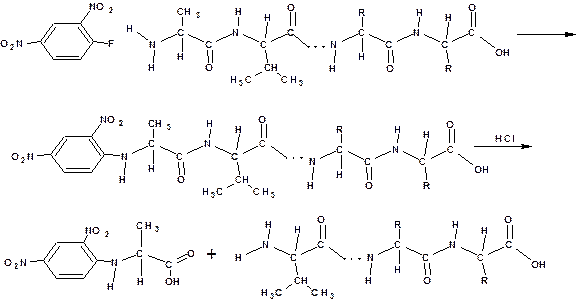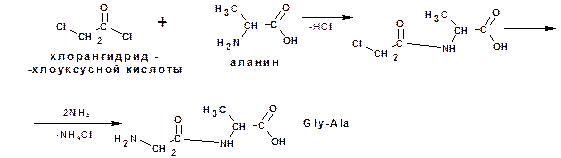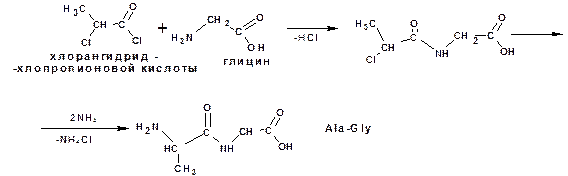|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Определение N-концевой аминокислотыПроводят с использованием 2,4-динитрофторбензола: При взаимодействии 2,4-динитрофторбензола с пептидом фтор нуклеофильно замещается на концевую аминогруппу. Затем пептид подвергают гидролизу. Продукт взаимодействия концевой аминокислоты с 2,4-динитрофторбензолом выделяют и кислоту идентифицируют. В тех случаях, когда 2,4-динитрофторбензол неприменим - используют фенилизотиоцианат.
Определение С-концевой аминокислоты: Для определения С-концевой аминокислоты (со свободным гидроксилом) пептид нагревают с гидразином при 1000С несколько часов. При этом все аминокислоты, кроме концевой, образуют гидразиды:
Аминокислоту, не образовавшую гидразид, выделяют и идентифицируют. Более простой метод заключается в применении фермента карбоксипептидазы, который расщепляет пептидную связь только С-концевой аминокислоты. Ее можно выделить и идентифицировать.
Построение полипептидной цепи проводят по методу Э.Фишера. Метод основан на применении хлорангидридов α-галогензамещеннх кислот. Например, надо получить цепи: Глициналанин (Gly-Ala):
и аланинглицинвалин (Ala-Gly-Val):
Последовательность аминокислот, ковалентно связанных между собой в полипептиде, составляет так называемую первичную структуру белка. Но собственно полипептид белком еще не является. Пептиды неспособны к функционированию. Выполнять какие либо функции в организме способны более сложные системы построенные из нескольких полипептидных цепей, определенным образом связанных друг с другом. Надмолекулярные структуры, сформированные полопептидными цепями, характеризуются вторичной, третичной и четвертичной структурой белка. Вторичная структура обусловлена водородными связями между пептидно не связанными кислородом карбонильной группы и водородом аминной группы. Если карбонил и аминная группа принадлежат разным полипептидным цепям, то такая вторичная структура называется β-структурой. Если карбонил и аминная группа принадлежат одной и той же полипептидной цепи, то такая вторичная структура называется α-структура. Следствием α-структуры является существование полипептидной цепи в форме спирали навитой на циллиндр. Длина одного остатка 1,5 А0, длина шага спирали 5,4 А0. Водородные связи α-спирали образуются между каждой первой и четвертой аминокислотой. Третичная структура белка формируется в результате складывания или свивания нескольких α-спиралей. При этом спирали удерживаются друг около друга за счет образования водородных связей, образованных боковыми амино-, гидрокси- и карбоксильными группами, а также дисульфидными связями и электростатически. Четвертичная структура формируется как агрегат нескольких полипептидных цепей, имеющих вторичную и третичную структуры. Полипептидные цепи удерживаются в четвертичной структуре теми же силами, что и в третичной структуре.
Разрушение первичной вторичной, третичной и четвертичной структуры белка называется денатурацией. Денатурация может быть вызвана термически (нагревание), химически, механически и т. д. При этом денатурация бывает обратимой и необратимой. Необратимой являются денатурация, связанная с разрушением первичной и вторичной структуры. После их разрушения белок самопроизвольно не восстанавливается. Например, гидролиз белков или варка яиц или мяса, взбивание яичного белка. Денатурация третичной и четвертичной структуры является обратимой. После их разрушения белки могут самопроизвольно восстанавливаться с возвращением биологических функций. Например, накручивание волос на бигуди (термическая денатурация) или химическая завивка. Дата добавления: 2015-12-15 | Просмотры: 806 | Нарушение авторских прав |