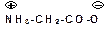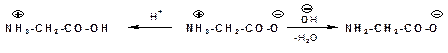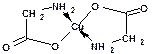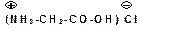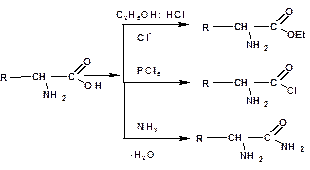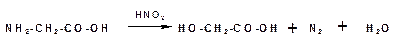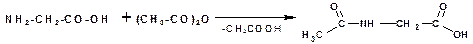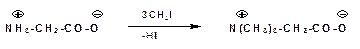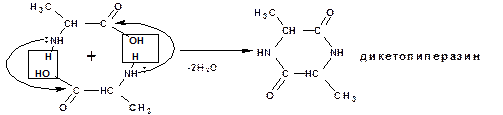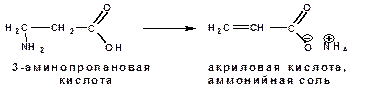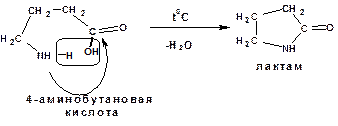|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Химические свойства. Аминокислоты – бесцветные кристаллические вещества с высокими температурами плавления, которые мало отличаются для разных аминокислот и поэтому не характерны
Аминокислоты – бесцветные кристаллические вещества с высокими температурами плавления, которые мало отличаются для разных аминокислот и поэтому не характерны. Плавление сопровождается разложением векщества. Плавление с разложением характерно для солей. Будучи солями аминокислоты хорошо растворимы в воде. Водный раствор аминокислот имеет нейтральную реакцию, что также характерно для солей. Аминокислоты представляют собой так называемые внутренние соли (биполярные ионы):
Такой ион в кислой среде ведет себя как катион, так как подавляется диссоциация карбоксильной группы, а в щелочной среде аминокислота ведет себя как анион:
Значение рH при котором достигается максимальная концентрация биполярного иона – называется изоэлектрической точкой.
Подобно другим соединениям со смешанными функциями, аминокислоты проявляют свойства кислот и аминов. Аминокислоты образуют соли с основаниями. Соли α-аминокислот с тяжелыми металлами могут иметь комплексный характер:
соль имеет интенсивно синее окрашиваание. Аминокислоты образуют соли с неорганическими кислотами:
Подобно другим кислотам, аминокислоты образуют сложные эфиры, хлорангидриды, амиды и т.д:
При действии азотистой кислоты аминокислоты образуют гидроксикислоты:
Аминогруппа в аминокислотах легко ацилируется при действии ангидридов и хлорангидридов кислот:
При алкилировании аминогруппы получаются вторичные и третичные аминокислоты. В избытке галоидного алкила образуются четырехзамещенныеаммонийные основания. Внутренние соли таких оснований называются бетаинами:
Поведение α, β и γ-аминокислот при нагревании: α-аминокислоты межмолекулярно образуют циклические амиды – дикетопиперазины:
β-аминокислоты при нагревании отщепляют молекулу аммиака с образованием α,β-ненасыщенных кислот (аммонийная соль):
γ и δ-аминокислоты при нагревании отщепляют воду и образуют внутримолекулярные циклические амиды – лактамы:
БЕЛКИ Дата добавления: 2015-12-15 | Просмотры: 488 | Нарушение авторских прав |