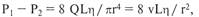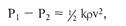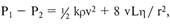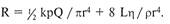|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология
|
В транспорте липидов в организме
Как указывалось выше, основным и
наиболее ярким проявлением ате-
росклероза считается накопление
внутриклеточных липидов, главным
образом холестерина и его эфиров.
Холестерин был первым липидным
компонентом, роль которого в раз-
витии атеросклероза была доказана
Н.Н.Аничковым: «без холестерина
не может быть атеросклероза». По-
этому целесообразно в общих чер-
тах рассмотреть процессы метабо-
лизма холестерина и липопротеи-
дов.
Холестерин выполняет в орга-
низме разнообразные физиологиче-
ские функции. Неэтерифицирован-
ный холестерин вместе с фосфоли-
пидами и белками обеспечивает из-
бирательную проницаемость кле-
точной мембраны, оказывает регу-
лирующее влияние на ее состояние
и на активность связанных с ней
энзимов. Холестерин является ис-
точником образования в организме
желчных кислот, а также стероид-
ных гормонов (половых и кортико-
идных). Продукт окисления холе-
стерина — 7-дегидрохолестерин под
действием ультрафиолетовых лучей
на кожу превращается в витамин
D3.
Биосинтез холестерина осуществ-
ляется в клетках всех органов и тка-
ней. Последовательность реакций,
происходящих в клетке при синтезе
холестерина, можно разделить на 3
основные стадии: I — образование
мевалоновой кислоты из ацил-КоА;
II — образование сквалена из мева-
лоновой кислоты и III — циклиза-
ция сквалена и образование холе-
стерина.
Источником образования мева-
лоновой кислоты является ацетил-
КоА, который в результате ряда
энзиматических реакций образует
(3-гидрокси-р-метилглутарил-КоА.
Этот процесс катализируется гид-
роксиметилглутарил-КоА-редукта-
зой — ферментом, который регули-
рует скорость синтеза холестерина
в клетке. Активность ГМК-КоА-
редуктазы зависит в свою очередь
от действия ряда факторов. Так,
ионизирующая радиация, введение
инсулина и тиреоидных гормонов
усиливают активность, а голода-
ние, глюкагон, глюкокортикоиды,
большие дозы никотиновой кисло-
ты ингибируют активность ГМГ-
КоА-редуктазы. Кроме того, актив-
ность фермента подвержена суточ-
ным колебаниям: максимум ее
приходится на полночь и мини-
мум — на утренние часы. И, нако-
нец, образовавшийся в клетке хо-
лестерин угнетает синтез ГМГ-
КоА-редуктазы. В стенке тонкой
кишки синтез холестерина регули-
руется концентрацией желчных
кислот.
Несмотря на то что любая клет-
ка организма способна к синтезу
собственного холестерина, боль-
шинство периферических клеток
холестерин получает извне. Един-
ственным средством транспорти-
ровки липидов экзогенного (пище-
вых) и эндогенного (синтезирован-
ных в печени и стенке тонкой
кишки) происхождения в крови
являются липопротеиды различных
классов плотности.
Строение липопротеидной части-
цы. Липопротеиды представляют
собой частицы сферической фор-
мы. Они состоят из гидрофобного
ядра, образованного неполярными
липидами — триглицеридами и
эфирами холестерина, и гидрофи-
льной оболочки, представленной
слоем фосфолипидов с вкрапления-
ми свободного холестерина, на по-
верхности которой располага-
ется апопротеин. Поверхностные
(апо-)белки, входящие в состав ли-
попротеидной частицы, выполняют
регуляторную функцию в процессе
метаболизма липопротеидов. По
флотационной способности липо-
протеиды подразделяют на хило-
микроны (ХМ), липопротеиды
очень низкой плотности (ЛПОНП),
липопротеиды низкой плотности
(ЛПНП) и липопротеиды высокой
плотности (ЛПВП).
Первыми частицами, образую-
щимися в процессе всасывания пи-
щевого жира, являются хиломикро-
ны. В стенке кишечника под дейст-
вием холинэстеразы происходит
гидролиз эфиров холестерина до
свободного холестерина и жирных
кислот. Триглицериды гидролизу-
ются панкреатическими и кишеч-
ными липазами и абсорбируются в
виде свободных жирных кислот и
моноглицеридов. Ресинтезирован-
ные в эпителиальных клетках три-
глицериды, фосфолипиды, этери-
фицированный холестерин и апо-
протеины В, A-I, А-II, A-IV соби-
раются внутри цистерн гладкого
эндоплазматического ретикулума в
большие липопротеидные части-
цы — прехиломикроны. Затем в
виде липидных капель они переме-
щаются к аппарату Гольджи, да-
лее — к плазматической мембране,
сливаются с ней и путем экзоцито-
за изливают содержимое в межкле-
точное пространство. Из межкле-
точного пространства пре-ХМ пе-
ремещаются в мезентериальные
лимфатические сосуды, из них — в
грудной лимфатический проток и
далее — в кровяное русло. В крови
происходит взаимодействие пре-
ХМ с ЛПВП, в результате которого
пре-ХМ акцептируют апо-CI, -СИ,
-СIII и апо-Е в обмен на апо-А и
эфиры холестерина. Приобретен-
ные апопротеины контролируют
весь дальнейший метаболизм хило-
микронов. Так, апо-Е обеспечивает
направленный транспорт ХМ в пе-
чень, апо-CI изменяет способность
апо-Е связываться с Е-рецептором
клеток печени, апо-СII активирует,
а апо-СIII ингибирует липопроте-
идлипазу. В капиллярах ХМ взаи-
модействуют с липопротеидлипазой
(ЛПЛ) — ферментом, расположен-
ным на поверхности эндотелиаль-
ных клеток, главным образом жи-
ровой и мышечной ткани. В резуль-
тате воздействия ЛПЛ на хиломик-
роны происходит гидролиз тригли-
церидов с образованием жирных
кислот и глицерина, непропорцио-
нальное уменьшение ядра этих час-
тиц, вследствие чего часть поверх-
ностно расположенных на них ком-
понентов: фосфолипидов, неэтери-
фицированного холестерина и бел-
ков — становится «лишней». Про-
исходит повторное взаимодействие
хиломикронов с ЛПВП, на которые
перемещаются апо-CI, -СII, -СIII,
фосфолипиды и НЭХС в обмен на
эфиры холестерина. Образуются
ремнантные частицы ХМ, апо-Е
которых взаимодействует с Е- или
В/Е-рецептором клеток печени,
обеспечивая элиминацию послед-
них из крови.
Повышение концентрации неэ-
терифицированных жирных кис-
лот, приносимых в клетки печени
в составе ремнантов ХМ или в
комплексе с альбумином, стиму-
лирует образование ЛПОНП.
ЛПОНП образуются в клетках пе-
чени и частично в кишечнике.
Основной поверхностный белок
этих липопротеидов В-100 синте-
зируется в рибосомах шероховатого
ретикулума гепатоцитов. Сборка
ЛПОНП из триглицеридов, эфиров
холестерина и апо-В-100 происхо-
дит в гладком эндоплазматическом
ретикулуме. Насцентные ЛПОНП
через аппарат Гольджи попадают в
секреторные везикулы и экскрети-
руются в пространство Диссе. По-
падая в кровь, ЛПОНП, подобно
ХМ, взаимодействуют с ЛПВП, об-
мениваются с ними поверхностны-
ми белками, превращаясь в зрелые
частицы. В дальнейшем ЛПОНП,
подвергаясь деградации под дейст-
вием липопротеидлипазы и пече-
ночной триглицеридлипазы, взаи-
модействуя с ЛПВП, на которые
перемещаются апо-CI, -СII, -СIII,
а также при помощи липидперено-
сящего белка фосфолипиды, три-
глицериды и НЭХС превращаются
либо в ЛППП, либо в ремнанты
ЛПОНП, которые захватываются
печенью.
Скорость выведения ремнантов
ЛПОНП зависит:
• от изоформы апо-Е, которая
определяет сродство частицы к ре-
цептору. Наибольшая аффинность
к рецептору выявлена у апо-Е4,
наименьшая — у апо-Е2. Варианты
апо-Е4 и апо-Е2 являются продук-
тами разных аллелей одного локуса
и отличаются от апо-ЕЗ типом ами-
нокислотных остатков в положени-
ях 112 и 158 молекулы апо-Е. Фе-
нотип апо-Е2 характерен для лиц с
семейной гиперлипопротеидемией
III типа;
• от активности липолитических
ферментов — ЛПЛ и ПТЛ;
• от активности липидперенося-
щего белка (ЛПБ);
• от активности специфических
рецепторов на поверхности гепато-
цитов и периферических кле-
ток. Основная функция ХМ и
ЛПОНП — транспорт к тканям
триглицеридов, где они использу-
ются в качестве источников энер-
гии или запасаются в виде жира.
ЛППП, продолжая взаимодейст-
вовать с ЛПВП, теряют триглице-
риды, апо-С и апо-Е, трансформи-
руясь в ЛПНП. Основная часть хо-
лестерина плазмы крови содержит-
ся в ЛПНП. Холестерин составляет
около 50 % массы ЛПНП. Липо-
протеиды переносят холестерин в
ткани через высокоаффинные
В/Е-рецепторы. Каждая частица
ЛПНП на своей поверхности со-
держит только одну молекулу
апо-В-100, которая выполняет роль
лиганда к В/Е-рецепторам перифе-
рических клеток.
Транспорт холестерина в составе
ЛПНП в клетку происходит ре-
цепторопосредуемым эндоцитозом.
Один рецептор связывает одну
частицу ЛПНП. Взаимодействие
ЛПНП с рецептором осуществляет-
ся в области специальных образова-
ний мембраны — окаймленных
ямок (coated pits), в которых при
участии мембранного белка клатри-
на концентрируются рецепторы.
После взаимодействия ЛПНП с ре-
цептором окаймленная ямка выпя-
чивается внутрь клетки с образова-
нием окаймленной везикулы, кото-
рая, сливаясь с гладкой везикулой,
образует эндосому. В эндосомах
происходит диссоциация ЛПНП и
рецепторов, рецепторы возвраща-
ются в эндоплазматическую мемб-
рану, а эндосомы с ЛПНП слива-
ются с лизосомами, в которых
ЛПНП подвергаются действию ли-
зосомальных энзимов. Белок ли-
попротеидов расщепляется до ами-
нокислот, эфиры холестерина — до
свободного холестерина и жирных
кислот. Образовавшийся холесте-
рин ингибирует активность гидро-
ксиметилглутарил-КоА-редуктазы,
подавляя, следовательно, биосинтез
собственного холестерина в клетке;
угнетает синтез и экспрессию В/Е-
рецепторов; активирует микросома-
льную ацил-КоА-холестеринацил-
трансферазу (АХАТ), этерифициру-
ющую холестерин, который затем
депонируется в цитоплазме. Депо-
нированный холестерин использу-
ется клеткой для синтеза гормонов
и построения мембран вновь обра-
зующихся клеток.
ЛПВП играют важную роль в
транспорте холестерина из перифе-
рических тканей в печень и в регу-
ляции нормального метаболизма
ХМ и ЛПОНП. ЛПВП образуются
несколькими путями. В гепатоцитах
и энтероцитах синтезируются не-
зрелые ЛПВП (н-ЛВПВ). Эти час-
тицы существенно отличаются от
плазменных ЛПНП: они имеют
форму дисков, обогащены неэтери-
фицированным холестерином и
фосфолипидами, содержат апо-Е и
незначительное количество апо-АI.
В крови н-ЛВПВ насыщаются холе-
стерином из ЛПОНП и ХМ, акцеп-
тируют апо-А белки. Трансформа-
ция «дисков» в сферические части-
цы происходит при участии фер-
мента лецитин-холестеринацил-
трансферазы (ЛХАТ). При действии
ЛХАТ жирно-ацильный радикал из
р-положения лецитина передается
на гидроксильную группу холесте-
рина, находящегося на поверхности
ЛПНП, в результате чего образует-
ся эфир холестерина и лизолеци-
тин. Эфиры холестерина ввиду их
нерастворимости в полярных липи-
дах перемещаются во внутреннюю
гидрофобную зону бислойного дис-
ка, раздвигают фосфолипидные
слои и способствуют формирова-
нию сферической структуры. В хо-
де ЛХАТ-реакции липопротеидная
частица теряет неэтерифицирован-
ный холестерин и лецитин. Изоле-
цитин, соединяясь с альбумином,
уносится током крови. Обедненная
поверхностными липидами частица
ЛПВПЗ становится сильным акцеп-
тором свободного холестерина и ле-
цитина и постоянно ими пополня-
ется. При контакте ЛПВПЗ с плаз-
матической мембраной происходит
переход неэтерифицированного хо-
лестерина с мембраны на ЛПВПЗ.
Кроме того, ЛПВПЗ взаимодейст-
вует со специфическим рецепто-
ром, лигандом к которому служит
апо-AI, в результате чего липопро-
теидные частицы проникают внутрь
клетки, небольшая часть их дегра-
дирует, но большая часть подверга-
ется ретроэндоцитозу. По мере на-
сыщения холестерином ЛПВПЗ
превращаются в ЛПВП2. Холесте-
рин из ЛПВП2 посредством бел-
ка—переносчика эфиров холестери-
на (cholesteryl ester transferring pro-
tein, СЕТР) может переноситься в
ЛПОНП, которые захватываются
печенью. ЛПНП2 также захватыва-
ются печенью. Показано, что холе-
стерин ЛПВП является предпочти-
тельным субстратом для образова-
ния желчных кислот. Установлено
также, что ЛПВП участвуют в пере-
даче холестерина не только пече-
ночным клеткам, но и клеткам сте-
роидогенных тканей, почек, эпите-
лия тонкой кишки, адипоцитам.
Таким образом, становится очевид-
ным, что при нормальном функци-
онировании липопротеидов невоз-
можно накопление эфиров холесте-
рина клетками, которое происходит
при атеросклерозе.
1.3.4. Роль липопротеидов
низкой плотности в накоплении
внутриклеточных липидов
Из описанных путей метаболизма
липидов в организме человека сле-
дует, что основным источником
поступления холестерина в клетки
сосудистой стенки являются ли-
попротеиды низкой плотности.
Долгое время считалось, что высо-
кое содержание ЛПНП в плазме
крови связано с ускоренным раз-
витием атеросклероза. При гомози-
готной форме семейной гиперхоле-
стеринемии (гиперлипопротеине-
мии II типа по Frederickson) атеро-
склеротические поражения сосудов
появляются, прогрессируют и при-
водят к преждевременной смерти в
течение первого десятилетия жиз-
ни. Эти данные позволили предпо-
ложить, что существует альтерна-
тивный механизм поступления хо-
лестерина в клетки сосудистой
стенки, отличный от В/Е-рецепто-
ра. Гипотетический альтернатив-
ный путь получил название ске-
венджер-рецептора (Scavenger cell
receptor). Функционирование ске-
венджер-рецептора было описано
Goldstein и соавт. в 1979 г. Скевен-
джер-рецептор опосредовал эндо-
цитоз модифицированных in vitro
ЛПНП, захват и интернализация
которых приводили к массивному
отложению эфиров холестерина в
культивируемых клетках. Этот путь
характеризовался высокой аффин-
ностью и крайне низкой насыщае-
мостью. Нативные ЛПНП не узна-
вались скевенджер-рецептором и
не конкурировали за места связы-
вания. Такая рецепторная актив-
ность была впоследствии обнару-
жена у моноцитов крови человека
и макрофагов, в том числе и у бо-
льных с гомозиготной формой ги-
перхолестеринемии, у эндотелиаль-
ных клеток быка, у пенистых кле-
ток, выделенных из эксплантатов
аорты кроликов с холестеринин-
дуцируемым атеросклерозом. В
1985 г. скевенджер-рецептор был
выделен из мышиных линейных
макрофагов P338D1 и идентифи-
цирован как гликопротеин с мол.
массой 260 кДа. Активность ске-
венджер-рецептора в отличие от
ЛПНП-рецептора не регулируется
содержанием внутриклеточного хо-
лестерина. Поэтому постоян-
ный эндоцитоз модифицирован-
ных ЛПНП через скевенджер-ре-
цептор на макрофагах приводит к
образованию больших внутрикле-
точных отложений. Однако неко-
торые типы химически модифици-
рованных ЛПНП, например мети-
лированные, вызывая внутрикле-
точное накопление холестерина, не
конкурировали с ацетилированны-
ми ЛПНП за скевенджер-рецептор,
что позволило предположить суще-
ствование путей захвата модифи-
цированных ЛПНП, отличных как
от В/Е-рецептора, так и от скевен-
джер-рецептора.
В 1989 г. из сыворотки крови бо-
льных с документированным атеро-
склерозом коронарных артерий
были выделены атерогенные
ЛПНП, способные в культуре глад-
комышечных клеток аорты челове-
ка вызывать накопление липидов.
Выяснилось, что ЛПНП больных и
здоровых не имеют существенных
различий в содержании апо-В, сво-
бодного и этерифицированного хо-
лестерина, триглицеридов и фосфо-
липидов. Кроме того, не отмеча-
лось различий в содержании про-
дуктов перекисного окисления ли-
пидов. Атерогенные и неатероген-
ные ЛПНП существенно различа-
лись по содержанию сиаловой кис-
лоты. Уровень сиаловой кислоты в
ЛПНП больных ИБС по сравнению
с ЛПНП здоровых лиц оказался в
2—4 раза ниже. Более того, отмеча-
лась обратная корреляция между
содержанием сиаловой кислоты в
ЛПНП и их атерогенным действи-
ем.
Сиаловая кислота является од-
ним из углеводов, входящих в со-
став нативных ЛПНП, и, как пред-
полагают, играет роль в метаболиз-
ме и функции ЛПНП. Аполипоп-
ротеин В (апо-В100) ЛПНП явля-
ется гликопротеидом и имеет два
типа полисахаридных цепей, свя-
занных с аспарагиновыми остатка-
ми молекулы белка N-гликозидной
связью: олигоманнозидные и сиа-
ловые биантенные. При этом сиа-
ловая кислота содержится в цепях
второго типа, где она является тер-
минальным сахаром. Установлено,
что в молекуле апо-В содержится
14—16 полисахаридных групп, 9—
10 из них являются сиалированны-
ми биантенными цепями. Встреча-
ющиеся в составе ЛПНП глико-
сфинголипиды также содержат тер-
минальную сиаловую кислоту.
В результате каких-то пока не изу-
ченных процессов аполипопротеин
ЛПНП теряет терминальную сиа-
ловую кислоту, десиалируется. Это
приводит к последующей множест-
венной модификации ЛПНП. Де-
сиалированные, множественно-мо-
дифицированные, циркулирующие
ЛПНП теряют сродство к В/Е-ре-
цептору клеток и приобретают
способность взаимодействовать со
скевенджер-рецептором, асиало-
гликопротеид-рецептором, с кле-
точными протеогликанами. Моди-
фицированные ЛПНП в отличие
от нативных ЛПНП способны
спонтанно агрегировать, образовы-
вать иммунные комплексы и ассо-
циаты с компонентами соедините-
льнотканного матрикса: протеогли-
канами, коллагеном, эластином.
Такие крупные ЛПНП-содержащие
комплексы захватываются клетка-
ми путем фагоцитоза. Усиленный
захват клетками модифицирован-
ных ЛПНП, низкая скорость их
деградации и гидролиза эфиров хо-
лестерина, а также стимуляция эте-
рификации свободного холестери-
на являются причинами внутри-
клеточного накопления эфиров хо-
лестерина, образующих липидные
включения, характерные для атеро-
склеротических клеток. Следова-
тельно, ключевым моментом в раз-
витии атеросклероза считается по-
явление в крови циркулирую-
щих множественно-модифициро-
ванных липопротеидов низкой
плотности.
Диагноз. По классификации
А.Л.Мясникова, различают два пе-
риода развития заболевания: нача-
льный (доклинический) и период
клинических проявлений, который
в свою очередь проходит 3 ста-
дии — ишемическую, тромбонекро-
тическую и склеротическую. Одна-
ко часто манифестация болезни
происходит в тромбонекротической
стадии, приводя пациентов к ин-
валидности, а нередко к смерти.
Диагноз атеросклероза может быть
поставлен только на основании за-
ключения ангиографии: ультразву-
ковой, рентгеноконтрастной, маг-
нитно-резонансной. Эти методы
исследования имеют свои ограни-
чения. Так, УЗ-ангиография не по-
зволяет визуализировать большую
часть сосудов коронарного бассей-
на, сосудов интракраниального от-
дела брахиоцефальной системы.
Применение рентгеноконтрастной
ангиографии ограничено в силу
того, что она является инвазивным
методом исследования. МР-ангио-
графия требует оснащения лечебно-
го учреждения весьма дорогостоя-
щим оборудованием. Именно по-
этому диагноз атеросклероза в на-
стоящее время ставят на основании
выявления ишемии, гиперхолесте-
ринемии, наличия у пациентов
факторов риска атеросклероза, что
не совсем правильно.
1.4. Гемодинамика и реология сосудистых
поражений: применение в диагностике и лечении
Хирург, который стоит перед проб-
лемой заболевания сосудов, должен
основывать свои решения на комп-
лексной оценке гемодинамических
и реологических факторов.
Нормальный кровоток. Основные
потери энергии крови при ее дви-
жении, выражающиеся в возникаю-
щем градиенте давления, связаны с
вязкостью и скоростью.
При наличии прямой, ригидной
цилиндрической трубки с постоян-
ным ламинарным током жидкости
вязкость ответственна за все энер-
гетические потери. Уравнение Пуа-
зейля определяет взаимоотноше-
ния между градиентом давле-
ния (энергии) и током жидкости
при вышеназванных строгих усло-
виях:
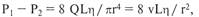
где P1 — давление на входе; Р2 —
давление на выходе; О — объемный
кровоток, равный Vпr2; L — длина,
n — коэффициент вязкости в пуа-
зах; r — радиус просвета сосуда.
Это равенство утверждает, что
при постоянном кровотоке гради-
ент давления прямо пропорциона-
лен длине сегмента и вязкости кро-
ви и обратно пропорционален чет-
вертой степени радиуса сегмента.
Среди многих факторов, определя-
ющих вязкость крови, гематокрит
является важнейшим; при цифрах,
равных 50 %, вязкость крови повы-
шается вдвое по сравнению с тако-
вой при гематокрите 35 %. Таким
образом, в ситуациях, когда преоб-
ладает ламинарный ток крови, ге-
матокрит может оказывать значи-
тельный эффект на градиент давле-
ния или кровоток.
Реальные условия движения кро-
ви далеки от описанных выше, по-
этому всякий раз, когда меняется
направление движения, возникают
дополнительные потери энергии
крови. Это происходит при любом
изгибе сосуда, его раздвоении или
ответвлении и всегда — при его су-
жении или расширении. С каждой
систолой сердца поток крови уско-
ряется и замедляется, вплоть до
движения в обратном направлении
во время диастолы, движется к
стенкам сосуда при его расшире-
нии и обратно — при сужении его
просвета. Инерционные потери
пропорциональны плотности кро-
ви и квадрату изменений ее скоро-
сти:
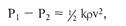
где к — постоянная; р — плотность
крови; v — скорость движения кро-
ви.
Во многих ситуациях инерцион-
ные потери даже больше, чем поте-
ри, связанные с вязкостью крови.
Относительные вклады вязкости
и инерционных потерь в кровоток
варьируют в значительных преде-
лах, поэтому очевидно, что невоз-
можно охарактеризовать кровоток с
помощью простой формулы даже
при нормальных условиях. Тем не
менее можно выразить общую кон-
цепцию вклада этих величин фор-
мулой:
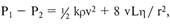
в которой сохраняются все выше-
приведенные обозначения.
В связи с тем что сопротивление
(R) крови в сегменте сосуда — это
отношение градиента давления и
кровотока через сегмент (AP/Q), а
v=Q/pr2, сопротивление обратно
пропорционально четвертой степе-
ни радиуса:
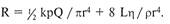
В этой формуле сохраняются все
вышеприведенные обозначения.
Формула также отражает тот факт,
что сопротивление не является по-
стоянной величиной и возрастает с
увеличением кровотока. Таким об-
разом, сопротивление участка сосу-
да может быть определено только
при точно известных объеме крово-
тока, частоте пульса и других фак-
торах, однако минимально возмож-
ное сопротивление можно вычис-
лить, основываясь на законе Пуа-
зейля, хотя следует понимать, что
истинное сопротивление всегда бу-
дет выше, чем рассчитанное мини-
мальное.
Дата добавления: 2015-02-06 | Просмотры: 1115 | Нарушение авторских прав
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|