|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
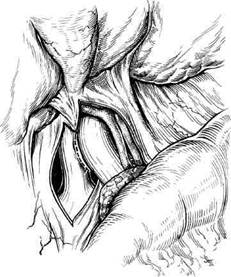
Лечение. Хирургическое лечение портальной гипертензиинаправлено прежде всего на предупреждение или устранение кровотеченияХирургическое лечение портальной гипертензии направлено прежде всего на предупреждение или устранение кровотечения. Поскольку причинами кровотечения являются портальная гипертензия и связанная с этим перегрузка коллатеральных сосудистых русел, логично проводить хирургическое вмешательство, которое снижает портальное давление и снимает лишний груз с коллатера-лей. Все иные вмешательства палиа-тивны и не способны предупредить развитие кровотечения. Максимальный лечебный эффект может быть достигнут на грани минимально необходимого для предупреждения геморрагических осложнений уровня декомпрессии портальной системы, с одной стороны, и потенциальной угрозы нарушения функции печени вследствие обеднения печеночного кровотока — с другой. Многие хирургические вмешательства при портальной гипертензии не выдержали проверку временем и представляют в настоящее время лишь исторический интерес. Более устойчивые позиции в современной хирургии имеют операции портосис-темного шунтирования. Искусственные сосудистые межсистемные анастомозы по своему гемодинамическо-му влиянию могут быть разделены на неселективные (без сохранения гепа-топетального кровотока) и селектив- ные (с сохраненным гепатопеталь-ным кровотоком) [Sutton, 1994]. К первой группе относятся анастомозы между воротной и нижней полой веной по способу конец в бок, бок в бок, два конца в бок, между верхней брыжеечной и нижней полой венами, между селезеночной и левой почечной венами с удалением селезенки, Н-образный спленоре-нальный шунт. Ко второй группе относят операции дистального сплено-ренального шунтирования. Много дискуссий ведется по вопросу о том, какой из названных видов анастомозов наиболее полезен. Недостатком прямых портосистемных шунтов является то, что при этом отводится от печени вся кровь, несомая портальной системой, чем усугубляется портальная энцефалопатия. Кроме того, выяснилось, что при тяжелом циррозе печени посткапиллярная блокада в печени может быть такой значительной, что часть крови, поступающая через печеночную артерию, покидает печень через воротную вену. Наложение прямого анастомоза и значительная декомпрессия портальной системы отводят от печени артериальную кровь, что способствует усилению некроза печеночных клеток, тем самым усугубляя течение цирроза. В какой-то степени последнее может быть предотвращено артериализацией культи воротной вены, чем улучшается ок-сигенация, обмен веществ и гемодинамика печени [Matzander, Kummer-le, 1972]. В то же время чрезмерно высокое давление, не характерное для воротной вены, отрицательно влияет на внутрипеченочное портальное русло, вызывая фиброз и лимфоцитар-ную инфильтрацию мелких ветвей воротной вены. Прямые портокавальные шунты затрудняют в последующем трансплантацию печени [Лебезев В.М., 1994]. Их наложение показано в настоящее время на начальных стадиях первичного билиарного цирроза, при врожденном фиброзе печени с сохраненной функцией гепатоцитов, а также при обструкции воротной вены в области ворот печени. Оперативное вмешательство производят через правосторонний тора-коабдоминальный или поперечный разрез. При этом больному приподнимают правый бок под углом 30° и под поясницу подкладывают валик. При достаточном опыте возможно применение обычной лапаротомии, которая может быть дополнена пересечением реберной дуги и межребе-рья. Печень приподнимают кверху, затем в элементах печеночно-две-надцатиперстной связки обнаруживают воротную вену, справа от которой вскрывается брюшина. Также рассекается париетальная брюшина над нижней полой веной. С помощью препаровки мобилизуют воротную и нижнюю полую вены (рис. 10.15). При наложении анастомоза бок в бок с помощью зажима Сатинского захватывают необходимую часть сосудов, затем вырезают овальные отверстия длиной 1—1,5 см. Непрерывным циркулярным швом монофильной нитью № 5,0 или 6,0 накладывается анастомо: При формировании соустья по типу конец в бок портальную вену пересекают после наложения зажима как можно ближе к воротам печени (рис. 10.16). Печеночный конец перевязывается, а свободный используют для наложения анастомоза.
Рис. 10.15. Портосистемное шунтирование. Наложен анастомоз бок в бок между нижней полой и воротной венами. При этом отверстие в нижней полой вене формируют таким образом, чтобы избежать перегибов воротной вены и завихрений крови.
Рис. 10.16. Портосистемное шунтирование. Анастомоз конец в бок соединяет воротную вену с нижней полой веной. Портальная вена в воротах печени перевязана.
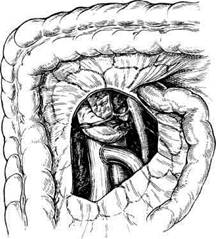
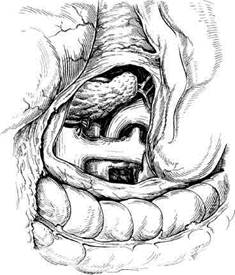
Рис. 10.17. Дистальное спленоренальное шунтирование. Анастомоз бок в бок наложен между дис-тальным отделом селезеночной вены и левой почечной веной. Селезеночная вена прошита и пересечена в проксимальном отделе. В последние годы предпочтение отдается парциальным Н-образным анастомозам и в большей степени операциям дистального спленоренально-го шунтирования [Плеханов А.Н., 1996]. Они обеспечивают адекватную декомпрессию воротной системы, в меньшей степени влияя на естественную циркуляцию крови. Послеоперационная энцефалопатия при селективном анастомозе наступает в 3 раза реже, чем при неселективном: 27 и 75 % соответственно [Mil-lucan W. et al., 1985]. Технически наложение подобных анастомозов сложнее, к тому же они создают наиболее узкое сообщение между двумя венозными системами, поэтому склонны к тромбозу. В связи с этим их рекомендуется накладывать только в тех случаях, если селезночная вена имеет достаточные размеры. Хирургическое вмешательство выполняют посредством верхнесрединной или верхнепоперечной лапа-ротомии. Производят мобилизацию желудочно-кишечной связки, затем препаровкой по нижнему краю поджелудочной железы выделяют селезеночную вену на протяжении 5—6 см. Тупым и острым путем вскрывают за-брюшинную клетчатку, ориентируясь по нижнему краю хвоста подже- лудочной железы. Выделяют левую почечную вену. Селезеночную вену пересекают, проксимальный конец перевязывают, а дистальный используют для создания соустья. В почечной вене формируют отверстие соответственно диаметру селезеночной вены и накладывают анастомоз по типу конец в бок (рис. 10.17; 10.18). Если наложить шунт без натяжения не удается, используют аутовену (наиболее близка по диаметру яремная вена) либо синтетический протез. Применение оптимального по диаметру протеза, изготовленного из по-литетрафлюороэтилена, значительно снижает риск стеноза или окклюзии портосистемного селективного шунта [Collins, 1994]. У детей возможно использование для создания соустья вены левого надпочечника [Mazarie-gos G.V. et al., 1998]. При тщательном отборе больных результаты операции можно считать удовлетворительными: летальность составляет 7 %, частота энцефалопатии — 8 %, рецидивов — 5 % [Мег-cado et al., 1995]. Хирургические вмешательства, направленные на уменьшение притока крови в портальное русло, в последнее время отходят на задний план, поскольку сопряжены с рядом отри- дательных моментов. Опыт показывает, что перевязка общей печеночной, селезеночной артерий или чревного ствола, уменьшающая поступление крови в воротную вену на 20— 40 %, не способна компенсировать препятствие, находящееся на пути оттекающей оттуда крови. Через короткое время вновь развивается портальная гипертензия и неминуемо наступает кровотечение. Спленэкто-мия, кроме того, способствует тромбозу селезеночной, а иногда и воротной вены, в результате чего теряется возможность наложения портока-вального или спленоренального анастомозов. Прогноз постспленэк-томического кровотечения еще более неблагоприятен. Удаление селезенки в настоящее время предпринимают в случае так называемой левосторонней парциальной портальной гипер-тензии, которая развивается не более чем в 1,7 % случаев [Чалый А.Н., 1997], но возникающие при этом варикозные вены пищевода и кровотечение из них не менее опасны, чем при других формах портальной ги-пертензии. Спленэктомия находит место в качестве сочетанной операции наложения портосистемного шунта, особенно если имеет место гипер-спленизм, предрасполагающий к кровотечениям. В то же время выполнение подобных операций приводит к большему числу осложнений в послеоперационном периоде [Ерами-шанцев А.К., 1997]. Новым прогрессивным направлением в лечении больных с портальной гипертензией является эндоваску-лярная хирургия. Лечебные эндовас-кулярные вмешательства являются прототипами соответствующих хирургических операций, но в отличие от них обладают минимальной трав-матичностью, органосохранностью и патогенетической направленностью и могут быть методом выбора в тех случаях, когда операция необходима, но выполнить ее невозможно или она сопряжена с высокой степенью риска [Девятов А.В., 1988; Гончаров М.Ю.,
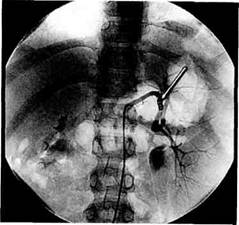
Рис. 10.18. Дистальное спленоренальное шунтирование. Наложен анастомоз конец в бок между селезеночной и левой почечной веной. 1996]. Подобная ситуация часто возникает при лечении больных в стадии декомпенсации заболевания и при развитии таких тяжелых осложнений, как профузное пищеводное кровотечение, асцит и острая печеночная недостаточность. Эмболизация селезеночной артерии впервые выполнена F.E.Maddi-son в 1973 г. Данная методика не только корригирует гиперспленизм, но и обеспечивает достаточную декомпрессию портальной системы [Мосягин В.Б., 1995; Черкасов В.А., 1995]. При этом катетер после анги-ографического исследования и определения показаний к вмешательству (расширенная селезеночная артерия, увеличенная селезенка, признаки ги-перспленизма) устанавливается в селезеночную артерию и через него в сосуд вводится искусственный эмбол с целью редукции кровотока. Учитывая отрицательные стороны острой окклюзии селезеночной артерии, следует использовать методику постепенной хронической эмболизации
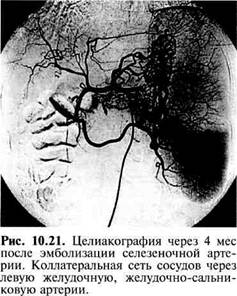
Рис. 10.19. Эмболизация селезеночной артерии. Стрелка указывает на металлическую спираль в дистальном отделе артерии. с помощью металлических спиралей конусовидной формы. При таком способе, по данным А.В.Девятова (1988), значительно реже наступают инфарцирование и абсцедирование селезенки (рис. 10.19; 10.20). Изучение отдаленных результатов эмболизации селезеночной артерии в нашей клинике показывает развитие гепатоартериализующего эффекта (47 %), реканализации (14 %), возникновение различных артериальных перетоков к селезенке через коллатерали (39 %). Чаще возникают перетоки через левую желудочную артерию (31,3 %), левую желудочную и желудочно-сальниковую артерии (28,1 %) и только желудочно-сальниковую артерию (25 %), реже — через левую желудочную, желудочно-сальниковую и панкреатические артерии (3,1 %), левую желудочную, желудочно-сальниковую и правую желудочную артерию (3,1 %). Развитие коллатеральной сети наблюдается, как правило, к 4—6 мес после вмешательства. При этом эффект эмболизации снижается (рис. 10.21; 10.22). В этом случае необходимо выполнение эмболизации соответствующих артерий, участвующих в перетоке крови к селезенке. Среди них наиболее значимым считается переток через левую желудочную артерию, который не только снижает эффект эмболизации селезеночной артерии, но и представляет угрозу возникновения пищеводного кровотечения в связи с резким усилением притока крови в кардиоэзофагеаль-ную зону. Хроническая эмболизация селезеночной артерии находит применение у больных с синдромом Бадда—Киа-ри. При этом, несмотря на сохраняющееся нарушение оттока крови из печеночных вен, клинические и субъективные показатели состояния
Рис. 10.20. Гемодинами-ческие изменения в бассейне чревного ствола после эмболизации селезеночной артерии. больных значительно улучшаются [Ким В.Ф., 1988]. Для восстановления кровотока у больных с мембранозным сужением нижней полой вены, а также при обструкции печеночных вен возможно применение чрескожной баллонной ангиопластики [Zajko A. et al., 1989]. Как правило, производят многократные дилатации [Martin L. et al., 1990], после которых устанавливают металлический стент [Verbrux A. et al., 1994]. K.I.Wiechel (1971) разработал методику чрескожной чреспеченочной катетеризации воротной вены путем пункции печени через восьмое—девятое межреберье по правой подмышечной линии, затем A.Lunderquist (1974) применил данный способ для облитерации варикозно-расширенных вен пищевода и желудка у больных с портальной гипертензией, создав оригинальные инструменты для этого вмешательства. Методика состоит из проведения целиакографии для выявления топографоанатомичес-ких особенностей воротной вены и ее ветвей, а также состояния печени, чрескожной чреспеченочной пункции и катетеризации воротной вены, селективного исследования ее притоков, портоманометрии, портогра-фии, лечебных процедур, удаления катетера и обтурации пункционного канала в печени. В первую очередь необходимо произвести эмболиза-цию мелких коротких желудочных вен применением гемостатической губки, тромбовара, тефлонового велюра, спирта на 40 % глюкозе, ауто-гемосгустка. Только после этого выполняют эмболизацию левой желудочной вены. Вначале вводят жидкие эмболизирующие средства, затем металлическую спираль и гемостати-ческую губку. Как показывают результаты применения данной методики в нашей клинике, в отдаленные сроки после эмболизации ВРВ пищевода и кар-дии имеется положительная тенденция перехода гепатофугального кро-
вотока в гепатопетальный, возникают менее опасные пути портокавально-го шунтирования: через нижнюю брыжеечную вену — в 66,7 %, пупочную вену — в 25 %, воротно-печеночные шунты — в 8,3 %. Результаты оказа-
Рис. 10.22. Целиакография. Эмболиза-ция артериальных перетоков, участвующих в кровоснабжении селезенки после окклюзии селезеночной артерии.
34 - 4886
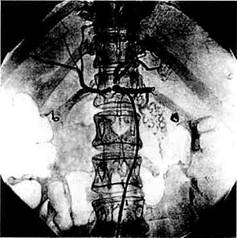
Рис. 10.23. Гемодинами-ческие изменения в портальной системе после эмболизации варикозных вен пищевода и желудка. 1 — гастроэзофагеальный путь шунтирования; 2 — шунтирование через пупочную вену; 3 — отток по нижней брыжеечной вене и венам прямой кишки. лись лучше в группе больных, которым производилась сочетанная эмбо-лизация варикозных вен пищевода и селезеночной артерии (рис. 10.23). Значительный уровень серьезных осложнений долгое время служил сдерживающим моментом широкому распространению чреспеченочных эндоваскулярных вмешательств в лечении портальной гипертензии, особенно при наличии противопоказаний к чреспеченочной пункции: тромбо-цитопения ниже 50,0 • 10/л, наличие объемных образований по ходу пункции, интерпозиция кишечника.
Рис. 10.24. Трансюгулярное внутрипече-ночное шунтирование. Между правой печеночной веной и воротной веной установлен расправляющийся стент. В связи с этим в последние годы все более широкое применение находят чреспеченочные вмешательства, выполняемые из трансюгулярного доступа (рис. 10.24). Методика была предложена в 1967 г. W.Hanafee и M.Weiner для холангиографии, затем использована J.Rosch в 1969 г. для портографии и наложения портока-вального соустья с помощью баллонного катетера Gruntzig. В 1976 г. M.I.Goldman [Goldman M. et al, 1976] использовал трансюгулярный доступ для эмболизации варикозных вен пищевода. Появление расправляющихся металлических стентов позволило создавать сообщение между печеночной и воротной веной диаметром 8—12 мм [Zemel G. et al., 1991]. При достаточном опыте персонала его удается наложить в 95 % случаев [Rossle M. et al, 1994]. Диаметр шунта подбирают таким образом, чтобы градиент портального давления оказался ниже 12 мм рт.ст. Летальность при установлении стента составляет менее 1 %, в течение 30 сут — от 3 [Rossle M. et al., 1994] до 13 % [La Berge J. et al., 1995]. Среди отрицательных моментов данной методики следует отметить раннюю окклюзию стента, которая наблюдается в 12 % случаев и обычно связана с низким градиентом давления между воротной и печеночной венами и развитием тромбоза. Этому способс- твуют технические трудности при установке шунта [Helton W. et al., 1993]. Частота развития энцефалопатии после установки трансюгулярного портосистемного стента составляет от 25 до 30 % и соответствует хирургическому портокавальному шунтированию [Sanyal A. et al, 1994]. Риск развития печеночной энцефалопатии возрастает у больных с декомпенсированным циррозом и зависит от возраста больного и диаметра стента [Riggio О. et al., 1996]. Гипердинамический тип кровообращения, свойственный циррозу, после транспеченочного шунтирования усугубляется. У больных с сопутствующей патологией сердца возможно развитие сердечной недостаточности [Azoulay D. et al, 1994]. Классификация больных с циррозом печени по тяжести их состояния
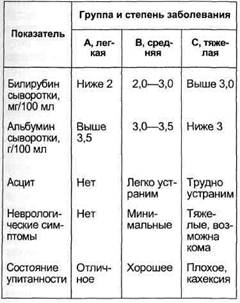
Таким образом, результаты применения эндоваскулярных вмешательств в полной мере позволяют считать их альтернативой хирургическому лечению больных с портальной гипер- тензией, особенно при ее декомпен-сированных формах. Опыт применения хирургических и эндоваскулярных вмешательств показывает, что прогноз при портальной гипертензии зависит не только и не в первую очередь от выбора способа лечения, а прежде всего от состояния печени, от "ее функциональных запасов", что в конечном счете и определяет исход у оперированных больных. С точки зрения прогноза больных обычно делят по тяжести состояния на три группы (классификация Child). У больных, относящихся к группе А, прогноз хороший, они переносят большую сложную операцию, смертность в этой группе ниже 10 %. У больных группы С ожидаемая продолжительность жизни составляет несколько месяцев и операционная смертность выше 50 %. Группа В занимает в этом отношении среднее положение между двумя названными группами. У больных старше 40 лет выживаемость после операций ниже и в 2 раза повышается частота развития энцефалопатии. Определенные надежды в этом плане можно возложить на адекватную предоперационную подготовку, которая в некоторой степени может улучшить состояние больных. В интересах этого — если, конечно, речь не идет об экстренной операции — нужно провести коррекцию всегда имеющихся больших или меньших расстройств обмена веществ. Богатая белками, калорийная диета с малым количеством соли, устранение видимых и скрытых отеков, повторные введения альбумина, терапия, направленная на защиту печеночных клеток, способны значительно улучшить результаты оперативного лечения больных с портальной гипертензией. Вопрос о возможности трансплантации печени следует рассматривать у всех больных с терминальной стадией цирроза печени. Отбор больных на операцию особенно затруднен вследствие недостатка доноров. По-
34* казанием к трансплантации считают увеличение протромбинового времени боле чем на 5 с, снижение уровня альбумина менее чем 30 г/л и резистентный к терапии асцит. Наличие портальной гипертензии, небольшие размеры печени приводят к большой кровопотере, что повышает риск операции. Годичная выживаемость после плановой трансплантации печени у больных группы низкого риска составляет 90 % [Starzl Т. et al, 1989]. Дата добавления: 2015-02-06 | Просмотры: 969 | Нарушение авторских прав |