|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Опухоли сосудовНовообразования мягких тканей представляют еще малоизученный раздел онкологии. Особенно это относится к сосудистым опухолям: достаточно сказать, что в 28—32 % случаев гистогенез злокачественных сосудистых опухолей мягких тканей остается невыясненным. Это объясняется, во-первых, противоречивыми представлениями об источнике роста, что в свою очередь связано с отсутствием единого понимания о развитии и регенерации сосудов; во-вторых, разнообразием морфологических вариантов сосудистых опухолей; в-третьих, нечеткими классификацией и терминологией. Согласно данным литературы, источником роста сосудистых опухолей могут быть все элементы сосудистой стенки: эндотелий, мышечные клетки, перициты, гломусные клетки, ангио-бласты сосудистой мезенхимы. Сосудистые опухоли относятся к внеор-ганным опухолям мягких тканей из производных мезенхимы. Такое выделение целесообразно в связи с многообразием видов этих опухолей, трудностью их дифференциальной диагностики, разработкой рациональных методик обнаружения и тактикой лечения. Термином "мягкие ткани" обозначают ткани, которые покрывают скелет и заполняют забрюшин-ное пространство, средостение и орбиту. Объединение в группу опухолей мягких тканей скорее основано на анатомо-топографических признаках, чем на общности их гистогенеза. Злокачественные опухоли мягких тканей являются сравнительно редкой формой и составляют всего 0,8—2,6 % от числа всех новообразований человека. Вероятно, это связано с низкими регенеративными и пролиферативны-ми потенциями мезенхимы. Злокачественные образования мягких тканей нередко именуют саркомами. Этот термин удобен, краток и четко отличается от термина "рак", который относится ко всем опухолям эпителиального происхождения. Хотя, по мнению некоторых морфологов, он не совсем точен, им широко пользуются в литературе. Вместе с тем ряд авторов избегают термина "ангиосаркома" и считают, что под злокачественными опухолями сосудистой ткани следует понимать ряд новообразований, обозначаемых различными терминами — в зависимости от источника роста. Учитывая, что степень клеточной аплазии в некоторых злокачественных опухолях сосудистого происхождения бывает настолько выраженной, что подчас трудно, а иногда невозможно определить источник роста, их определяют как "недифференцированная саркома, богатая сосудами". Следует отметить, что до настоящего времени не удается провести четкой границы между группой злокачественных и доброкачественных сосудистых опухолей, так как существуют формы пограничные, полузло- качественные (ангиолейомиома про-лиферирующая, ангиоперицитома, дифференцированная), которые, обладая местным инфильтрирующим ростом, отличаются высокими потенциями к рецидивам, в то же время крайне редко дают метастазы. В этом отношении сосудистые опухоли представляют значительные трудности для клиницистов и морфологов, так как даже при явно зрелом доброкачественном строении они способны повторно давать местные рецидивы, что является одним из признаков злокачественности. Зрелые доброкачественные сосудистые опухоли — гемангиомы и лимфангиомы были известны очень давно как самые частые формы опухолей раннего детского возраста. Детально изучать злокачественные опухоли сосудистого генеза начали сравнительно недавно. В 1942—1943 гг. известный американский патолог A. Stout описал два типа злокачественных сосудистых опухолей: геман-гиоэндотелиому, исходящую из эндотелия сосудистой стенки, и геман-гиоперицитому — из перицитов адвентициального слоя. В целом частота ангиосарком невелика, однако они занимают по частоте 2-е место среди всех сарком мягких тканей (12,0—20,1 % случаев). Вопросам классификации и терминологии опухолей мягких тканей придается большое значение. Среди ряда классификаций, не лишенных недостатков, в настоящее время используется классификация Международного противоракового союза, построенная по гистогенетическому принципу. Согласно этой классификации, сосудистые опухоли подразделяют на капиллярную гемангиому, кавернозную гемангиому, артериальную гемангиому, лимфангиому, ге-мангиоперицитому, злокачественную гемангиоэндотелиому, злокачественную гемангиоперицитому и геморрагическую саркому (Капоши). Половой предрасположенности к развитию сосудистых опухолей не 31 - 4886 наблюдается, хотя некоторые авторы (А.И.Раков) отмечают, что саркомы чаще встречаются у мужчин (соотношение 3:2), другие (К.В.Даниель-Бек, АЛ.Колобяков) — у женщин (соотношение 5:4). Ангиосаркомы преимущественно возникают у больных в возрасте до 40 лет (около 80 %). Низко-дифференцированные типы, как правило, встречаются у лиц моложе 30 лет. Многочисленные теории этиологии злокачественных опухолей до настоящего времени не дают исчерпывающего объяснения причин бластома-тозного роста, в том числе сосудистых опухолей. Не исключена вероятность развития некоторых из них на почве дисэмбриоплазий или пролиферации камбиальных элементов отдельных тканей [Раков А.И., 1962]. В литературе представлены описания развития сарком мягких тканей в эксперименте под влиянием различных канцерогенных воздействий (бензпирен, кунжутное масло). Имеются редкие наблюдения возникновения сарком мягких тканей различного гистогенеза на местах, ранее подвергнутых облучению, причем всегда спустя длительный срок после лучевого воздействия, и в зонах выраженных трофических послелучевых изменений. Эти наблюдения свидетельствуют о том, что канцерогенные факторы (химические и ионизирующие) могут служить причиной злокачественных опухолей не только эпителиальной, но и мезенхимальной природы. Развитию сарком может предшествовать травма, в частности огнестрельная, хроническое воспаление, предшествующие доброкачественные опухоли. По-видимому, в основе механизма развития злокачественной опухоли лежат длительно существующие изменения в тканях, по выражению И.В.Давыдовского, "патологическая регенерация мезенхимы". Весьма спорна роль однократной механической травмы как фактора, способствующего развитию злокачественных опухолей мягких тканей. Очевидно, травма является лишь реали- зующим фактором, стимулирующим рост и клинические проявления уже существующего опухолевого зачатка. Эта точка зрения находит подтверждение у значительной группы больных, имевших интервал между травмой и появлением опухоли всего несколько месяцев, максимум 1—1,5 года. В редких клинических наблюдениях период от момента травмы до появления опухоли достигает 5—10 и даже 20 лет. По-видимому, как и при хроническом воспалении, однократная механическая травма способствует возникновению очага длительной патологической регенерации, следствием чего и является возникновение саркомы. Механизм развития сарком мягких тканей на фоне длительно существующей доброкачественной опухоли встречается крайне редко, и многие авторы опровергают подобную возможность. Первичная множественность злокачественных ангиосарком наблюдается в двух вариантах. Наиболее редкий — местная (или регионарная) множественность, когда последовательно (метахронно) возникают новые опухоли, но не вблизи послеоперационного рубца, как проявление рецидива, а в отдалении от него. Клинически это может проявляться возникновением опухоли на стопе, затем на голени или бедре и ягодице (3—5 узлов и более). Самым частым проявлением множественности ангиосарком является повторное рецидивирование, когда после неоднократных радикальных иссечений опухоли в данной области возникают новые и новые рецидивы за счет оставшихся множественных опухолевых зачатков-сателлитов. По-видимому, проявления первичной множественности злокачественных опухолей мягких тканей свидетельствуют о мультицентричности зачатков опухоли в данной зоне или о каких-то общих гормонально-обменных нарушениях в организме, создающих своего рода предрасположен- ность к опухолевому росту. Определенное место в патогенезе некоторых форм злокачественных сарком мягких тканей занимают дисэмбриопла-зии — дистопированные зачатки недифференцированной мезенхимы, из которых также при условии нарушений общей корреляции в организме развиваются злокачественные опухоли. Не исключены возможное влияние экзо- и эндогенных факторов, роль вирусов и других известных факторов канцерогенеза. Морфологическая классификация. До настоящего времени не существует достаточно полной и общепризнанной морфологической классификации сосудистых опухолей [Смолья-нинов А.В., 1969; Вихерт A.M., Га-лил-Оглы Г.А., Порошин К.К., 1969; Петрова А.С., Соколова В.К., 1974; Даниель-Бек К.В., Колобяков А.А., 1979]. Наиболее полную классификацию сосудистых опухолей дает Stout (1953). По его мнению, нельзя называть все злокачественные сосудистые опухоли ангиосаркомами, так как гистологически они выглядят по-разному. Поэтому он выделяет гемангиоэндо-телиому, происходящую из эндоте-лиальных клеток, и злокачественную гемангиоперицитому. Саркому Калоши считают специализированной опухолью невыясненной этиологии, которая отличается специфической картиной роста. Опухоли разделяют на зрелые (доброкачественные), которые обычно возникают у детей, и незрелые (злокачественные), чаще поражающие лиц старшего или пожилого возраста. При выраженной степени аплазии сосудистые опухоли не удается отнести к тому или иному морфологическому варианту, и тогда их именуют общим термином "ангиосаркомы". Макроскопически ангиосаркомы мало отличаются от других сарком. Это опухоли серо-розового или бурого цвета, относительно плотные, нередко с видимым инфильтрирующим ростом в окружающие ткани, хотя могут быть заключены в ложную капсулу. По данным микроскопической картины, ангиоэндотелиома (геман-гиоэндотелиома) сформирована из множества атипичных капилляров с пролиферацией атипичных эндоте-лиальных клеток, которые в виде комплексов или значительных скоплений выполняют просвет сосудов. Более зрелые варианты ангиосарком сходны с капиллярной ангиомой, менее зрелые нередко попадают в группы неклассифицируемых сарком. Гемангиоперицитома, развивающаяся из видоизмененных гладко-мышечных клеток адвентиции сосуда — перицитов Циммермана, состоит из значительного количества новообразованных сосудов, вокруг которых располагаются удлиненные или более округлые клетки (перициты) с разной степенью полиморфизма и атипии. В отличие от ангиоэндоте-лиом при гемангиоперицитомах эндотелий сосудов и их просвет не вовлечены в опухолевый рост, и опухоль не имеет капсулы. В анаплазированных формах нередко стирается перицитар-ное строение, нарастает полиморфизм клеток, которые частично еще остаются расположенными вокруг сосудов, а частично лежат беспорядочно. Гистологически ангиосаркомы состоят из круглых, веретенообразных, реже полиморфных клеток с выраженной аплазией. Дифференцировать их от других видов сарком часто не представляется возможным. Однако характерной основой выделения ангиосарком из общего числа злокачественных опухолей сосудистого происхождения является способность ее образовывать сосуды. Цитологически ангиогенные саркомы имеют характерную микроскопическую картину. Наличие округлых или овальных клеток, расположенных ветвящимися скоплениями, с крупными ядрами и пестрым распределением хроматина в них, а также большое число сосудов в пунктате составляют те особенности цитоло- гических картин, по которым может быть установлен диагноз сосудистой саркомы. Цитологически провести дифференциальный диагноз различных форм сосудистых сарком очень трудно, хотя имеются некоторые характерные морфологические особенности. Так, при ангиосаркоме клетки меньше, ядра окрашиваются более гиперхромно. При гемангиоперици-томе обращают на себя внимание более крупные клетки с довольно нежным рисунком хроматина в ядрах. Расположение же клеток вокруг сосудов в виде муфт встречается как при ангиосаркоме, так и при геман-гиоперицитоме. Метастазирование. Злокачественные ангиосаркомы склонны мета-стазировать как лимфогенным, так и гематогенным путем. Метастазирование в регионарные лимфоузлы отмечается в 40—45 % случаев. Немаловажное значение при этом имеют такие факторы, как расположение опухоли вблизи лимфатического барьера, а также прорастание и изъязвление кожных покровов. Поражение лимфатических узлов является крайне неблагоприятным признаком, так как в 60 % случаев сочетается с отдаленными метастазами и является проявлением генерализации опухолевого процесса. Гематогенные метастазы ангиосаркомы наблюдаются в 80—88 % случаев, чаще всего метастазирование происходит в легкие; при этом редко метастазы бывают солитарными. Как правило, спустя 3—6 мес после обнаружения одиночного метастаза при повторном рентгенологическом исследовании больного выявляются множественные метастатические очаги. Следовательно, возможности радикального излечения после удаления одиночного метастаза в легком крайне ограничены. Установление показаний к удалению метастаза в легком оправдано только при динамическом контроле спустя несколько месяцев после его первичного выявления.
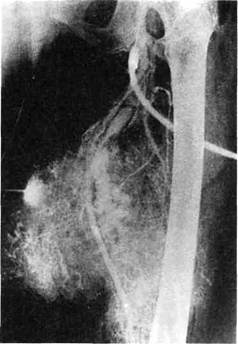
31* Значительно реже гематогенное метастазирование происходит в кости (6 %), печень (3 %), подкожную жировую клетчатку туловища и конечностей (3 %). В 30 % гематогенное метастазирование ангиосарком имеет характер генерализации процесса с одновременным поражением внутренних органов, костей, лимфатического аппарата и подкожной жировой клетчатки. Клиническая картина. Основной жалобой больных является наличие опухоли. Примерно в 66 % случаев опухоль является первым и единственным признаком болезни. Болевые ощущения отмечают всего 30— 33 % больных, причем более чем у половины из них боли сочетаются с появлением опухоли и лишь у меньшинства являются первым симптомом, который предшествует ее появлению. Боли тупого, ноющего характера обычно возникают только при давлении на опухоль или при ее пальпации. Болевой синдром связан с темпом роста опухоли и ее локализацией. При близости опухоли к суставу боли усиливаются во время движений, а при прорастании в кости принимают постоянный характер, но, как правило, не дают типичных для первичных сарком костей обострений в ночное время. Если опухоль располагается вблизи крупных нервных стволов и сплетений, боли становятся интенсивными и развивается типичная картина неврита или плексита с сильными иррадии-рующими болями. Однако, как правило, интенсивность болей при сосудистых саркомах невелика, и этот признак не имеет определяющего значения. Темп роста опухоли может варьировать от очень медленного, едва заметного для больного, до бурного, с быстрым увеличением ее размеров. Соответственно темпу роста выделяют 4 варианта: ▲опухоль обладает очень быстрым, бурным ростом, достигает в течение нескольких месяцев значительных размеров (примерно у 20 % больных); ▲темп роста опухоли менее бурный, но прогрессирующий; в течение 1—2 лет опухоль увеличивается в 2—3 раза по сравнению с первоначальным размером; этот наиболее типичный для ангиосарком темп роста встречается более чем у 30 % больных; ▲ скачкообразный рост опухоли, когда медленно растущая или почти не изменяющаяся в размерах на протяжении многих лет опухоль начинает быстро увеличиваться; подобный вариант наблюдается у 30 % больных; ▲на протяжении всего срока существования опухоль обладает медленным ростом, торпидным течением; такой нехарактерный для злокачественных опухолей рост не является редкостью и наблюдается в 20 % случаев. От темпа роста опухоли зависят сроки обращения больных к врачу. Более 60 % из них обращаются за помощью и получают лечение в течение первого года, в то же время более 10 % больных начинают лечение спустя 5 лет и более после обнаружения опухоли. Физикальное обследование. Ангио-саркомы могут возникать в любых частях тела, однако в 60—75 % локализуются на конечностях, причем на нижних в 2 раза чаще, чем на верхних. Локализация опухоли на бедре наблюдается в 45 % случаев. Примерно с той же частотой ангиосарко-мы возникают на туловище. К редким, но возможным локализациям относятся волосистая часть головы, кисть, стопа, область промежности. Сравнительно редко ангиосаркомы развиваются на шее, а на грудной стенке наиболее часто поражают подключичную область и область лопатки (надостная ямка). Опухоль обычно располагается в толще тканей. Частота опухолей на конечностях уменьшается от проксимальных отделов к дистальным. На бедре преимущественно поражаются перед-невнутренняя и задняя поверхности. На голени, плече и предплечье подобной избирательности не отмечается. Следует отметить, что ангио-саркомы очень редко локализуются вблизи суставов. Изменения кожи не являются характерными для ангиосарком. Такие признаки, как расширение подкожных вен, багрово-цианотичная окраска и инфильтрация кожи, равно как и ее изъязвление, являются относительно поздними и характерны для бурно растущих опухолей (25 % случаев). В одних наблюдениях кожа напряженная, блестящая, но сохраняет нормальную окраску, в других — приобретает багрово-цианотичный цвет, становится инфильтрированной и сращенной с поверхностью опухоли. При наличии изъязвления на поверхности кожи разрастаются фунгоз-ные, грибовидные опухолевые массы. Чаще прорастание кожи опухолью наблюдается при поверхностном ее расположении, особенно при рецидивах. Изъязвление с последующим экзофитным ростом может быть спровоцировано предшествующим рассечением ее или биопсией. Одним из характерных, но не па-тогномоничных признаков является расширение подкожных вен над опухолью (примерно 20 % случаев). Оно возникает при больших бурно растущих опухолях с усиленным кровообращением и местным затруднением оттока. Местное повышение температуры кожи над опухолью является одним из классических признаков ее злокачественности. Форма, контуры и размеры опухолей не имеют каких-либо специфических черт. Как правило, ангиосар-комы имеют овоидную форму. Примерно у половины больных имеются довольно четкие границы опухоли, что противоречит представлениям о злокачественном росте и затрудняет дифференциальный диагноз с доброкачественными опухолями. Обладая инфильтрирующим ростом, ан-гиосаркомы часто окружены подобием капсулы, которая формируется за счет десмопластической реакции и уплотнения окружающих тканей (ложная капсула). Это и придает опухоли относительную четкость границ и округлую форму. Размеры опухолей обычно не превышают 12—18 см. Поверхность и консистенция ангиосарком не имеют характерных отличительных черт. С одинаковой частотой опухоли имеют бугристую или гладкую поверхность, консистенция их различная: от хрящевидной, деревянисто-плотной до мягкоэластич-ной или неравномерной. При распаде в центре опухоли отмечается флюктуация. Симптом ложной флюктуации обнаруживают в случаях ослиз-нения опухолей. Однако чаще всего ангиосаркома имеет плотную или плотно-эластическую консистенцию. Для ангиосарком типично глубокое расположение в толще мышц, межмышечных соединительнотканных или жировых прослоек, однако у 20 % больных опухоли локализуются поверхностно. Одним из наиболее характерных признаков ангиосарком является ограничение ее подвижности. Это особенно демонстративно при напряжении группы мышц соответственно расположению опухоли и является отражением инфильтративного роста злокачественного образования. Функция конечности при ангио-саркомах нарушается редко, обычно при запущенных и распространенных процессах. Следует подчеркнуть, что основой для своевременного распознавания ангиосарком является онкологическая настороженность врача, что и определяет направленность дальнейших исследований. Рентгенологическая диагностика. Рентгенологическое обследование начинают с обзорного снимка с целью выявления возможных изменений в костях, наличия тени опухоли в мягких тканях и патологических известковых включений (кальцификаты или оссификаты). Вторичные изменения в костях при ангиосаркомах наблюдаются в 14—15 % случаев и имеют вид очага деструкции различной величины и формы. Важно установить наличие поражения кости и отличить первичную опухоль от вторичного поражения кости ангиосарко-мой, растущей в мягких тканях. Поражение кости может иметь место только при злокачественном характере опухоли, что предполагает резекцию кости или ампутацию конечности. Рентгенологические признаки вторичных изменений костей при ангиосаркомах не зависят от гистологической формы опухоли и определяются распространенностью, агрессивностью роста опухоли, а также глубиной ее расположения. В ряде случаев рентгенологическая картина не позволяет с уверенностью судить о злокачественном характере опухоли. Обзорная рентгенография позволяет обнаружить тень опухоли в мягких тканях, однако лучше эта тень выявляется при использовании "мягких" и прицельных снимков (Л.В.Заноздра) или томографии [Винтергальтер С.Ф., 1971]. Если на обычных обзорных снимках тень опухоли выявляется примерно у 20—25 % больных, то при применении специальных методик — у 50 % и более. Чаще опухоль имеет характер расплывчатого увеличения всей массы мягких тканей, реже ясно выделяется в виде более или менее очерченной интенсивной тени. Однако кажущаяся четкость контуров опухоли не является достоверным признаком ее доброкачественности. Тень опухоли на рентгенограммах чаще обнаруживают при злокачественной синовиоме или неклассифицируе-мых бластомах. Рентгенография также позволяет выявить включения в опухоль, возникающие в результате обызвествления или патологического костеобра-зования. Следует помнить, что при ангиосаркомах включений обычно не бывает. Этот симптом встречается при злокачественной невриноме, синовиоме, неклассифицируемых бластомах, доброкачественных опухолях (липома, гемангиома), а также при неопухолевых процессах типа осси-фицирующего миозита. Обязательным является рентгенологическое обследование органов грудной клетки. У больных с ангио-саркомами могут быть выявлены легочные метастазы, подтверждающие злокачественный характер опухоли. Рентгенологическим методом определяется распространенность процесса (4-я стадия), что позволяет избежать нерадикальных операций. Важно подчеркнуть, что при ангиосаркомах, отличающихся бурным течением, рентгеноскопию грудной клетки обязательно следует повторять накануне операции, что позволяет выявить метастазы, не обнаруженные при первом обследовании больного. При дифференциальной диагностике между ангиосаркомами, доброкачественными опухолями и воспалительными процессами ценная информация может быть получена с помощью ангиографического исследования. Различают прямые и косвенные ангиографические признаки опухолей мягких тканей. К прямым относятся расширение питающих опухоль артерий и наличие в новообразовании собственно опухолевых "патологических" сосудов в артериальной фазе и ненормально длительная задержка контрастного вещества в этих сосудах в капиллярной фазе, а также пропитывание контрастным веществом всего массива опухоли или отдельных ее участков в паренхиматозной ткани (рис. 9.1). Иногда присутствуют все эти признаки, но чаще проявляются только некоторые из них. К косвенным ангиографичес-ким признакам относятся смещение или сдавление крупных артериальных стволов (рис. 9.2). Специфической ангиографической картины, характерной для определенной гистологической формы опухолей мягких тканей, не существует. Даже при ангиосаркомах, когда ангиографичес-кая картина, казалось бы, должна быть особенно яркой, редко удается обна-
Рис. 9.1. Селективная артериография бедренных артерий (артериальная фаза). Ангиогенная саркома правого бедра. На внутренней поверхности бедра определяется зона патологической васкуляри-зации. Рис. 9.2. Селективная артериография бедренных артерий. В проксимальной и средней трети бедра — обширная зона патологической васкуляризации. Поверхностная бедренная артерия смещена опухолью кнутри.
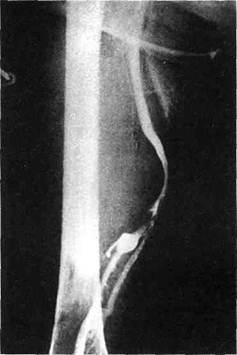
ружить специфические изменения. Поэтому основные задачи ангиографии состоят не столько в установлении природы опухоли, сколько в определении ее локализации, размеров и выявлении взаимоотношений с магистральными сосудами и тканями. Следует помнить, что патологическая васкуляризация не является специфическим признаком, характерным только для опухолей. Сходная ангиографическая картина возможна при воспалительных инфильтратах, что обусловлено наличием расширенных и густо расположенных капилляров в очагах воспаления [Margulis, 1964; Chavez & Hardy, 1966] и гематомы [Stener, Wickbom, 1966]. Флебография. Целью исследования является установление взаимоотношений с сосудистым пучком, обнаружение сдавления или прорастания вены (рис. 9.3). Зная уровень блокады или сдавления вены, степень развития коллатералей, хирург может заранее планировать перевязку магистральной вены или возможность ее протезирования. Данные флебографии особенно ценны при решении вопроса о повторных операциях, когда заведомо нарушены топографоанатомические соотношения тканей (рис. 9.4). Компьютерная томография. При КТ-исследовании мягких тканей применяют стандартные и специальные программы с использованием режимов высокого и сверхвысокого пространственного разрешения. Толщина среза составляет 8 мм при шаге 8—24 мм. При оценке изображений сравнивают пораженную конечность
Рис. 9.3. Флебограмма правого бедра. Бедренная вена смещена опухолью кнут-ри и сужена. со здоровой. Плотность сосудистых новообразований мягких тканей часто сходна с плотностью окружающих мышц, поэтому единственными признаками наличия опухоли служат смещение жировых прослоек и увеличение объема пораженной мышечной группы по сравнению с противоположной стороной. Основными КТ-симптомами ан-гиосарком являются: • повышение плотности прилегающей к опухоли жировой клетчатки; • вовлечение в процесс нескольких групп мышц; • плохое отграничение новообразования от окружающих тканей; • наличие участков пониженной плотности внутри опухоли. Для улучшения визуализации и получения объективной информации о вовлечении в опухолевое пора- жение сосудов используют методику внутривенного контрастирования. Пневмография является простым и безопасным методом при использовании углекислого газа или закиси азота. Она позволяет судить о состоянии отдельных мышц, их форме и структуре. На рентгенограммах газ, окутывающий опухоль, распространяется между мышцами в виде перистых просветлений, создавая раз-ноконтрастный фон, на котором четко вырисовывается тень опухоли, что позволяет определить глубину расположения опухоли, ее контуры взаимоотношения с костями. Характерным признаком сарком является наличие "хвостов", непосредственно переходящих в окружающие ткани. Пневмография позволяет отличить злокачественные опухоли от неопухолевых процессов, а также выявить тени маленьких, непальпируемых сателлитов, иногда на значительном расстоянии от основного узла. В случаях рецидивов опухолей, где трудно избежать наложения костей, пневмографию проводить нецелесообразно. Цитоморфологическую диагностику применяют для установления природы опухоли. Пункцию опухоли осуществляют по общепринятой методике: тонкой иглой без анестезии пунктируют опухоль с засасыванием ее клеточного сока в сухой и обработанный эфиром 20-граммовый шприц с последующим приготовлением мазков. Необходимо соблюдать следующие правила: пункцию проводят в более плотные участки по периферии опухоли, чтобы избежать попадания в зону распада; необходимо избегать пункции в зоне рубцово-из-мененных тканей в случаях рецидивных опухолей, где присутствуют лишь элементы хронического воспаления. Для ангиосарком характерен обильный кровянистый или бурый пунктат. Как правило, пункцию не повторяют более одного раза, после чего возможности цитологической диагностики считаются исчерпанными. Эф-
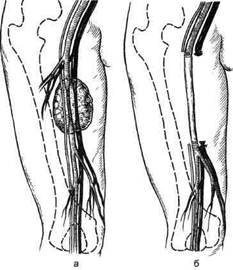
Рис. 9.4. Флебограмма левого бедра. Полное нарушение проходимости левой бедренной вены за счет сдавления опухолью. фективность клинико-цитологичес-кой диагностики составляет 95—98 %. Гистологическая диагностика. Вопрос целесообразности биопсии опухолей, покрытых неизмененной кожей и глубоко расположенных, остается дискутабельным. Большинство авторов считают оптимальным сочетание биопсии с операцией. При расположении опухоли на конечности биопсию проводят со жгутом, чтобы избежать гематогенных метастазов. В случаях обнаружения высокодиф-ференцированной саркомы производят широкое иссечение опухоли, а при наличии малодифференциро-ванной — ампутацию конечности выше уровня наложения жгута. Дифференциальный диагноз. Скудная клиническая симптоматика ан-гиосарком, часто отсутствие ярких и патогномоничных симптомов являются причиной частых диагностических ошибок и трудностей дифференциальной диагностики. Более чем у половины больных при первичном обращении к врачу злокачественная природа сосудистой опухоли оказывается нераспознанной. Обычно ставят диагноз доброкачественной опухоли (липома, фиброма, нейрофибро-ма и др.) или другого часто встреча- ющегося заболевания (воспалительный процесс, посттравматический миозит, гематома или неврит-плексит). Небрежно собранный анамнез в отношении темпа роста опухоли и невнимательно проведенная ее пальпация без направленного поиска симптома ограничения подвижности опухоли при условии значительного преобладания доброкачественных опухолей над злокачественными влекут ошибку в диагнозе. При обращении больного с жалобами на появление опухоли мягких тканей должны быть приняты во внимание все признаки ее злокачественности: локализация, прогрессирующее увеличение в размерах, малейшая степень фиксации к окружающим тканям. Вследствие того что ангиосаркома расценивается как доброкачественное образование, больному производят заведомо нерадикальное ограниченное оперативное вмешательство — вылущивание опухоли, нередко в амбулаторных условиях. Только последующий рецидив заставляет врача усомниться в правильности ранее поставленного диагноза и направить больного к онкологу. При наличии травмы в анамнезе часто устанавливают диагноз "гема- тома", "миозит" и др. Ошибочный диагноз ставят по упрощенной схеме: травма-боль и опухоль-гематома. Вместе с тем важным отличительным признаком является то, что ангио-саркома появляется не сразу после травмы, а через некоторый промежуток времени (от нескольких месяцев до 3 лет и более). Наличие опухоли с тенденцией к росту при значительном промежутке времени после травмы указывает на возможную бласто-матозную природу заболевания. В каждом пятом случае злокачественную опухоль принимают за воспалительный процесс и ставят диагноз (абсцесс, нагноившаяся гематома, постинъекционный абсцесс и др.). При редкой локализации анги-осарком — на шее, в подмышечной или паховых областях нередко ошибочно предполагают неспецифический или туберкулезный лимфаденит. Быстрое увеличение опухоли, местное повышение температуры, изменение окраски кожи симулируют картину воспалительного процесса и приводят к неверному диагнозу. Диагностические ошибки приводят к ошибочной тактике: отсрочке во времени с началом радикального лечения (иногда до нескольких месяцев), безуспешному проведению медикаментозной терапии, тепловых и других физиотерапевтических процедур. К порочным методам лечения прибегают и невропатологи, когда ставят ошибочный диагноз неврита при выраженном болевом синдроме. Трудности дифференциального диагноза предопределяют вероятность гипердиагностики опухолей. Такие ошибки обычно влекут за собой явно неправильное и небезразличное для больного лечение — лучевую или химиотерапию. Некоторым больным необоснованно производят обширное и даже калечащее вмешательство, например ампутацию конечности (принимают за ангиосаркому межмышечную липому большого размера). При дифференциальной диагностике между ангиосаркомой и хрони- ческим воспалением важно учесть сообщение больного о периодическом изменении размеров "опухоли", когда образование то увеличивается, то уменьшается в размерах (симптом "гармошки"). Данный симптом никогда не возникает при истинной опухоли, тем более злокачественной, и является указанием на то, что у больного имеется неспецифический воспалительный процесс или иная редкая патология (внебрюшинный эндомет-риоз, туберкулезная гранулема и др.). Дифференциальный диагноз следует проводить с доброкачественными опухолями. Основным отличительным признаком ангиосарком является прогрессирующий рост и ограничение подвижности. Такие признаки, как размеры опухоли и ее консистенция, диагностически незначимы. Плотная или плотноэластическая консистенция может быть при зрелой доброкачественной фиброме, нейро-фиброме или при их злокачественных аналогах, а также других формах сарком. Мягкая консистенция, иногда с флюктуацией, наблюдается и при злокачественных ангиосаркомах в случаях их распада или при наличии миксоматозного компонента. Четкость границ опухоли — признак сомнительный, так как ангиосарко-мы могут быть заключены в "ложную капсулу", что создает иллюзию четкости границ при пальпации. Дифференциальный диагноз труден при глубоко расположенных доброкачественных опухолях из-за отсутствия сведений о темпе роста опухоли и ограничения ее подвижности в толще мягких тканей. Расширение подкожных вен над опухолью может наблюдаться и при доброкачественных новообразованиях. Следует учитывать относительную редкость межмышечных доброкачественных опухолей на бедре, в ягодичной или окололопаточной областях. Очень труден дифференциальный диагноз между зрелыми доброкачественными опухолями и высокодифференцированными вялотекущими ангиосаркомами. От посттравматических процессов (гематома, миозит и др.) саркомы отличаются двумя признаками: наличием некоторого промежутка времени между травмой и появлением опухоли и неуклонным прогрессировани-ем процесса. При остром воспалении картина обычно развивается в течение нескольких суток (или часов), сопровождается общей температурной реакцией, болями и гиперемией кожи в отличие от багрово-синюшной ее окраски при ангиосаркоме. Трудности возникают при дифференциальной диагностике с подост-рым или хроническим продуктивным воспалением, когда имеются все признаки, свойственные злокачественной опухоли (нечеткость границ, ограничение подвижности, нередко увеличение в размерах после физиотерапевтических процедур). Решающее значение имеют два фактора: острое начало и периодическое изменение припухлости в размерах, характерные для воспаления. Дифференциальная диагностика необходима также между бластомами мягких тканей и послеоперационными воспалительными инфильтратами, возникающими после удаления ангиосарком. Отсутствие тенденции к уменьшению инфильтрата в обычные сроки или его увеличение дают основание заподозрить продолжение опухолевого роста. Лечение. Основным методом лечения ангиосарком является хирургическое. Показания и противопоказания к оперативному лечению опухолей, локализующихся на конечностях, зависят от гистологического строения, характера роста новообразования, степени его распространенности, анатомической локализации и общего состояния больного. Оперативные вмешательства делятся на две группы: органосохраняющие операции (широкое иссечение опухолей), ампутацию и экзартикуляцию конечностей. Саркомы мягких тканей служат абсолютным показанием к хирургическому вмешательству. Основным критерием определения объема операции является возможность радикального иссечения опухоли. При диссеминированных формах оперативное лечение противопоказано. Ампутация и экзартикуляция показаны при саркоме мягких тканей, прорастающей в кости и сосудисто-нервный пучок, при недифференцированных или низкодифференциро-ванных формах ангиосарком, а также при безуспешности сохраняющих операций. С паллиативной целью ампутация показана также при далеко зашедшем опухолевом процессе, в случае резких болей, патологическом переломе кости, полном отсутствии функции конечности. Пахово-под-вздошную лимфаденэктомию (операция Дюкена) выполняют при метастазах ангиосарком, локализующихся на нижних конечностях. Противопоказанием является диссеминация опухолевого процесса (отдаленные метастазы). Выбор объема и метода оперативного вмешательства. При хирургическом лечении ангиосарком необходимо соблюдение следующих основных принципов: 1) радикальный характер операции при возможно меньшем риске; 2) абластичность оперативного вмешательства; 3) по возможности сохранение конечности без нарушения ее функции. Это достигается путем удаления опухоли в целостном мышечно-фас-циальном футляре. Адекватная экс-цизия предусматривает удаление опухоли в анатомическом футляре из здоровых тканей без обнажения поверхности опухоли. Мышцы удаляют^ частично или целиком в зависимости от величины новообразования. В единый блок удаляемых с опухолью тканей входит клетчатка и фасции, покрывающие оставшиеся мышцы. При минимальных, даже косвенных указаниях на вовлечение в опухолевый очаг роста магистральных сосудов производят их резекцию и протезирование (рис. 9.5). Проксимальная и дистальная граница резекции
Рис. 9.5. Взаимоотношение опухоли с магистральными сосудами правого бедра (а) и схема выполненной операции (б). сосудов должна быть не менее 5 см от края опухоли. Нецелесообразно упорное стремление к скелетизации сосуда при его тесной связи с опухолью, поскольку это с высокой степенью вероятности приводит к рецидиву новообразования, а при возникновении аррозивного кровотечения качество реконструкции и последующий результат могут иметь неблагоприятный характер. При удалении ангиосарком бедра нередко производят одномоментную резекцию бедренной артерии и вены. Для решения вопроса о целесообразности пластики бедренной вены необходимо ориентироваться на глубокую вену бедра, которая играет значительную роль в осуществлении коллатерального оттока венозной крови от дистальных отделов конечности. Протезирование общей бедренной вены необходимо, если ее резекция производится выше устья глубокой вены бедра. Наиболее оптимально использовать ау-товенозный материал. Использование сегмента бедренной вены позволяет хорошо адаптировать имплантат с донорским участком сосуда по диа- метру. Без ущерба для венозного кровотока нижней конечности может быть использован трансплантат длиной до 20 см. При этом, если требуется одномоментное протезирование артерии и вены, кроме аутоматериа-лов, целесообразно использовать протезы из политетрафторэтилена. В случае небольших дефектов сосудов, образующихся после удаления опухолей, могут быть использованы заплаты из аутовены или консервированной твердой мозговой оболочки. Операция Дюкена. Вертикальным разрезом на 8—10 см выше середины паховой связки и на 15—20 см ниже ее рассекают кожу до подкожной жировой клетчатки. Кожные лоскуты мобилизуют в стороны на уровне поверхностной подкожной фасции. Подкожный жировой слой иссекают с таким расчетом, чтобы обнажить подвздошную часть брюшной стенки и весь бедренный треугольник. Разрез продолжают до подлежащих мышц, фасцию которых рассекают и отслаивают, обнажая таким образом портняжную и длинную приводящую мышцы, которые служат наружной и внутренней границами удаляемого блока, состоящего из лимфатических узлов и клетчатки. Далее перевязывают и пересекают большую подкожную вену в нижнем углу раны (вершина бедренного треугольника). После этого блок клетчатки с лимфатическими узлами оттесняют кнутри, а портняжную мышцу отводят кнаружи, что позволяет легко обнажить ложе бедренных сосудов. Постепенно весь удаляемый блок тканей вместе с наружной стенкой сосудистого влагалища отделяют от бедренных сосудов и поднимают кверху к месту впадения большой подкожной вены в бедренную, где большую подкожную вену перевязывают и пересекают. Выделенный препарат удаляют единым блоком. В ранних стадиях заболевания может быть произведено широкое удаление опухоли вместе с окружающими тканями с одновременным иссе- чением регионарных лимфоузлов. Учитывая высокую злокачественность ангиосарком конечностей, целесообразно сочетать ампутацию (экзарти-куляция) конечности с удалением регионарных лимфоузлов. Широко используют комбинированный метод лечения, когда на первом этапе лечения, перед хирургическим вмешательством проводят лучевую терапию (возможно использование ее после операции). Радиочувствительность большинства ангиосарком невелика, зрелые сосудистые опухоли оказываются более чувствительными к лучевой терапии, чем их злокачественные аналоги. Комбинированное лечение снижает частоту рецидивов и улучшает прогноз. Проведение регионарной химиотерапии в дополнение к операции нецелесообразно. Отдаленные результаты лечения, прогноз. Пятилетняя выживаемость больных после лечения составляет 27—29 %. Общий срок жизни больных от начала заболевания при анап-лазированных формах ангиосарком не превышает 3—3,5 года. Поэтому калечащие операции при ангиосар-комах должны быть исключением и их следует проводить только в самых крайних случаях, так как течение болезни настолько злокачественное, что потеря конечности не спасает больному жизнь. Более оправданным является максимально широкое иссечение опухоли в комбинации с лучевой терапией, избавляющее больного от ненужной ампутации и тяжелой психической травмы. Частные формы. Гемангиоэндоте-лиома (син.: эндотелиома, ангиосар-кома, гемангиосаркома, гем- и лим-фангиоэндотелиома, гемангиобласто-ма, злокачественная ангиома). Злокачественная опухоль из эндотелия кровеносных и лимфатических сосудов. Чаще всего эта опухоль развивается на фоне длительно существующего лимфостаза верхних конечностей после радикальной мастэктомии. Обычно через 4—10 лет после опера- ции. Пол и возраст больных значения не имеют. Локализация опухоли в мягких тканях довольно разнообразна: обычно узлы опухоли располагаются более поверхностно, в подкожной жировой клетчатке, реже в толще мышц. Размеры опухоли различны: колеблются от 1—2 см до гигантских, захватывающих все плечо и имеющих вид экзофитно растущих буровато-красных масс. Макроскопически — сочные, рыхлые, буровато-красные узлы с нечеткими контурами. Очаги геморрагии — довольно частая находка. Лимфангио-эндотелиома в чистом виде встречается очень редко и характеризуется появлением хилезного секрета на поверхности среза, однако вследствие прорастания опухолью близлежащих сосудов опухоль по внешнему виду приобретает сходство с гемангиоэн-дотелиомой. Прогноз неблагоприятный. До 60 % больных погибают в ближайшие 2—3 года от гематогенных метастазов. Гемангиоперицитома (син.: ангио-перицитома, перицитома, перителио-ма, перицитарная саркома, периэндо-телиома, периваскулярная гемангио-эндотелиома). Опухоль, гистогенети-чески связанная с перицитами Циммермана. Возникает преимущественно у лиц среднего и пожилого возраста, одинаково часто у мужчин и женщин. Локализация опухоли в мягких тканях довольно разнообразна, но более излюбленным местом их возникновения являются межмышечные прослойки передней поверхности бедра. По морфологическому строению различают дифференцированные (морфологически зрелые) и недифференцированные гемангио-перицитомы. Опухоль склонна к длительному течению, обычно достигает больших размеров, сохраняет четкие контуры и подвижность. Макроскопически — пористое строение, розовато-красный цвет, обилие сосудов, подходящих к опухоли. По данным разных авторов, метастазы при ге- мангиоперицитомах отмечаются в 10—56 % случаев. Саркома Копоши (син.: идиопати-ческая геморрагическая саркома, мультицентричная ангиосаркома, ан-гиоретикулоэндотелиома). Это заболевание выделяется в самостоятельную форму в силу своеобразной клинической и гистологической картины. Гистогенез опухоли до настоящего времени неясен. Саркома Капоши — циклически текущее ангиоматозное поражение с мультицентричным ростом и с исходом в дальнейшем в злокачественную сосудистую опухоль. Большинство исследователей включают саркому Капоши в группу сосудистых опухолей, так как в третьей, неопластической, стадии ее развития отчетливо выступает ангиоматозный характер поражения. Источником роста саркомы Капоши могут быть эндотелий, фибробласты, нейромио-артериальные элементы, ретикулярные клетки, мезенхима, в частности ангиобластический росток. Клиническая картина при саркоме Капоши характеризуется появлением множественных симметричных узелков, расположенных в дистальных отделах конечностей. Процесс чаще локализуется в коже, реже в висцеральных органах и совсем редко — в мягких тканях. Вначале появляющиеся пятна, узелки, бляшки имеют синеватый, красновато-коричневый цвет, округлую или неправильную форму, выступают слегка над поверхностью кожи. Высыпания плотные, различного размера. В дальнейшем узелки сливаются, захватывают большую площадь, отдельные узелки имеют бородавчатый вид; часто наступает изъязвление, а кровоизлияния придают опухоли коричневую, темно-бурую окраску. В отдельных участках наступает рубцевание, приводящее к образованию островков атрофии с пигментацией и телеангиэкта-зиями. Нарушение кровобращения проявляется отеком конечности. Заболевание может длиться годами (5—10 лет и более), возникает пре- имущественно у лиц среднего и пожилого возраста, главным образом у мужчин (9:1). Общее состояние больных длительное время не страдает. Однако через несколько лет может наступить генерализация процесса, появляются метастазы в лимфатических узлах и внутренних органах. Лечение: наибольшее распространение получила близкофокусная рентгенотерапия в сочетании с кортикос-тероидами. При распространенных формах с некоторым успехом применяется лекарственное лечение (сар-колизин). Литература Вихерт A.M., Галил-Оглы Г.А., Порошин К.К. Опухоли мягких тканей. — М.: Медицина, 1969. Габуния Р.И., Колесникова Е.К. Компьютерная томография в клинической диагностике. — М.: Медицина, 1995. Головин Д.И. Ошибки и трудности гистологической диагностики опухолей. — Л.: Медицина, 1982. Даниель-Бек К.В. Ошибки диагностики и тактики при саркомах мягких тканей//Хи-рургия. - 1965. - № 4. - С. 109-114. Даниель-Бек К.В. О метастазах сарком мягких тканей конечностей и туловища в регионарные лимфатические узлы // Вопр. он-кол. - 1966. - № 9. - С. 12-17. Даниель-Бек КВ., Никитина Н.И. Клини-ко-цитологические параллели в диагностике злокачественных опухолей мягких тканей//Хирургия. — 1967. — № 8. — С. 133-136. Злокачественные новообразования (статистические материалы по СССР)/Под ред. А.Ф.Серенко и Г.Ф.Церковного. — М.: Медицина, 1974. Зотов СП., Фокин Ан.Ал., Желваков Б.А. и др. Сосудистая реконструкция в хирургии опу-холей//Грудн. и серд.-сосуд. хирургия. — 1996. - № 6. - С. 247. Колобяков А.А., Липович М.М., Островская И.М. Пневмография и ангиография в диагностике опухолей мягких тканей//Хи-рургия. - 1971. - № 5. - С. 101-105. Опухоли опорно-двигательного аппарата// Научные труды/Под ред. Н.Н.Трапезникова и Л.А.Ереминой. — Вып. 5. — М., 1976. Петерсон Б.Е. Хирургическое лечение злокачественных опухолей. — М.: Медицина, 1976. Петерсон Б.Е., Чиссов В.И., Пачес А. И. Атлас онкологических операций. — М.: Медицина, 1987. Петрова А. С, Соколова В. К. Цитологическая диагностика опухолей скелета и мягких тканей. — М.: Медицина, 1974. Раков A.M., Чехарина Е.А. Злокачественные опухоли мягких тканей конечностей и туловища. — Л.: Медицина, 1975. Смольянинов А.В. Морфологическая диагностика опухолей мягких тканей. — М.: ЦОЛИУВ, 1969. Тришкин В.А., Столяров Б.И. Лимфогенное метастазирование злокачественных опухолей мягких тканей (докл.)//Вопр.онкол. — 1977. -№ 7. -С. 118-119. Фокин Ан.Ал., Зотов СП., ВаженинА.В., Вер-бовецкий Л. П. Использование поверхностной бедренной вены в реконструктивно-вос-становительной хирургии сосудов// Грудн. и серд.-сосуд. хир. — 1993. — № 5. — С. 72—75. Цель Е.А. Клиническая характеристика не-классифицируемых опухолей мягких тка-ней//Вопр.онкол. — 1975. — № 11. — С. 21-26. Chavez СМ., Hardy J.D. Angiography in tumor diagnosis and management (review of 93 cas-es)//Ann.Surg. - 1966. - Vol. 163. -P. 672-684. Margulis A.R. Arteriographyof tumors: difficulties in interpretation. — Radiol.clin.N.Amer. — 1964. - Vol. 2, N 3. - P. 543-562. Pack G.T., Atiel I.M. Tumors of soft somatic tissues. — New York, 1958. Stener В., Wickbom I. Angiography in the cases of muscle repturre with organizing haemato-ma//Acta Radiol. — 1966. - Vol. 4. -P. 169-176. Stout A. P. Mesenchimal Tumors of the Soft Tissues//Trans. Stud. Colleg.Physic. — 1963. — Vol. 31. - P. 91-97.
Дата добавления: 2015-02-06 | Просмотры: 1939 | Нарушение авторских прав |