|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Синдром Иценко—КушингаПри чрезмерном повышении функции всех гормонпродуцирующих зон коры надпочечников развивается состояние пангиперкортицизма, или синдром Иценко—Кушинга. Другое название этого заболевания — глю-кокортицизм, так как при нем преобладает гиперпродукция глюкокор-тикоидов. Нарушение всех видов обмена под влиянием избыточного количества глюкокортикоидов опре- делило и другое название болезни: супраренометаболитный синдром. Впервые клиника этого заболевания была описана в 1924 г. отечественным невропатологом Н.М. Иценко, который предполагал, что причиной заболевания являются патологические изменения в гипоталамической области головного мозга, ответственного за функцию гипофиза. В 1932 г. американский нейрохирург H.Cus- hing сообщил о возможности аналогичных клинических проявлений при базофильных аденомах гипофиза. До настоящего времени многие исследователи выделяют болезнь Ицен-ко—Кушинга, когда предполагается наличие первичных изменений в межуточном мозге или гипофизе, и синдром Иценко—Кушинга, когда первичными являются патологические изменения в надпочечниках. В основе болезни Иценко—Кушинга лежит гиперпродукция кортикотропин-ри-лизинг-гормона в подбугорье и АК-ТГ в гипофизе, что приводит к двусторонней диффузной гиперплазии коры надпочечников, преимущественно ее пучковой зоны, и гиперсекреции глкжокортикоидов (кортизола). Развитие синдрома Иценко—Кушинга связывают с первичными изменениями в надпочечниках (адено-матоз, опухоли), что также проявляется усилением синтеза и секреции кортизола, избыток которого подавляет выделение АКТГ гипофизом. Несмотря на различие патогенетических механизмов, вызывающих повышенное образование кортико-стероидов, клинические проявления при болезни и синдроме Иценко— Кушинга одинаковы и обусловлены в основном гиперфункцией коркового слоя надпочечников. Именно надпочечники являются "исполнительным органом в развитии заболевания" [Ратнер Г.Л., Чернышев В.Н., 1973] при одновременном наличии тех или иных изменений в гипоталамо-гипо-физарной системе. Поэтому вполне обоснованным является предложение многих авторов объединить эти два патологических состояния под единым названием "синдром Иценко—Кушинга". Отдельно выделяют так называемую эктопическую форму синдрома Иценко—Кушинга, когда гиперплазия коры надпочечников и гиперпродукция глюкокортикоидов стимулируются АКТГ-подобными пептидами, вырабатываемыми вне надпочечников злокачественными но- вообразованиями: наиболее часто — это бронхогенный рак легкого, реже — опухоли поджелудочной и вилочко-вой железы, рак матки, щитовидной, предстательной железы, яичек и пр. Таким образом, следует различать гипофизарную, надпочечниковую и эктопическую формы синдрома Иценко—Кушинга. Частота. По данным М.С.Куша-ковского (1983), суммарно частота этих синдромов в общей популяции составляет 0,1 %, а среди гипертоников — 0,5 %. По предположению В.Н.Чернышева (1998), на миллион жителей должно быть несколько сотен таких больных. Среди них около 80 % составляют лица с гипофи-зарным синдромом Иценко—Кушинга и 20 % — с первично-надпочечни-ковым и эктопическим синдромом Иценко—Кушинга. Этиология и патогенез. Причина развития гипофизарной формы синдрома Иценко—Кушинга не установлена. У некоторых больных начало заболевания связывается с травмой головного мозга, перенесенной ней-роинфекцией, беременностью, которые могут быть причиной нарушения контроля секреции АКТГ. Заболевание часто начинается в период полового созревания, после родов и абортов, что может быть объяснено "ранимостью" гипоталамических и других отделов ЦНС в эти периоды наибольшей активности гипоталамо-гипофизарно-надпочечниковой системы [Балаболкин М.И., 1998]. Многие зарубежные исследователи считают, что в основе заболевания лежит аденома из АКТГ-секретирующих клеток (чаще это базофильные или хромофобные аденомы). Вследствие избыточного выделения гипофизом АКТГ нарушается принцип обратной связи, когда в ответ на повышение уровня в крови глюкокортикоидов (кортизола) не происходит заметного снижения секреции АКТГ. Гиперсекреция АКТГ приводит к двусторонней гиперплазии коры надпочечников, увеличению образования и
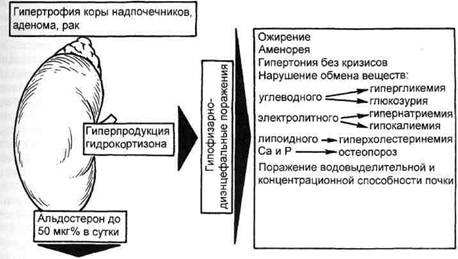
Рис. 8.6. Клинические проявления синдрома Иценко—Кушинга. секреции кортикостероидов, влияющих на обмен веществ и обусловливающих клиническую картину заболевания (рис. 8.6). В основе надпочечниковой формы синдрома Иценко—Кушинга лежит развитие гиперплазии, доброкачественной или злокачественной опухоли пучковой зоны коры надпочечников, что проявляется усиленной секрецией кортизола, угнетающего выделение АКТГ гипофизом. По литературным данным, у 50—80 % больных с данной формой синдрома Иценко— Кушинга имеется гиперплазия коры надпочечника, у 20—30 — различные опухоли и у 10 % значимые изменения надпочечников отсутствуют. О механизме развития эктопической формы синдрома Иценко—Кушинга сказано выше. Гипофизарная и надпочечниковая формы синдрома в 4—8 раз чаще встречаются у женщин, в основном в возрасте от 20 до 45 лет, а эктопическая — чаще у мужчин. У большинства больных имеется гиперплазия коры обоих надпочечников, когда они диффузно увеличиваются, не изменяя своей формы. Масса и размеры гиперплазирован- ных надпочечников обычно в 2—3 раза превышают нормальные. Опухоли коркового слоя (кортикостеромы) как причина синдрома Иценко—Кушинга встречаются у 20—30 % пациентов, причем у женщин в 4—5 раз чаще. Злокачественный рост опухоли отмечается у 30—50 % больных. Малигнизация чаще всего наблюдается у лиц молодого возраста. Опухоли обычно односторонние и сочетаются с гипотрофией противоположной железы. При всех формах синдрома Иценко—Кушинга гиперпродукция глю-кокортикоидов приводит к резким нарушениям обмена веществ, прежде всего углеводного обмена. В результате распада белков мышечной ткани и переработки их в углеводы, а затем в жировую ткань происходит перераспределение жира в верхнюю часть туловища. Избыток углеводов снижает толерантность к глюкозе и часто приводит к развитию сахарного диабета, снижению устойчивости к инфекции. Повышенное выделение альдостерона, андро- и эстрогенов влечет нарушения минерального обмена, половой сферы и развитие артериальной гипертензии. Синдром Иценко—Кушинга является одним из наиболее тяжелых эндокринных расстройств, затрагивающим все органы и системы и уже через 5—7 лет от начала заболевания при отсутствии лечения приводящим к гибели больных или развитию осложнений. Это подчеркивает необходимость возможно более раннего выявления и лечения данного заболевания. Клиническая картина. Клинические проявления синдрома Иценко— Кушинга обычно нарастают постепенно. В большинстве случаев заболевание начинается с ожирения, характеризующегося перераспределением жировой ткани с преимущественным отложением на лице, животе, надключичных областях, плечевом поясе и спине, особенно в нижнешейном и верхнегрудном отделах с формированием "климактерического горбика" или "буйволиного типа". Ожирение не захватывает верхние и нижние конечности, отчего они выглядят непропорционально тонкими. Лицо становится круглым, лунообразным, ги-перемированным, особенно в щечных областях, что придает ему весьма характерный вид, называемый "матро-низмом". На коже живота, груди, бедер, ягодиц и внутренних поверхностей плеч в результате катаболизма белков появляются слегка втянутые своеобразные полосы — стрии шириной до 2 и длиной до 8 см, имеющие фиолетово-розовый цвет. Вследствие атрофии эпидермиса и соединительной ткани кожа истончается, становится легко ранимой, повреждения ее длительно не заживают. Возникают гнойничковые высыпания. Экхи-мозы, подкожные кровоизлияния и отеки на ногах связаны с повышенной ломкостью и проницаемостью капилляров. В местах трения кожи (шея, локти, живот) появляется гиперпигментация из-за избыточного отложения меланина под действием гиперпродукции АКТГ. Одновременная гиперсекреция андрогенов у женщин приводит к нарушениям менструального цикла, атрофии молочных желез, бесплодию, гирсутиз-му. У мужчин нарушаются либидо и потенция, появляются признаки де-маскулинизации. Больные выглядят немощными, вялыми. Мышечная сила, особенно в проксимальных отделах конечностей, прогрессивно падает. За счет декальцификации и уплощения позвонков уменьшается рост, возможны патологические переломы костей. У многих больных заболевание сопровождается нарушениями в психоэмоциональной сфере, чаще в виде депрессии и склонности к суициду. Часты раздражительность, эмоциональная неустойчивость, быстрая умственная истощаемость, ухудшение памяти. Вследствие избытка глюкокортикоидов у больных часто нарушается обмен углеводов, обычно в виде нарушений толерантности к глюкозе, реже развивается явный сахарный (стероидный) диабет. Снижение сопротивляемости к инфекции, помимо гнойничковых высыпаний, проявляется частым развитием пиелонефрита, склонностью к гнойным осложнениям после инъекций и хирургических операций. Характерно, что при отсутствии лечения половина больных с синдромом Иценко—Кушинга погибают от интеркур-рентных инфекций. Одним из наиболее постоянных признаков синдрома Иценко—Кушинга является артериальная гипер-тензия, выраженность которой увеличивается с длительностью заболевания. Средний уровень АД составляет 220—225/120—130 мм рт.ст. Одной из основных причин гипертензии является задержка натрия, вызванная избытком кортизола и в меньшей степени кортикостерона и дезокси-кортикостерона. Роль альдостерона в нарушении натрий-калиевого обмена при синдроме Иценко—Кушинга незначительна. Часто наблюдаются изменения периферической крови: снижение количества лимфоцитов и эозинофилов, повышение количества гранулоцитов. Отмеча- ются полицитемия и повышенное содержание гемоглобина. Следует подчеркнуть, что клинические проявления всех форм синдрома Иценко—Кушинга весьма сходны, а различие состоит лишь в частоте и сочетании отдельных симптомов. Как правило, внешние проявления синдрома Иценко—Кушинга настолько характерны, что правильный диагноз заболевания без дифференциации на отдельные клинические формы возможен уже при первом контакте с больным. Следует помнить, что при опухолевой форме синдрома Иценко—Кушинга заболевание обычно прогрессирует более быстрыми темпами и симптоматика его более яркая. Частота отдельных симптомов при синдроме Иценко—Кушинга представлена ниже. Частота отдельных симптомов при синдроме Иценко—Кушинга
В зависимости от частоты, сочетания и тяжести отдельных клинических симптомов В.Н.Чернышев (1998) выделяет три степени тяжести синдрома Иценко—Кушинга. Легкой степени соответствуют умеренно выраженные внешние проявления синдрома Иценко—Кушинга с мягкой, хорошо корригируемой артериальной гипертензией. Проявления нарушений функции внутренних органов минимальны, отсутствует сахарный диабет, нет выраженного остеопороза и признаков сердечной недостаточности. При средней степени тяжести имеются развернутая клиническая картина синдрома, умеренная артериальная гипертензия, сахарный диабет, выраженный остеопороз, а также признаки сердечной недостаточности. Тяжелому и прогрессирующему течению соответствуют резко выраженные клинические проявления синдрома Иценко—Кушинга. У больных имеются тяжелая артериальная гипертензия, сахарный диабет. Резко выражен остеопороз, часто с патологическими переломами костей; сердечная недостаточность, нарушение функции почек и инфекционно-сеп-тические осложнения. Диагноз. Развернутый диагноз синдрома Иценко—Кушинга основывается на клинической картине и результатах специального (лабораторного и инструментального) обследования больных. В большинстве случаев наличие тотального гиперкортицизма, проявляющегося яркой клинической картиной, не вызывает сомнения в наличии у больного синдрома Иценко—Кушинга и в общем не требует его подтверждения лабораторными методами. Основной задачей обследования является установление причины возникновения заболевания, в частности наличия гиперплазии коркового слоя надпочечников или опухоли. Именно это является определяющим в выборе метода лечения и показаний к хирургическому вмешательству. Поэтому обследование больных с явными признаками пан-гиперкортицизма наиболее целесообразно начинать с инструментальных методов диагностики. Для предварительного диагноза и латерализации поражения надпочечников достаточной информативностью обладает ультразвуковое скани- рование. Точность данного метода несомненна при наличии опухоли надпочечника более 2 см в диаметре. Однако при меньших размерах опухоли или дифференциации микро- и макроаденоматоза железы разрешающие возможности УЗИ не превышают 60 %. При обнаружении опухоли надпочечника используют компьютерную томографию, позволяющую определить ее локализацию, структуру, размеры и взаимоотношение с окружающими тканями, что необходимо для планирования хирургического вмешательства. Если при УЗИ надпочечников опухолевый рост не выявлен, то наиболее точная информация о характере их морфологических изменений может быть получена с помощью маг-ниторезонансной томографии, обладающей более высокими, чем КТ, чувствительностью и точностью. Информативность МРТ приближается к 90 %. Полученные при этом данные позволяют латерализовать поражение и выбрать оптимальную тактику и объем оперативного вмешательства. При отсутствии изменений и нормальных размерах надпочечников необходимо помнить о возможном наличии эктопической АКТГ-проду-цирующей опухоли и использовать МРТ для обследования грудной или брюшной полости, а также других анатомических зон ее вероятной локализации. Для получения информации о характере изменений гипофиза методом выбора также является МРТ. В совокупности с результатами лабораторных исследований она позволяет определить необходимость и метод подавления гиперпродукции АКТГ. Широко применявшиеся ранее методы топической диагностики (суп-рареноангиография, томография в условиях ретропневмоперитонеума и пр.) обладают меньшей диагностической точностью и сопряжены с потенциальной опасностью для боль- ного, поэтому большинство современных исследователей от них отказались. Дальнейшее обследование больных с синдромом Иценко—Кушинга направлено на лабораторное подтверждение повышенной гормональной активности надпочечников и гипофиза. В этом отношении одним из наиболее информативных является определение экскреции свободного кортизола с мочой. Суточное выделение кортизола в норме варьирует в пределах 20—100 мкг. Более высокие показатели подтверждают наличие гиперкортицизма. Определение концентрации кортизола в плазме крови также позволяет доказать наличие у больного гиперкортицизма. При синдроме Иценко—Кушинга содержание кортизола в плазме крови больных повышено. В норме концентрация кортизола в утренние часы колеблется от 10 до 25 мкг/100 мл (0,28—0,69 мкмоль/л), а вечером — 2—8 мкг/100 мл (55—221 нмоль/л). Следовательно, в норме утром уровень кортизола в 2—5 раз превышает его содержание в вечерние часы. При синдроме Иценко—Кушинга, помимо повышенной секреции кортизола, нарушается суточный ритм его секреции: утрачивается разница в содержании кортизола в утренние и вечерние часы. Определив концентрацию АКТГ в плазме крови, можно не только подтвердить наличие гиперкортицизма, но и приблизительно судить о причине его возникновения. У больных с гипофизарной формой синдрома Иценко—Кушинга отмечается умеренное повышение уровня АКТГ в плазме крови (менее 200 пг/мл). При наличии опухоли коркового слоя надпочечника уровень АКТГ в плазме крови резко снижен или практически не определяется. В случаях эктопических АКТГ-продуцирующих опухолей с развитием синдрома Иценко—Кушинга уровень АКТГ в плазме крови резко повышен, как правило, более 200 пг/мл. Следует отметить, что определение базальной экскреции метаболитов кортизола (17-оксикортикосте-роиды и 17-кетостероиды) с мочой в настоящее время для диагностики синдрома Иценко—Кушинга не используют, так как их выведение увеличивается при различных патологических состояниях (ожирение, ги-пертиреоз) и, напротив, уменьшается при гипотиреозе, что не соответствует истинному состоянию гипер- или гипокортицизма. Кроме того, некоторые лекарственные препараты (барбитураты, хлодитан и др.) изменяют скорость образования и уровень кортизола в плазме. Для установления причины синдрома Иценко—Кушинга и разграничения отдельных его форм высокую диагностическую значимость имеет проба с дексаметазоном (проба Лид-дла). Она основана на том, что под воздействием дексаметазона, являющегося центральным блокатором синтеза АКТГ, у больных с неопухолевой формой синдрома Иценко-—Кушинга вследствие снижения синтеза АКТГ в гипофизе (принцип обратной связи) уровень кортизола в плазме крови уменьшается. При наличии корти-костеромы или эктопической формы синдрома Иценко—Кушинга уровень кортизола остается неизменным, так как не зависит от уровня секреции АКТГ гипофизом и на его концентрацию в плазме крови прием дексаметазона не влияет. Проба с дексаметазоном проводится в двух вариантах. При малом тесте больному в течение суток каждые 6 ч дают по 0,5 мг дексаметазона. Мочу для определения 17-ОКС или свободного кортизола собирают два дня до и два дня после назначения дексаметазона. Дексаметазон в данной дозе угнетает образование кортикостероидов у всех практически здоровых лиц и приводит к снижению уровня кортизола и 17-ОКС на 50 % и более от исходного. При синдроме Иценко— Кушинга эти "малые дозировки" дексаметазона не влияют на уровень кортизола и 17-ОКС. При большом тесте следующие 2 сут больной принимает уже по 2 мг дексаметазона каждые 6 ч. Также проводят сбор мочи для определения 17-ОКС или свободного кортизола. При неопухолевой форме синдрома Иценко—Кушинга и гиперфункции надпочечников происходит падение экскреции стероидов на 50 % и более. У больных с опухолевой и эктопированной формой экскреция кортикостероидов не изменяется. Проба с АКТГ. При введении 50 ЕД АКТГ у больных с неопухолевой гиперфункцией коры надпочечников происходит увеличение секреции кортизола и соответственно экскреции его метаболитов. В случаях наличия кортикостеромы секреция кортикостерона и выведение метаболитов стероидов остаются неизмененными вследствие автономности роста и функции опухоли. При дифференциальной диагностике синдрома Иценко—Кушинга следует помнить о гипоталамичес-ком синдроме пубертатного периода, синдроме поликистозных яичников, синдроме Штейна—Левенталя, ожирении и псевдосиндроме Иценко— Кушинга, наблюдающемся у лиц, злоупотребляющих алкоголем. Лечение. Нормализация секреции АКТГ и кортизола является основной целью лечения, которое в зависимости от формы синдрома Иценко—Кушинга может быть консервативным, хирургическим или комбинированным. Многие авторы при всех формах синдрома Иценко—Кушинга отдают предпочтение различным хирургическим операциям на надпочечниках или гипофизе ввиду недостаточной эффективности медикаментозной терапии и возможности развития тяжелых осложнений. В этом отношении примечательны слова Г.Кушинга: "Мы живем в эпоху все более безопасной хирургии и все более опасной терапии". При гипофизарной форме синдрома Иценко—Кушинга, когда гипер- плазия и гиперфункция коры надпочечников обусловлены гиперпродукцией гипофизом АКТГ, лечение обычно направлено на одновременное подавление функции как гипофиза, так и надпочечника. Подавление функции гипофиза может быть достигнуто трансфеноидальной ги-пофизэктомией. Однако это технически сложное вмешательство у части больных (до 30 %) оказывается неэффективным, а после удаления больших аденом часто возникают рецидивы опухоли. Другим методом угнетения гипофиза является применение различных видов ионизирующей радиации. Чаще всего используют рентгенотерапию в общей дозе 4,5—5 тыс. рад с повторением курса через 7—9 мес. С этой же целью применяется гамма-терапия (кобальт-60) в той же дозе. В последние годы облучение гипофиза проводится тяжелыми частицами (протонами), обладающими высокой энергией и проникающей способностью. Доза облучения — 8—10 тыс. рад однократно. В ряде случаев используют крио-деструкцию аденомы гипофиза, имплантацию в область аденомы радиоактивного иттрия (90-Y) или золота (198-Аи). Следует отметить, что, помимо отсроченной и недостаточной эффективности, лучевые воздействия на гипофиз нередко приводят к подавлению не только надпочечников, но и других желез внутренней секреции. Кроме того, эффективность адреналэктомии, как правило, выше. Поэтому правильнее рассматривать лучевую терапию области гипофиза лишь в качестве компонента комплексного лечения. Важным является и то, что у лиц, получавших лучевую терапию области гипофиза и впоследствии подвергнувшихся адреналэктомии, часто развиваются опухоли гипофиза. Медикаментозное подавление функции коры надпочечников достигается назначением препаратов, снижающих синтез прежде всего кортизола. Аминоглютетимид (ориметен, мамо-мит) назначают в дозе от 0,5 до 2 г/сут. Хлодитан начинают с суточной дозы 1—2 г и повышают ее ежедневно на 1 г каждую неделю до 8-12 г/сут. При наступлении эффекта дозу снижают наполовину. Курс лечения 48—50 дней (200—300 г препарата). Митотан назначают внутрь по 0,5 г 3—4 раза в день с постепенным увеличением дозы до 8—12 г/сут. При приеме перечисленных препаратов возможны осложнения (аллергические реакции, тошнота, рвота, головная боль, угнетение гемопоэза и др.), что ограничивает возможности их применения. Адреналэктомия. Хирургические вмешательства на надпочечниках являются основным методом лечения больных с синдромом Иценко—Ку-шинга. Первые операции были проведены Riche (1907) и Jandier (1908) и заключались в удалении опухоли коры надпочечника. Частичную резекцию обоих надпочечников при синдроме Иценко—Кушинга впервые выполнили в 1934 г. Walters, Wilder Jandier. Целью адреналэктомии при гиперкортицизме является достижение надпочечниковой недостаточности с последующей заместительной терапией кортикостероидами. Накопленный опыт операций на надпочечниках показал, что односторонние адреналэктомии при неопухолевой форме синдрома Иценко—Кушинга не приводят к надпочечниковой недостаточности. Эффект наступает лишь при двусторонних вмешательствах. Большинство хирургов выполняют двусторонние адреналэктомии в два этапа с интервалом в несколько недель или месяцев. Выбор стороны первоочередного вмешательства определяется результатами магнитно-резонансной томографии. При отсутствии асимметрии в размерах и характере изменений в надпочечниках одностороннюю адреналэктомию целесообразнее выполнять справа, как технически бо- лее сложную. Возможную в будущем операцию на левом надпочечнике будет выполнить проще. В случае явной асимметрии в размерах надпочечников адреналэктомия производится на стороне большего поражения. При решении вопроса об объеме вмешательства на надпочечниках необходим дифференцированный подход с учетом тяжести клинических проявлений у больных с неопухолевой формой синдрома Иценко—Ку-шинга. Оптимальные комбинации различных методов лечения конкретных групп больных с гиперкорти-цизмом предложены В.Н.Чернышевым (1998). При легкой тяжести заболевания оптимальной является комбинация односторонней тотальной адренал-эктомии с лекарственным подавлением функции коры надпочечников, причем вначале проводится медикаментозная терапия, затем удаляется надпочечник и после операции вновь проводится курс лечения депрессорами синтеза глюкокортикоидов. В случае необходимости он может быть повторен с последующим переходом к поддерживающим дозам лекарственных препаратов. В случае отсутствия ремиссии выполняют лучевую терапию гипофиза или удаляют второй надпочечник. Для больных со средней тяжестью клинических проявлений синдрома Иценко—Кушинга стойкого эффекта можно достичь при использовании следующей схемы: химиотерапия (аминоглютетимид, хлодитен, кето-кеназол, этомидат и др.) до операции, затем односторонняя адреналэктомия, аналогичная химиотерапия после операции в сочетании с лучевым воздействием на область гипофиза. При отсутствии ремиссии и прогрессиро-вании заболевания показано удаление второго надпочечника. Больным с тяжелой формой синдрома Иценко—Кушинга требуется быстрое и эффективное подавление гиперфункции коры надпочечников. Этим требованиям отвечает двусторонняя поэтапная, чаще тотальная адреналэктомия с минимальным перерывом. Химиотерапию вышеуказанными препаратами проводят короткими курсами как перед первой адреналэктомией, так и в промежутках между ними. В ряде случаев для смягчения отрицательных последствий двусторонней адреналэктомии эту операцию сочетают с аутотранс-плантацией части удаленной железы под кожу больного, что позволяет сохранить минимальное эндогенное поступление кортикостероидов. При односторонней адреналэктомии подготовка больного к операции должна быть направлена на коррекцию имеющихся эндокринно-об-менных нарушений и заключаться в назначении гипотензивных средств, препаратов калия. Удаление надпочечника лучше всего производить через внеполостной доступ с резекцией XI ребра, создающий оптимальные условия для всех манипуляций. После мобилизации железы, перевязки ее центральной вены и удаления обеспечивают тщательный гемостаз. Затем половину надпочечника фраг-ментируют на несколько частей, которые имплантируют в подкожную жировую клетчатку через отдельные короткие разрезы проксимальнее основной раны. Перед вторым этапом адреналэктомии для устранения или смягчения последствий острой надпочечниковой недостаточности необходима предоперационная подготовка, создающая гормональный фон для постепенного перехода в последующем на заместительную гормональную терапию. Ниже представлена одна из наиболее распространенных схем пред- и послеоперационной гормональной терапии: 1) за 1—2 дня до удаления второго надпочечника в/в или в/м вводят 100—200 мг гидрокортизона в сутки; 2) за 3—4 ч до начала операции также вводят 100—200 мг гидрокортизона; 3) в первые сутки после операции в/в каждые 3—4 ч вводят по 50—75 мг гидрокортизона; 4) на 2-е сутки — по 50—75 мг гидрокортизона каждые 6 ч; 5) 3-и сутки — по 50—75 мг гидрокортизона каждые 8 ч; 6) на 4-е сутки — та же доза, но через 12 ч; 7) на 5—6-е сутки после операции — 50—75 мг гидрокортизона один раз; 8) на 6-й и 7-й дни больного переводят на постоянный прием предни-золона по 5—10 мг/сут. В техническом отношении удаление второго надпочечника не имеет каких-либо особенностей. У больных с легкой и средней степенью тяжести клинических проявлений синдрома Иценко—Кушинга предпочтительнее субтотальная адреналэктомия. При тяжелой форме гиперкортицизма требуется тотальная адреналэктомия. У больных с кортикостеромами риск оперативных вмешательств существенно выше, чем даже при двусторонней адреналэктомии, из-за высокой частоты (более 50 %) злокачественного роста опухоли, сращений ее с окружающими тканями и органами. Кроме того, у этих больных эндок-ринно-обменные нарушения выражены наиболее резко, а гиперсекреция стероидных гормонов подавляет функцию и приводит к атрофии противоположного надпочечника. Риск развития острой надпочечниковой недостаточности и тяжелых осложнений в таких случаях наиболее высок. Подготовка больных с кортикос-теромой к предстоящему оперативному вмешательству аналогична таковой при тотальной адреналэктомии. Оптимальными доступами для удаления опухолей надпочечников являются внеполостной разрез с резекцией XI ребра (при кортикостеро-мах небольшого или среднего, не более 5—6 см, размера) и торакофрено-люмботомия в десятом межреберье (при опухолях большого диаметра). Следует подчеркнуть, что использование широких полостных доступов увеличивает риск гнойных осложнений со стороны раны вследствие имеющихся у этих больных резких эндокринно-обменных нарушений. Особенно нежелательна с этой точки зрения лапаротомия. Использование торакофренолюмботомии при удалении больших кортикостером оправдано тем, что этот разрез дает большую свободу манипуляций по выделению опухоли под визуальным контролем. Большие, особенно злокачественные опухоли тесно спаяны с воротами и сосудами почки, печенью, селезенкой и нижней полой веной, что затрудняет выделение и удаление пораженного надпочечника с опухолью. Перевязка центральной вены надпочечника и отделение опухоли от нижней полой вены являются наиболее ответственными этапами операции, после чего удаление опухоли значительно облегчается. Операцию заканчивают дренированием ложа опухоли и плевральной полости. Послеоперационный период. После односторонней адреналэктомии заместительной гормональной терапии обычно не требуется. Для профилактики гнойно-септических осложнений назначают антибиотики. Ранняя активизация больных предупреждает тромботические и легочные осложнения. При тотальной адреналэктомии необходима заместительная гормональная терапия по схеме, описанной выше. Нестабильность гемодинамики корригируется увеличением дозы кортикостероидов и назначением вазопрессоров. В случае недостаточного эффекта от введения гидрокортизона дополнительно назначают дезоксикортикостерона ацетат по 10—15 мг/сут в/м. Введение большого количества физиологического раствора и аскорбиновой кислоты позволяет достичь более быстрого разрешения острой надпочечниковой недостаточности. После удаления кортикостером вероятность развития острой надпочечниковой недостаточности значи- тельно выше вследствие резкой атрофии противоположного надпочечника. Как правило, восстановление его функции занимает несколько месяцев, в течение которых требуется назначение небольших поддерживающих доз глюкокортикоидов (обычно преднизолон до 5 мг/сут). Обязательны антибиотикотерапия, профилактика легочных осложнений, коррекция уровня калия и сахара крови при наличии стероидного диабета. Результаты хирургического лечения. Летальность и частота осложнений после операций на надпочечниках находятся в прямой зависимости от продолжительности выраженных гормональных нарушений. Это подчеркивает необходимость возможно более раннего выявления и хирургического лечения больных с различными формами синдрома Иценко— Кушинга. После односторонней ад-реналэктомии летальность обычно минимальна и зависит от случайных причин. Результаты двусторонних ад-реналэктомий значительно хуже, что связано с обычной тяжестью эндок-ринно-обменных нарушений и наличием осложнений у подобных больных. Показатели летальности у большинства авторов не превышают 5 %. При удалении злокачественных кортикостером летальность также высока и составляет 3,4—19 %, что объясняется как значительной тяжестью исходного состояния больных, так и нередкими осложнениями во время операции. В среднем у каждого пятого больного с синдромом Иценко—Кушинга в послеоперационном периоде развиваются раневая и полостная инфекция, достигая 70 % в структуре всех послеоперационных осложнений. Отдаленные результаты изолированной односторонней адреналэкто-мии при гипофизарной форме синдрома Иценко—Кушинга в сравнении с длительным медикаментозным подавлением стероидогенеза значительно лучше и позволяют достичь ремиссии заболевания почти у половины больных. При дополнительном облучении гипофиза ремиссия наступает у 60—70 % больных. Наилучшие отдаленные результаты в этой группе больных наблюдаются после поэтапной двусторонней адреналэк-томии, приводящей к полному регрессу имевшихся эндокринно-обменных нарушений. Необходимая в таких случаях постоянная заместительная терапия значительно упрощается при аутотрансплантации части надпочечника в подкожно-жировую клетчатку в зоне операционного доступа. Это позволяет снизить количество принимаемых кортикостероидов в 2—3 раза. У больных с синдромом Иценко— Кушинга, обусловленным кортикос-теромой, отдаленные результаты определяются характером роста опухоли. Удаление доброкачественных кортикостером быстро, особенно у детей, приводит к исчезновению всех эндокринно-обменных нарушений и полной нормализации состояния больных. При злокачественных кор-тикостеромах после временного улучшения обычно через 1—1,5 года появляются рецидив опухоли и ее метастазы. Повторные вмешательства неэффективны. Литература Балаболкин М.И. Эндокринология. — М., 1998. - 582 с. Зографски С. Эндокринная хирургия. — София, 1977. - 525 с. Старкова Н.Т. (ред.). Руководство по клинической эндокринологии. — СПб., 1996. Торгунаков А. П. Псевдофеохромоцитома. — Кемерово, 1990. - 190 с. Чернышев В.Н. Артериальная гипертензия в практике хирурга и терапевта. — Самара, 1998. - 256 с. Дата добавления: 2015-02-06 | Просмотры: 1152 | Нарушение авторских прав |