|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Классификация моногенных и мультифакторных заболеваний человека и их молекулярная основаЗдоровье, или предрасположенность к различным заболеваниям, в значительной мере зависит от генетических особенностей человека. В бывшем Советском Союзе развитие медицинской генетики связывалось с именем академика Н.П.Бочкова, создателя Института медицинской генетики АМН СССР (ныне Медико-генетический научный центр РАМН). Успешное завершение международного проекта «Геном человека», расшифровка структуры генома человека и целого ряда других организмов открыли недоступные ранее возможности для понимания молекулярных основ наследственных болезней, разработки новых стратегий диагностики и лечения. На рисунке 1 показано огромное количество генов, участвующих в развитии и функционировании органов и тканей человека. Неполадки в каждом из них могут привести к тяжелым, иногда смертельным наследственным заболеваниям(hereditary diseases). В настоящее время известно пять тысяч наследственных заболеваний, из них две тысячи представляют собой тяжелые расстройства, приводящие к инвалидности. Подробности о многих заболеваниях и их молекулярно-генетических особенностях можно найти в разделе «Генетика» Базы знаний по биологии человека HUMBIO, которая создана и поддерживается Институтом молекулярной генетики РАН. До недавнего времени были изучены главным образом моногенные болезни, т.е. возникающие при нарушении работы одного гена. Сегодня их известно более тысячи – от них страдает в общей сложности около 5% новорожденных. Однако большинство наследственных болезней связаны с одновременным нарушением работы нескольких генов и определенными воздействиями внешней среды – их называют мультифакторными болезнями. В той или иной мере наследственные особенности определяют восприимчивость организма или его устойчивость относительно большинства заболеваний, в том числе инфекционных. Поэтому здоровье или болезнь – фактически результат взаимодействия наследственных задатков и среды. Геномные исследования позволяют выявлять предрасположенность к ряду патологий на любой стадии развития организма, что расширяет объем пресимптоматической, дородовой и преимплантационной (предшествующей внедрению зародыша в матку) диагностики. Для этого проводится анализ ДНК, получаемой обычно из крови или других биологических образцов индивида.
Рисунок 1 – Количество генов, вовлеченных в развитие и функционирование органов и тканей человека. Наследственные заболевания обусловлены хромосомными перестройками и генными мутациями. У человека различают наследственные заболевания с полным проявлением мутации (все хромосомные и некоторые генные) – синдром Дауна, гемофилия А, В, С, фенилкетонурия и др.; с неполным (зависящим от условий среды) проявлением мутаций – некоторые формы диабета, подагра и др.; возникающие из-за внешних факторов, но обусловленные генетической предрасположенностью к ним – аллергия, атеросклероз, рахит и др. Среди генных наследственных заболеваний выделяют моногенные и полигенные (мультифакторные), а среди моногенных различают формы с разным типом наследования (аутосомно-доминантные, аутосомно-рецессивные, доминантные сцепленные с полом и рецессивные сцепленные с полом). Доля наследственных составляет около 10% всех заболеваний человека. Хромосомные болезни – это группа болезней, в основе развития которых лежат нарушения числа или структуры хромосом, возникающие в гаметах родителей или на ранних стадиях дробления зиготы. История изучения хромосомных болезней берет начало с клинических исследований, проводившихся задолго до описания хромосом человека и открытия хромосомных аномалий. В частности, к ним относятся болезнь Дауна (трисомия 21), синдромы Тернера (трисомия 18), Клайнфелтера, Патау (трисомия 13), Эдвардса. В настоящее время описано два варианта нарушений числа хромосомных наборов – тетраплоидия и триплодия. Другая группа синдромов обусловлена нарушениями числа отдельных хромосом – трисомиями (когда имеется добавочная хромосома в диплоидном наборе) или моносомиями (одна из хромосом отсутствует). Моносомии аутосом несовместимы с жизнью. Трисомии – более часто встречающаяся у человека патология. Ряд хромосомных болезней связан с нарушением числа половых хромосом. Самая многочисленная группа хромосомных болезней – это синдромы, обусловленные структурными перестройками хромосом. Выделяют хромосомные синдромы так называемых частичных моносомий (увеличение или уменьшение числа отдельных хромосом не на целую хромосому, а на ее часть). Моногенные заболевания. Рассмотрим некоторые наиболее часто встречающиеся моногенные болезни, т.е. болезни, возникающие в результате нарушения работы одного гена. При фенилкетонурии мутации нарушают работу гена, контролирующего превращение аминокислоты фенилаланина в тирозин. Болезнь развивается, когда ребенок получает поврежденный ген от обоих родителей. Если один из пары генов нормален, человек остается здоровым. Сегодня частота появления фенилкетонурии (т.е. мутаций в обеих копиях гена) составляет 1 на 10–17 тыс. рождений, а частота скрытого носительства болезнетворного аллеля – 1 на 100. Поскольку эта патология встречается достаточно часто, всех новорожденных тестируют на фенилкетонурию. Вовремя назначенная специальная диета может предотвратить болезнь или облегчить ее течение. У каждого народа свой спектр характерных мутаций. Например, в Волго-Уральском регионе России фенилкетонурия особенно часто встречается среди русских. Большинство случаев заболевания вызвано одной и той же мутацией, привнесенной сюда переселенцами из Северной Европы. В семьях других национальностей фенилкетонурия вызывается несколькими различными мутациями. При аутосомно-рецессивном заболевании – болезни Вильсон–-Коновалова – из-за мутаций в гене, связанном с обменом меди, в организме накапливается медь. В результате ее токсического воздействия поражаются печень и головной мозг. Заболевание долгое время протекает скрытно, ранние проявления весьма многообразны, что затрудняет его выявление. Болезнью Вильсона–Коновалова страдают во всем мире, причем некоторые народы особенно часто. Так, у евреев ашкенази ее частота в 30 раз превышает среднемировую. В настоящее время известно более 70 различных мутаций, приводящих к этой патологии. В некоторых этнических группах, наряду с широко известными, можно обнаружить “молодые” мутации, свойственные только им. Например, у представителей татарской национальности выявлена мутация, которая нигде больше не встречается. Молекулярно-генетический анализ позволил предположить ее тюркские корни. Этнические особенности обнаружены в спектре и частоте мутаций для такой тяжелой патологии, как муковисцидоз. У представителей белой расы – это одно из самых распространенных моногенных заболеваний. Изменения в гене белка, участвующего в переносе ионов хлора через клеточную мембрану, приводят к нарушению секреции эндокринных желез с поражением дыхательного и желудочно-кишечного трактов. В Башкортостане выявлено девять связанных с муковисцидозом мутаций, а всего в мире их описано более тысячи. В Волжско-Уральском регионе “европейская” мутация найдена у русских и татар, а “тюркская” – у татар и башкир. Большинство моногенных мутаций проявляется на самых ранних этапах развития – в детстве или даже во внутриутробном периоде. При болезнях плода чаще всего нарушается работа белков, регулирующих одновременно множество генов (факторов транскрипции). На первом году жизни наиболее часты нарушения, связанные с обменом веществ. Однако некоторые генетические дефекты могут не проявляться до глубокой старости. Например, в генах белков пресениллинов (PS) найдены мутации, приводящие к болезни Альцгеймера – одной из форм старческого слабоумия. А встраивание избыточных тринуклеотидных повторов в “гентингтон”-ген связано с другой болезнью, также проявляющейся в преклонном возрасте, – хореей Гентингтона.
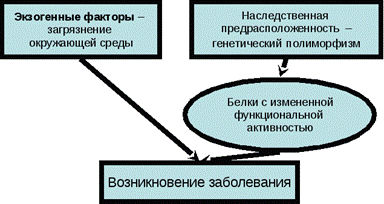
Рисунок 2 – Факторы развития мультифакторных заболеваний Как видим, предрасположенность к мультифакторным болезням возникает тогда, когда нарушена регуляция различных систем – нейроэндокриных, иммунны х, обмена веществ, – в том числе обезвреживания чужеродных веществ (так называемых систем трансформации-детоксикации ксенобиотиков). Отметим, что в организме ксенобиотики разлагаются в два этапа: сначала подвергаются ферментативной модификации, а лишь затем промежуточные метаболиты превращаются в растворимые безвредные соединения и выводятся. При этом промежуточные метаболиты могут отличаться более высокой мутагенной и онкогенной активностью, чем сами ксенобиотики или конечные продукты их разложения. Различные варианты генов, кодирующих ферменты системы детоксикации, определяют скорость их работы. В частности, при сниженной активности детоксификационной функции плаценты (фермента плацентарной глютатион-метионинтрансферазы, GSTM1) возрастает риск ранних спонтанных абортов. Генетически детерминированная активность глютатионтрансфераз влияет и на развитие различных форм рака. Например, сочетание определенных мутаций увеличивает риск рака груди у женщин в 3–10 раз, а у курильщиц – в 40 раз. В лаборатории моделирования генетических процессов Института генетики и цитологии НАН Беларуси кандидаты биологических наук Э.В.Крупнова и Н.Н.Чакова в рамках заданий ГКПНИ «Биологическая инженерия и биобезопасность» и ГП «Биотехнология» ведут паспортизацию по молекулярному маркеру GST в целях диагностики наследственной предрасположенности к заболеваниям органов дыхания. Заболеваемость органов дыхания различного происхождения у взрослого и детского населения неуклонно возрастает во всем мире. Данная патология является лидирующей: · по количеству дней нетрудоспособности; · инвалидности; · смертности (четвертое, пятое места) Анализ полиморфизма GST-генов осуществлялся с использованием метода мультиплексной ПЦР. Гомозиготность по «нулевым аллелям» генов GSTT1 и GSTM1 определяли по отсутствию на электрофореграммах фрагментов амплификации размером 480 и 215 п.н. соответственно. Таким образом, при изучении полиморфизма GST-генов у больных так называемым немелкоклеточным раком легкого (НМРЛ) в белорусской популяции выявлено: · частота встречаемости нулевых генотипов GSTM1(-) и GSTT1(-) составляет 36,7 и 26,7% соответственно; · генотип GSTT1(-) в группе некурящих больных встречался со статистической достоверностью в 1,5 раза чаще (36,4%), чем у курящих пациентов (23,7%). Совместно с генетиками Республиканского научно-практического центра «Мать и дитя» начато изучение полиморфизма GST-генов у детей Беларуси с целью разработки технологии выявления наследственной предрасположенности к заболеваниям органов дыхания различной этиологии. Планируется провести анализ делеционного полиморфизма в генах системы детоксикации у новорожденных, у детей, страдающих бронхиальной астмой, у детей с хроническим обструктивным бронхитом, а также у здоровых детей того же возраста и определить частоту встречаемости нулевого генотипа в этих когортах. Эффективность лечения различными препаратами также связана с состоянием генов. Например, лечение эндометриоза (заболевания, встречающегося почти у 10% женщин белой расы) широко используемым препаратом циклофероном у части больных безрезультатно по причинам генетического характера. Наши исследования также позволят прогнозировать чувствительность пациентов к лекарственным препаратам различных фармакологических групп, в метаболизме которых участвуют глутатион-S-трансферазы, что поможет индивидуализировать медикаментозную терапию и снизить риск побочных эффектов. К настоящему времени на хромосомах человека картировано около 800 генов, мутации которых приводят к различным наследственным заболеваниям. Количество моногенных заболеваний, для которых известна локализация контролирующего гена, еще больше и приближается к 950 за счет существования аллельных серий, т.е. групп болезней, клинически сильно отличающихся, но обусловленных мутациями в одном и том же гене. Среди них гены, обусловливающие предрасположенность к остеопорозу (VDR-3), дефектам заращения нервной трубки (ДЗНТ), коронарной болезни сердца (КБС) и атеросклерозу (MTHFR), инфаркту миокарда (АСЕ), атеросклерозу (АроЕ), аденоме и раку простаты (AR), диабету (IDDM-1 и -5), астме (СС16) и др. Известны также онкогены (Ras, Miс) и антионкогены (p53), мутации которых с большой вероятностью ведут к различным опухолям. Уже идентифицированы гены, мутации которых не только предрасполагают, но и с большой вероятностью вызывают серьезные заболевания (BRCA1, BRCA2 – рак молочной железы, PS-1, PS-2 – болезнь Альцгеймера и др.). Быстро увеличивается и список наследственных болезней с поздней манифестацией, для которых вполне реальна ранняя досимптоматическая диагностика в любом возрасте (хорея Гентингтона, другие нейродегенеративные заболевания, рак толстой кишки, щитовидной железы и др.). Наконец, уже сегодня можно выявлять гетерозиготное носительство наиболее частых смертельных наследственных болезней в семьях высокого риска (муковисцидоз, миодистрофия Дюшена, фенилкетонурия, синдром Мартина–Белла, гемофилия, спинальная мышечная атрофия, адреногенитальный синдром). Очень важно, что эти и многие другие тяжелые наследственные недуги с успехом диагностируются уже пренатально, что позволяет выявить возможность рождение больных детей. Дата добавления: 2014-12-11 | Просмотры: 2615 | Нарушение авторских прав |