|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
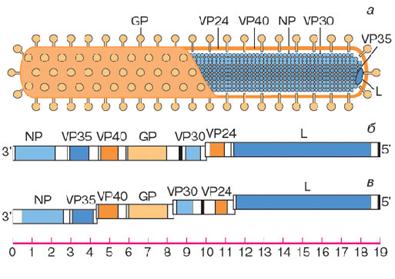
Возникающие» вирусные инфекции (вирусы Эбола, Денге, Хантаан и др.), их свойства и распространениеРечь пойдет в основном о геморрагических лихорадках – группе острых вирусных природно-очаговых болезней, характерным проявлением которых является повышенная кровоточивость. Возбудители геморрагических лихорадок относятся к различным семействам РНК-содержащих вирусов. Все болезни этой группы характеризуются способностью к распространению и тяжелым течением, относятся к опасным и особо опасным инфекционным заболеваниям. В настоящее время в группу геморрагических лихорадок включено 15 болезней, в том числе лихорадки Эбола, Марбург, Ласса, желтая лихорадка, геморрагическая лихорадка Денге, лихорадка долины Рифт и др. Это семейство филовирусов, поражающих человека и обезьян, получило название от латинского слова "filamentous" – длинный, протяженный – в связи с уникальной для вирусов человека формой их вирионов в виде длинных цилиндрических палочек. Семейство в настоящее время собираются разделить на два вида: Эбола-вирусы и Марбург-вирусы. Вирус Эбола. Этот вирус был идентифицирован в 1976 г., когда одновременно вспыхнули две эпидемии: на юге Судана (284 случая, летальность 53%) и на севере Заира (318 случаев, летальность 88%). Серологические тесты показали, что два штамма, заирский и суданский, не были одинаковыми. Свое имя вирус получил от реки Эбола, впадающей в реку Конго. Эпидемия вспыхнула в 55 деревнях, прилежащих к реке, и внезапно прекратилась. Другой штамм вируса Эбола был выделен в 1989 г. во время вспышки инфекции в обезьяньем питомнике в Рестоне, США. Обезьяны были привезены с Филиппинских островов. Четыре сотрудника американского питомника и четыре – филиппинского были серопозитивными, но ни у кого из них не развилась геморрагическая болезнь. Этот рестонский штамм вируса Эбола, или вирус Рестон, по-видимому, является высокопатогенным для обезьян, но не для человека. Сродни Эбола – вирус Марбург, который впервые проявился на девять лет раньше, еще в 1967 г. в Европе (Югославия и Германия – города Марбург и Франкфурт), куда был перенесен на обезьянах, завезенных из Уганды (район оз. Виктория). Заболели работники фармацевтических заводов, участвовавшие в заборе почек у экспортированных обезьян. Всего заболел 31 человек, из которых семеро умерли. Лишь вирус бешенства, дальний родственник филовирусов, превосходит их по смертности, достигающей в случае вируса Эбола практически 100% – при попадании в кровь и отказе или невозможности срочно ввести вакцину. Вирионы этого семейства многообразны по форме, встречаются сигмообразные, U-образные формы, однако основной является палочковидная форма с диаметром 80 нм и длиной от 790 нм (вирус Марбург) до 970 нм (вирусы Эбола и Рестон). При рассмотрении их поперечных срезов в электронном микроскопе обнаруживаются внутренний нуклеокапсид (комплекс нуклеиновой кислоты с белками, в основном белком NP) диаметром 50 нм, окруженный липидной оболочкой, и внутреннее пространство с малой электронной плотностью диаметром 20 нм. Такие параметры предполагают спиральную форму нуклеокапсида с пустой сердцевиной, что подтверждается и видимой продольной периодичностью вирионов с шагом 5 нм. На поверхности вирионов, образованной липидной оболочкой, которую вирус заимствует у клетки-хозяина, можно видеть шипы длиной 10 нм. В состав вирионов входят все кодируемые геномом вируса белки, что является обычным для большинства вирусов с негативным РНК-геномом. Генетический материал вируса представлен одноцепочечной неинфекционной РНК негативной полярности, что означает неспособность этой цепи РНК выступать в качестве матрицы для синтеза белка. РНК имеет молекулярную массу 4,2·106дальтон, что соответствует длине примерно в 19200 нуклеотидов и 1,1% массы всего вириона. Полные нуклеотидные последовательности геномов вирусов Эбола и Марбург определены несколько лет назад российскими, германскими и американскими учеными. В плюс-цепи РНК (она комплементарна геномной РНК) выявлены семь рамок трансляции белков. Строение генома вируса Марбург приведено на рисунке 12. Оно сходно со строением геномов вирусов бешенства и кори, однако имеет некоторые особенности.
Рисунок 12 – Схема строения вириона филовируса (а), карта генома вируса Марбург (б) и карта генома вируса Эбола (в) Примечание. На схеме устройства вириона показано, что РНК находится в составе нуклеокапсида (или "ядра" вируса) и связана с белками NP и VP30, а белки VP40, VP24 и GP связаны с липидной мембраной. При этом основным поверхностным белком является белок GP, который образует шипики на поверхности вириона. Масштабная линейка для карты генома проградуирована в тысячах нуклеотидов
Каждый белок филовирусов кодируется своей собственной матричной РНК. В свою очередь эти матричные РНК считываются с минус-цепи вирионной РНК с помощью вирусспецифической РНК-полимеразы, кодируемой геном L.
До недавнего времени не было ничего известно о способе проникновения этих вирусов в клетки. Однако Марк Голдсмит из университета Калифорнии и его коллеги провели исследование, в ходе которого выяснили, что возможным путем проникновения вирусов в клетку может быть молекула, расположенная в оболочке клетки и отвечающая за улавливание фолиевой кислоты (витамина группы В), влияющей на рост и развитие. Многие клетки человеческого организма обладают специальными рецепторами, которые улавливают этот витамин. Эксперименты, проведенные учеными, показывали, что гликопротеины, окружающие вирус Эбола и вирус Марбург, могут соединяться с одним из видов этого рецептора, позволяя вирусу проскользнуть в клетку. Азок Энтони из университета Индианы предполагает, что рецепторы "открываются" для проникновения вируса тогда, когда в организме не хватает фолиевой кислоты, как это нередко случается у людей, живущих в развивающихся странах. Это ведет к тому, что при недостатке витамина в организме остается много свободных рецепторов, а соответственно и много мест для проникновения вируса. М.Голдсмит сомневается в применимости больших доз фолиевой кислоты для тех людей, которые находились в контакте с вирусами, для профилактики заболеваний. Вместо этого он предлагает метод, пока разработанный только в лабораторных условиях –применить антитела, которые созданы для того, чтобы занимать рецепторы фолиевой кислоты, тем самым заблокировав для вирусов вход в клетки. Еще один возможный способ предотвращения заболевания, который может быть разработан на основе результатов этого исследования, состоит в том, чтобы ввести в организм свободные рецепторы-приманки, которые смогут улавливать вирус, предотвращая его проникновение в клетки. По мнению А.Энтони, этот способ может оказаться эффективным, однако возникает проблема удаления вирусов из крови. В любом случае необходимо убедиться, что не пострадают другие уязвимые рецепторы. Вирус Денге (Dengue). Лихорадка Денге (по другому называется костоломной или суставной лихорадкой) существует в двух самостоятельных клинических формах:
Источником инфекции служат больной человек, обезьяны и, возможно, летучие мыши. Возбудитель, выделенный и описанный А.Себином в 1945 г., как и возбудитель желтой лихорадки относится к вирусам семейства Togaviridae рода Flavivirus (арбовирусы антигенной группы В), которые содержат РНК, имеют двухслойную липидную оболочку из фосфолипидов и холестерола, размеры вириона 40–45 нм в диаметре. Инактивируется при обработке протеолитическими ферментами и при прогревании выше 60°С, под влиянием ультрафиолетового облучения. Известно четыре типа вируса Денге, различных в антигенном отношении. Вирусы Денге имеют антигенное родство с вирусами желтой лихорадки, японского и западно-нильского энцефалитов; размножается на культурах тканей и клетках почек обезьян, хомяков и др. В сыворотке крови больных вирус сохраняется при комнатной температуре до двух месяцев, а высушенный – до пяти лет. Передача инфекции человеку осуществляется комарами Aedes aegypti, обезьянам – A. albopictus. Комар A. aegypti становится заразным через 8–12 дней после питания кровью больного человека и остается инфицированным до трех месяцев и более. Болезнь распространена в тропическом и субтропическом поясах Америки, Африки, Азии и Австралии. Первые эпидемии лихорадки Денге зафиксированы в Северной Америке в 1780-х гг. В 1779 г. болезнь была идентифицирована и поучила свое имя. Пандемия началась в 1950-х годах в Юго-Восточной Азии и продолжалась до 1975 г. За последние 10–15 лет наблюдается значительное повышение этой заболеваемости в различных регионах. Сообщалось о значительных вспышках лихорадки Денге в КНР, Вьетнаме, Индонезии, Таиланде и на Кубе.
Вирус проникает в организм через кожу при укусе человека зараженным комаром. На месте ворот инфекции через три–пять дней возникает ограниченное воспаление, где происходит размножение и накопление вируса. В последние 12 часов инкубационного периода отмечается проникновение вируса в кровь. Вирусемия продолжается до третьего–пятого дня лихорадочного периода. Денге может протекать в классической и геморрагической формах. Строгой зависимости между типом вируса и клинической картиной не отмечается. От больных так называемой филиппинской геморрагической лихорадкой выделялись вирусы Денге второго, третьего и четвертого типов, при сингапурской геморрагической лихорадке – все четыре типа, при оценке этиологии таиландской геморрагической лихорадки одно время писали о новых типах вируса денге (пятом и шестом). В дальнейшем наличие этих типов вируса не было подтверждено. В настоящее время установлено, что геморрагическая лихорадка Денге и шоковый синдром Денге могут вызывать все четыре серотипа вируса Денге. В патогенезе заболевания особо важную роль играет внедрение в организм человека вирусов первого, третьего или четвертого серотипов, за которым через несколько лет следует и второй серотип. В развитии геморрагической лихорадки денге особое значение имеют иммунологические факторы. Усиленный рост вируса Денге второго серотипа происходит в мононуклеарных фагоцитах, полученных из периферической крови иммунизированных доноров или в клетках неиммунизированных доноров в присутствии субнейтрализующих концентраций вируса Денге или перекрестных гетеротипичных антител к флавовирусам. Комплексы вирус-антитело присоединяются, а затем внедряются в мононуклеарные моноциты с помощью Fc-рецепторов. Активная репликация вируса в этих клетках может приводить к серии вторичных реакций (активация комплемента, системы кинина и др.) и к развитию тромбогеморрагического синдрома. Таким образом, геморрагические формы возникают в результате повторного инфицирования местных жителей или при первичном инфицировании новорожденных, получивших антитела от матери. Интервал между первичным (сенсибилизирующим) и повторным (разрешающим) заражением может колебаться от трех месяцев до пяти лет. При первичной инфекции любым типом вируса возникает классическая форма Денге. Впервые прибывающие в эндемический очаг заболевают только классической формой Денге. Симптомы и течение. Инкубационный период длится от трех до пятнадцати дней (чаще пять–семь дней). Заболевание обычно начинается внезапно. Лишь у отдельных больных за шесть–десять часов отмечаются нерезко выраженные продромальные явления в виде разбитости и головной боли. Часто в период якобы полного здоровья появляются озноб, боли в спине, крестце, позвоночнике, суставах (особенно коленных). Лихорадка наблюдается у всех больных, температура тела быстро повышается до 39–40°С. Отмечаются резкая адинамия, анорексия, тошнота, головокружение, бессонница; у большинства больных – гиперемия и пастозность лица, отекание сосудов склер, гиперемия зева. Вирусы Хантаан. Острое вирусное природно-очаговое заболевание, сопровождающееся поражением почек, впервые описано советскими исследователями на Дальнем Востоке в 1935–1940 гг. Заболевание получило название «геморрагический нефрозо-нефрит». В это же время подобное заболевание было описано японскими и шведскими исследователями, изучавшими его в Маньчжурии. Первый вирус, этиологически связанный с этими заболеваниями, был описан только в 1978 г. (вирус Корейской геморрагической лихорадки – вирус Хантаан). Установлена его этиологическая связь со вспышкой заболевания, произошедшей в 1951 г. среди 3000 корейских солдат. Тогда смертность от инфекции составила 15%. Как отдельный род в семействе буньявирусоввирус Хантаан (Hantavirus), был выделен в 1987 г. Как и его серологические родственники морфологически и по молекулярной организации подобен другим представителям семейства. Они относятся к сферическим РНК-содержащим вирусам диаметром 85–110 нм, однако характеризуются отсутствием серологических связей с другими членами семейства, наличием уникальных 3'-концевых последовательностей в трех долях генома и собственной стратегией кодирования. Вирус инактивируется при температуре 50°С в течение 30 мин, при 0–4 °С стабилен 12 часов. В настоящее время охарактеризованы шесть хантавирусов. Наиболее изученными являются вирусы Хантаан, Сеул и Пуумала. Заболевания, вызываемые этими вирусами, называли геморрагическим нефрозо-нефритом, Корейской геморрагической лихорадкой, эпидемической геморрагической лихорадкой, эпидемической нефропатией. В 1983 г. для этих заболеваний ВОЗ приняла единое название – геморрагическая лихорадка с почечным синдромом (ГЛПС). Клинические проявления инфекции хорошо охарактеризованы. Выделены пять стадий инфекции:
Выделены серьезные и умеренные формы ГЛПС. Серьезные формы ГЛПС, вызываемые вирусом Хантаан, распространены в сельских районах Кореи, Китая, восточной части России. Умеренные формы связанны с вирусом Сеул и широко распространены в Азии и Европе. Антитела к этому вирусу обнаружены у крыс и людей на Североамериканском континенте, однако заболеваний не зарегистрировано. Наиболее умеренная форма ГЛПС, вызываемая вирусом Пуумала, распространена повсеместно, в том числе и на территории бывшего СССР. Носителями вируса являются грызуны. Каждый хантавирус инфицирует определенного грызуна: вирус Хантаан – желтогорлую мышь (Apodemus), Пуумала – полевок (Clethrionomys), Сеул – крыс (Rattus). Это ограничивает возможность пересортировки генов и генетического смешения, следствием чего является высокая степень геномного сохранения. Различают три основные эпидемиологические формы ГЛПС – сельский тип (связан с вирусами Хантаан и Пуумала), городской тип (связан с вирусом Сеул) и лабораторный тип (связан с инфицированием лабораторных животных-грызунов). Заражение людей является результатом прямого контакта с экскретами инфицированных грызунов при употреблении загрязненных продуктов питания. Кроме того, заражение может произойти аэрогенно при лесных, сельскохозяйственных и садово-огородных работах. 4.3 Возможные причины появления новых и возникающих вирусных инфекций Несмотря на многолетнее изучение рассмотренных вирусных инфекций в ведущих лабораториях мира, до сих пор не удалось найти ответа на многие связанные с ними вопросы:
Ответы на вопросы ученые целенаправленно ищут много лет, но окончательных результатов до сих пор нет. Кроме того, набор довольно странных обстоятельств, сопутствовавших началу эпидемий в Африке, придал ореол мистики всему, что связано с этими вирусами. Может быть, именно поэтому полудокументальная книга о вирусах Ричарда Престона "Горячая зона" стала бестселлером в США в 1994 г., а снятый по ее мотивам фильм "Эпидемия" – одним из лидеров видеопроката во всем мире. Некоторые исследователи считают, что возникновение вирусов, подобных ВИЧ, Эбола, является следствием разрушения экосистемы тропических лесов. Все вирусы возникали там, где экосистема была нарушена, особенно это относится к тропическим лесам – самым большим резервуарам жизни на планете. «Вырываясь из лесов, вирус проносится сквозь человечество, как эхо от криков умирающей природы», – говорится в одной интернет-статье.
Вызывает опасение тот факт, что инфекции такого рода привлекают внимание военных биологов и потенциальных биотеррористов. Отсутствие средств эффективной профилактики и защиты против целой серии геморрагических лихорадок сочетается с достаточно высокой смертностью, легкостью распространения боевых рецептур (распыление). К счастью, вирусы культивировать труднее, чем бактерии, поэтому пока не приходится опасаться производства вирусов геморрагических лихорадок в промышленных масштабах.
Вопросы для проверки усвоения материала 1 Что такое ВИЧ? Какова его роль в развитии СПИДа? 2 Как тестируется ВИЧ-инфекция? Какие методы при этом используются? 3 Какие стадии развития ВИЧ-инфекции выделяют в настоящее время? 4 Что такое гепаптит? На какие группы разделяются все вирусные гепатиты? 5 Каковы основные особенности вируса гепатита С? 6 Что такое гепатит GB? 7 С какими вирусами связана герпетическая инфекция? 8 Каковы основные характеристики герпесвирусов 6, 7, 8? 9 Что понимают под атипичной пневномией? 10 Какие средства используются при лечении САРС? 11 Что такое геморрагичские лихорадки? С каким семейством вирусов они связаны? 12 Когда и как был открыт вирус Эбола и его разновидности Марбург и Рестон? 13 Каковы основные симптомы заражения вирусом Денге? Как осуществляется передача инфекции человеку? 14 С какими регионами связана лихорадкеа Денге? 15 Какие заболевания вызывает вирус Хантаан? 16 Каковы клинические проявления геморрагической лихорадки с почечным синдромом? 17 С какими вирусами связаны серьезные и умеренные формы ГЛПС?
18 Каковы возможные причины появления новых и возникающих вирусных инфекций?
2 Описать роль систем трансформации-детоксикации ксенобиотиков в формировании предрасположенности к мультифакторным заболеваниям. 3 Дать характеристику митохондриальных болезней. 4 Осветить работы РНПЦ «Мать и дитя» в области медицинской генетики. 5 Охарактеризовать методы молекулярной диагностики. 6 Дать анализ роли предымлантационной диагностики при использовании метода экстракорпорального оплодотворения. 7 Описать основные этапы открытия явления РНК-интерференции. 8 Охарактеризовать перспективы использования РНК-интерференции в медицинской практике. 9 Подготовить электронную презентацию на тему «Вирусы природные и компьютерные: сравнительная характеристика». 10 Охарактеризовать современные, перспективные и гипотетические методы борьбы с ВИЧ-инфекцией. 11 Проанализировать работы белорусских вирусологов по изучению происхождения новых и возникающих вирусных инфекций. 12 Подготовить реферат на тему «Проблемы биотерроризма». * Патрушев, Л.И. Экспрессия генов. / Л.И. Патрушев. – М.: Наука, 2000. – 527 с. ** Горбунова, В.Н., Баранов, В.С. Введение в молекулярную диагностику и генотерапию наследственных заболеваний. / В.Н.Горбунова [и др.]. – СПб.: Специальная литература, 1997. – 287 c. ** Горбунова, В.Н. Молекулярные основы медицинской генетики. / В.Н.Горбунова. под ред. Е.И.Шварца. – СПб.: Интермедика, 1999. ** Дыгало, Н.Н. Анализ функции генов в мозге сиквенс-специфическими воздействиями на мРНК. / Н.Н.Дыгало. // Вестник ВОГиС. 2006. Т. 10, № 2. С. 352–365. ** Нетесов, С.В. Вирусные гепатиты. / В.Н.Нетесов. // Соросовский образовательный журнал. 1997. № 2. С. 35–43. ** Сукерник, Р.И., Дербенева, О.А., Стариковская, Е.Б., Володько, Н.В., Михайловская, И.Е., Бычков, И.Ю., Лотт, М.Т., Браун, М.Д., Уоллес, Д. Митохондриальный геном и митохондриальные болезни человека. / Р.И.Сукерник [и др.]. // Генетика. 2002. Т.38, № 2. С.161–170. ** Хуснутдинова, Э.К., Боринская, С.А. Геномная медицина – медицина XXI века. / Э.К. Хуснутдинова [и др.]. // Природа. 2002. № 12. С. 3–8. ** Dallas, A., Vlassov, A.V. RNAi: a novel antisense technology and its therapeutic potential. / A.Dallas [e.a.]. // Medical Science Monitoring. 2006. Vol. 12, № 4. P. 67–74. ** Kim, V.N. Small RNAs: classification, biogenesis, and function. / V.N.Kim // Molecules and Cells. 2005. Vol. 19, №. 1. P. 1–15. ** Strachan, T., Read, A.P. Human molecular genetics. / T.Strachan [e.a.]. – BIOS Scientific Publishers Ltd, 1996. *** http://www.med-gen.ru/content/science/index.html *** http://humbio.ru/humbio/genetics.htm *** http://nature.web.ru/db/section_page.html?s=260000442 *** http://medi.ru/pbmc/88003.htm
*** http://www.aids.ru *** http://vira-ss.narod.ru/encyclopeadia.html
Условные обозначения: * Основная литература. ** Дополнительная литература. *** Интернет-сайты. Учебное издание Дромашко Сергей Евгеньевич
В СОВРЕМЕННОЙ МЕДИЦИНЕ Учебно-методическое пособие Редактор-корректор А. А. Сычев
Печать ризографическая. Усл. печ. 1,6 л. Уч.-изд. 1,2 л. Тираж 100 экз. Заказ 214. ЛИ №02330/0133427 от 06.12.2004. Ул. Кнорина, 1, 220049, г. Минск. Беларуси по механизации сельского хозяйства» ЛП № 02330/0150026 от 10.05.2007. Ул. Кнорина, 1, корп. 3, 220049, г. Минск. Дата добавления: 2014-12-11 | Просмотры: 1988 | Нарушение авторских прав |