|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Новые вирусы: ВИЧ, гепатита С, гепатита GB, герпесвирусы 6, 7, 8, атипичной пневмонии, их характеристика и вызываемы ими заболеванияВирус иммунодефицита человека относится к ретровирусам, и для него характерны все особенности жизненного цикла вирусов данного семейства. Геном ВИЧ представлен одноцепочечной молекулой РНК. В инфицированной клетке с помощью вирусного фермента – обратной транскриптазы (ревертазы) – на матрице вирусной РНК синтезируется двухцепочечная молекула ДНК, которая затем встраивается в какой-либо участок одной из хромосом клетки-хозяина. Интегрированная ДНК-копия ретровирусного генома До недавнего времени считалось, что вирусы ОРЗ, гепатита C и ВИЧ относятся к разным группам. Пол Элквист и его коллеги из Университета Висконсин–Мэдисон детально исследовали эти патогены и пришли к выводу, что все они произошли от одного предка. О родстве патогенов свидетельствует cходство в строении белковых оболочек вирусных частиц. К тому же, у всех этих вирусов аналогичный механизм репликации – т.е. копирования новых частиц. Выявление общих черт наиболее распространенных в мире вирусов может привести к созданию высокоэффективных лекарственных препаратов нового поколения. Тестирование ВИЧ-инфекции. Большинство вирусных инфекций (например, грипп, ветряная оспа) развиваются быстро, и врач их идентифицирует прежде всего по клиническим проявлениям у больного. В случае ВИЧ-инфекции такой подход неприменим, так как ее внешние проявления могут наблюдаться лишь спустя месяцы и годы после заражения. Поэтому всеобщее распространение получил метод обнаружения в крови человека антител к вирионным белкам ВИЧ. Первые варианты такого метода – метода иммуноферментного анализа (ИФА) были разработаны уже в 1984 г. Метод ИФА используют для массовых обследований. В случае положительного результата обязательно выполняют дополнительные анализы методически независимыми способами, обеспечивающие достоверность результатов. В частности, для выявления провирусной ДНК в клетках крови используется более чувствительный метод полимеразной цепной реакции (ПЦР). Стадии развития ВИЧ-инфекции. Разработка методов тестирования и многолетние наблюдения за ВИЧ-инфицированными пациентами позволили подробно изучить стадии развития данной инфекции. Согласно принятой классификации, заболевание в своем развитии проходит шесть стадий.
В Африке катастрофа уже охватила сегодня до 30% населения некоторых стран. Официальная мировая статистика свидетельствует, что к концу 2002 г. от СПИДа уже умерли около 25 миллионов человек, и около 42 миллионов инфицированы. Россия, Украина и Беларусь при этом входят в число лидеров по темпам нарастания заболеваемости. В России, начиная с 1996 г., даже официальные данные регистрируют ежегодное увеличение количества больных в 2–3 раза. По разным подсчетам, в России на настоящий момент могут быть инфицированы от 220 тысяч до 1,5 миллионов человек. В настоящее время самыми неблагополучными по распространению ВИЧ-инфекции являются Калининградская, Ростовская, Нижегородская области, Краснодарский край и Москва. Устрашает прогноз Национального разведывательного совета США (US National Intelligence Council), обнародованный в октябре 2002 г. Если верить ему, к 2010 г. каждый десятый работоспособный россиянин может быть инфицирован ВИЧ. Гепатит С. Слово "гепатит" происходит от греческого слова hepar, hepatos, которое в переводе означает "печень", а собственно термин "гепатит" обозначает название совокупности симптомов болезни – воспаления печени. Симптомы этой болезни известны с давних времен, но причины ее стали проясняться только в 1963 г., когда впервые была доказана инфекционная природа одного из видов гепатита – гепатита В. Опасность этого заболевания для человека подтверждает тот факт, что почти половину пациентов инфекционных клиник в нашей стране в настоящее время составляют больные гепатитами, а вторым по важности фактором канцерогенеза (т.е. способствующим возникновению рака фактором) после табакокурения является перенесение инфекции вирусом гепатита В. Все вирусные гепатиты по способу их передачи от человека к человеку можно разделить на две группы:
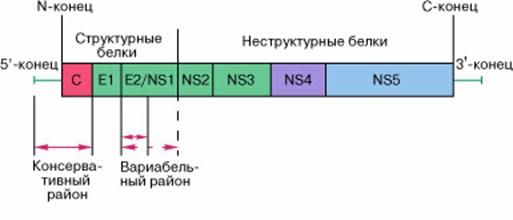
Со времени открытия вирусной природы заболевания и обнаружения вирусов гепатитов А и В выяснилось, что лишь немногим более половины случаев этого заболевания обусловлены инфицированием именно этими типами возбудителей и, по всей вероятности, существуют и другие вирусы, вызывающие гепатиты у людей. Со временем даже возник термин – гепатит "ни-А, ни-В". Лишь в конце 1980-х гг. был обнаружен новый вирус, вызывающий заболевание печени, его назвали вирусом гепатита С (ВГС). В настоящее время установлено, что до 40% случаев посттрансфузионных гепатитов (т.е. гепатитов, возникающих после применения для лечения человека препаратов из донорской крови) вызывается этим вирусом. По имеющимся данным, в мире около 3% населения являются хроническими носителями ВГС. Передается он от человека к человеку так же, как и гепатит В. В России при обследовании ежегодно выявляется 10–20 тысяч новых носителей этого вируса, однако ввиду того, что исследования начаты лишь в 1995 г., эта цифра представляется заниженной. Предполагаемое число носителей (по аналогии с другими странами) может достигать 2–3 миллионов. В настоящее время ВГС относят к семейству флавивирусов. Долгое время его не могли обнаружить в крови в виде вирусной частицы, и лишь в последние годы это удалось сделать. Размер его вириона составляет 38–50 нм. Устройство генетического материала ВГС (рисунок 10) подобно геномам пести- и флавивирусов, типичными представителями которых являются вирусы желтой лихорадки и клещевого энцефалита.
Рисунок 10 – Строение геномной РНК виуса гепатита С. C – капсидный белок, Е1 и Е2 – поверхностные белки, NS5 – РНК-полимераза Он состоит из одноцепочечной РНК, длиной около 9400 нуклеотидов. На 5'- и 3'- концах вирусной РНК находятся нетранслируемые (некодирующие) области. Между ними заключена единственная открытая протяженная рамка трансляции (рамка считывания генетического кода в аминокислотную последовательность), с которой считывается вирусный полипептид (3010 или 3011 аминокислот, начиная с первого остатка аминокислоты метионина). Последовательность генов в геноме ВГС подобна таковой у пести- и флавивирусов. Вирусная рамка считывания может быть разделена на структурную и неструктурную части. Структурная часть состоит из генов белка вирусного нуклеокапсида C и гликопротеинов оболочки E1 и E2. Ген белка C среди различных изолятов ВГС весьма консервативен. Гены гликопротеинов E1 и E2 значительно менее консервативны и имеют очень изменчивые от изолята к изоляту районы. У представителей рода флавивирус, по названию которого получило название семейство, белок, соответствующий гликопротеину E2 оболочки вириона ВГС, не входит в состав вирусной частицы. Он является первым (по порядку расположения генов в вирусной РНК) неструктурным белком флавивирусов и обозначается NS1. Поэтому гликопротеин E2 вируса гепатита C обозначают также E2/NS1. Неструктурная часть генома ВГС кодирует белки NSp2-Nsp5, большинство которых являются либо вирусспецифическими протеазами, либо ферментами, ответственными за размножение вируса. Гепатит GB. В середине 90-х гг. обнаружены еще несколько вирусов, поражающих печень. В частности весной 1995 г. выявлен вирус гепатита, передающийся парентеральным путем, точнее сразу три его разновидности, объединенные именем гепатит GB: гепатиты GB-A, GB-B и GB-C. Все разновидности относятся, как и вирус гепатита С, к семейству флавивирусов, передаются от человека к человеку так же, как и гепатит С. Эти вирусы, по всей вероятности, являются причиной до 5% всех перентеральных гепатитов у людей. Обнаружены они, как и вирус гепатита С, методами молекулярной биологии. Герпесвирусы 6, 7, 8. Герпетическая инфекция (син.: простой герпес) – собирательное название для инфекций, вызываемых вирусом простого герпеса первого типа (ВПГ-1) и вирусом простого герпеса второго типа (ВПГ-2). Термин «герпес» (от греческого herpes – ползучий) был использован Геродотом в 100 г. до н.э. для описания волдырей, сопровождающихся лихорадкой. Вирусы, относящиеся к семейству герпесвирусов, очень широко распространены в природе. Они могут вызывать заболевания у различных видов диких и домашних животных (кошек, собак, лошадей, коров, кур, рыб и др.). В настоящее время известно более 100 герпесвирусов, 8 из них выделены от человека: вирусы простого герпеса первого и второго типов (HSV-1, HSV-2), ветряной оспы – опоясывающий герпес, цитомегаловирус (CMV), вирус Эпштейна–Барр, вирусы герпеса человека шестого, седьмого и восьмого типов (HHV-6, HHV-7, HHV-8). К семейству Herpesviridae относятся три подсемейства: аlpha-Herpesviridae, beta-Herpesviridae, gamma-Herpesviridae. Наиболее важным биологическим свойством герпесвирусов в патогенезе заболеваний является их способность к латентному существованию. Герпесвирусы способны пожизненно персистировать в организме человека и вызывать заболевания с многообразными клиническими проявлениями:
Одной из самых распространенных вирусных инфекций человека является простой герпес (ВПГ), представляющий собой серьезную медико-социальную проблему. Около 90% людей на земном шаре инфицированы ВПГ и около 20% имеют какие-либо клинические проявления инфекции. Все герпесвирусы имеют выраженное иммуносупрессивное действие, подавляют клеточные и гуморальные реакции иммунитета. Наименее изучены клинические проявления инфекций, вызванных герпесвирусами шестого, седьмого и восьмого типов, у детей. HHV-6– шестой член семейства герпесвирусов человека является причиной розеолы, имеет многообразные проявления у детей и взрослых. Хотя этот новый вирус был найден изначально в B-лимфоцитах иммуноскомпрометированных взрослых больных, впоследствии выяснилось, что он имеет первоначальное сродство с T-лимфоцитами, и его оригинальное название – человеческий В-лимфотропный вирус (HBLV) – было изменено на HHV-6. HHV-6 входит в состав рода Roseolovirus, подсемейства beta-Herpesvirus. Подобно другим вирусам герпеса HHV-6 обладает характерным электронно-плотным ядром и икосаэдральным капсидом, окруженным оболочкой и внешней мембраной, местом расположения важных гликопротеинов и протеинов мембраны. Главный компонент клеточного рецептора для HHV-6 – CD46, который присутствует на поверхности всех ядерных клеток и позволяет HHV-6 инфицировать широкий ряд клеток. Главная цель HHV-6 – это зрелая клетка CD4+, но вирус может инфицировать естественных киллеров (NK), гамма-дельта T-лимфоциты, моноциты, древоподобные клетки, астроциты и разнообразные линии T и B клеток, мегакариоцитов, ткань эпителия и др. Серологические исследования HHV-6 показали повсеместность случаев HHV-6-инфекции: ее обнаруживали во всех странах, где проводили исследования. Инфицирование происходит обычно на первом или втором году жизни, и соответственно около 95% взрослых имеют антитела к HHV-6. В Соединенных Штатах Америки, Японии установлено, что приобретенная HHV-6 инфекция встречается преимущественно у младенцев 6–18 месяцев жизни. Почти все дети инфицируются в возрасте до трех лет и сохраняют иммунитет на всю жизнь. Наиболее показательно, что инфекция HHV-6, приобретенная в детском возрасте, приводит к высокой частоте серопозитивности у взрослых. HHV-7 – седьмой член семейства Herpesviridае – впервые идентифицирован в клетках здорового взрослого человека в 1990 г. HHV-7 также входит в состав рода Roseolovirus, подсемейства beta-Herpesvirus, имеет морфологическое, антигенное и геномное сходство с HHV-6. Он имеет нуклеокапсид, содержащий ДНК, окруженный плотной оболочкой и липидным покрытием. HHV-7 прежде всего заражает CD4+ T-клетки, такие как мононуклеары пуповинной и периферической крови. В эпителиальных клетках слюнных желез он пролиферирует с выбросом вирусов. Другие ткани, такие как кожа, молочная железа, легкие, также могут содержать антиген HHV-7. HHV-7 является распространенной инфекцией детского возраста, которая проявляется несколько позже, чем HHV-6, и в более широком возрастном диапазоне. Серологические исследования показали, что большинство индивидуумов в Соединенных Штатах инфицируются HHV-7 к 6–10-му году жизни. HHV-7 выделяется в слюне у 95% взрослых, что указывает на высокий уровень инфицированности населения и склонность HHV-7 к персистенции. HHV-7 наиболее вероятно передается через слюну, в которой вирус активно реплицируется. HHV-8 имеет более давнюю историю. В 1872 г. венгр Мориц Капоши впервые описал агрессивную пигментированную идиопатическую саркому кожи. Эта опухоль сегодня хорошо известна как саркома Капоши. Ранее в США и странах Западной Европы она была редкой патологией, ее частота составляла менее 0,06 на 100 тыс. человек, пока не возникла эпидемия СПИДа. Спустя сто лет, в начале 80-х гг., появились сообщения о высокой частоте саркомы Капоши у гомосексуальных мужчин, впоследствии этот показатель увеличился до 15–20% у гомосексуальных ВИЧ-зараженных мужчин. В течение некоторого времени предполагалась вирусная этиология саркомы Капоши. Ассоциация с HHV-8 и саркомой Капоши не предполагалась, пока. в 1994 г. не открыли герпесвирус, связанный с саркомой Капоши (KSHV), который сегодня классифицирован как HHV-8 в пределах подгруппы герпесвирусов гамма-2, группы Rhadinovirus. Выявлены вариации HHV-8 инфекции, связанные с географическими и социоэкономическими факторами. Сероэпидемиологические исследования показали высокие уровни заболеваемости классической саркомой Капоши в странах Африки, особенно Центральной; низкие – в США, Японии и в некоторых северных европейских странах, средние – в большинстве средиземноморских стран. Основная группа риска в США – гомосексуальные мужчины, у которых серопозитивность составляет около 40%. Передача HHV-8 происходит различными путями, но, вероятно, преобладает половой путь, а также передача через слюну. Это подтверждается выявлением HHV-8 в сперме. Дополнительные пути заражения обусловлены присутствием ДНК вируса HHV-8 в слюне и лимфоцитах периферической крови. В Африке, где существует эндемическая форма саркомы Капоши, инфицирование HHV-8 происходит обычно в детстве, относительно высокий уровень инфицирования отмечается также в период становления сексуальной активности. Перинатальный путь передачи отмечен в странах Африки и на острове Сардиния. Атипичная пневмония. Этот термин применяется для обозначения двух различных заболеваний: · В медицинской литературе под атипичной пневмонией традиционно понимается воспаление легких, вызванное микоплазмами, хламидиями или легионеллами и имеющее необычное для него клиническое течение. · Новая болезнь, выявленная в ноябре 2002 г. в Китае, затем в Гонконге, получившая там эпидемическое распространение и зарегистрированная к маю 2003 г. в 30 других странах (численность заболевших превысила 7 тыс. чел., умерло – свыше 500), в средствах массовой информации получила название атипичной пневмонии. В медицинской литературе по предложению ВОЗ для обозначения ее применяется термин тяжелый острый респираторный синдром, или САРС (SARS – severe acute respiratory syndrom). В Инкубационный период длится обычно от двух до семи суток, иногда до 10 суток. Болезнь проявляется остро: повышение температуры тела до 38 °С и выше, озноб, боли в мышцах, головная боль, общая слабость. Примерно у четверти больных наблюдаются боли в горле и насморк. Возможны головокружение, тошнота, рвота, боли в животе, жидкий стул. Чаще через два–три дня состояние больного улучшается, при тяжёлом течении болезни появляются кашель, сухой или с небольшим количеством мокроты, одышка и быстро развивается выраженная дыхательная недостаточность. При непосредственном исследовании больного и рентгенологически выявляют признаки пневмонии; в гемограмме чаще отмечается лейкопения. Смертность от атипичной пневмонии составляет 3,6%. У 10-20% заразившихся болезнь протекает в тяжелой форме и сопровождается осложнениями; 80-90% заболевших выздоравливают. Лихорадка, кашель и затрудненное дыхание в сочетании с данными эпидемиологического анамнеза (контакт с больным или возможность такого контакта, например приезд из Китая, Гонконга или Тайваня) позволяют поставить предположительный диагноз тяжёлого острого респираторного синдрома. При подозрении на САРС больной подлежит госпитализации и строгой изоляции в специально оборудованном боксе. Проводят кислородотерапию, искусственную вентиляцию лёгких, лечение антибиотиками широкого спектра действия, а также противовирусными препаратами (однако их эффективность не доказана). С целью индивидуальной профилактики показаны применение противовирусных иммуностимулирующих препаратов: арбидол, амиксин, закаливание организма, рациональное питание, поливитамины. Дата добавления: 2014-12-11 | Просмотры: 1574 | Нарушение авторских прав |
 наз
наз  ывается провирусом. В таком состоянии ретровирус может долгое время сосуществовать с инфицированным организмом, никак себя не проявляя. Однако, получив определенные молекулярные сигналы, с провирусной ДНК инициируется транскрипция вирусной РНК, а с нее – синтез вирусных белков. Затем следуют сборка многочисленных вирусных частиц и выход их из клетки, приводящий в итоге к гибели зараженных клеток. Отличительное свойство ВИЧ прояется в том, что он адсорбируется на поверхности только тех клеток, которые содержат мембранный белок, называемый антигеном CD4. Такой поверхностный антиген в основном содержат T4-лимфоциты, являющиеся T-хелперами/индукторами (хелпер от англ. helper – помощник) и играющие важнейшую роль в координации работы всей иммунной системы человека. Уничтожение вирусом лимфоцитов этого типа и обусловливает иммуносупрессорное действие ВИЧ.
ывается провирусом. В таком состоянии ретровирус может долгое время сосуществовать с инфицированным организмом, никак себя не проявляя. Однако, получив определенные молекулярные сигналы, с провирусной ДНК инициируется транскрипция вирусной РНК, а с нее – синтез вирусных белков. Затем следуют сборка многочисленных вирусных частиц и выход их из клетки, приводящий в итоге к гибели зараженных клеток. Отличительное свойство ВИЧ прояется в том, что он адсорбируется на поверхности только тех клеток, которые содержат мембранный белок, называемый антигеном CD4. Такой поверхностный антиген в основном содержат T4-лимфоциты, являющиеся T-хелперами/индукторами (хелпер от англ. helper – помощник) и играющие важнейшую роль в координации работы всей иммунной системы человека. Уничтожение вирусом лимфоцитов этого типа и обусловливает иммуносупрессорное действие ВИЧ.