|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
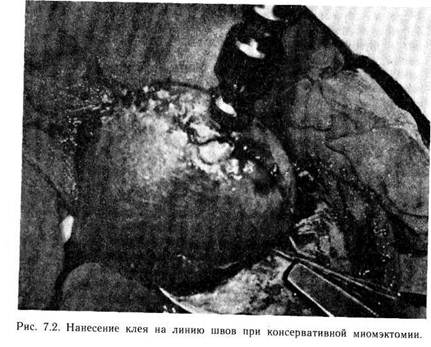
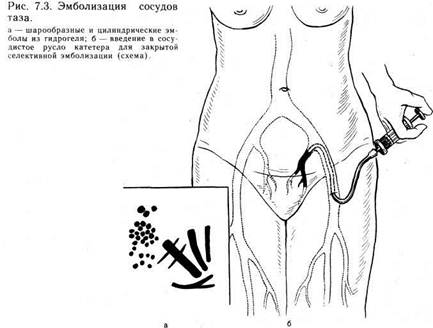
В ОПЕРАТИВНОЙ ГИНЕКОЛОГИИСовременный этап развития оперативной гинекологии характеризуется разработкой принципиально новых хирургических вмешательств, совершенствованием этапов традиционно признанных операций. Этому способствовало последовательное внедрение в оперативную гинекологию ряда достижений XX столетия в области полимерной химии, физики и техники. Наряду с совершенствованием хирургических вмешательств были созданы новые разделы оперативной гинекологии, значительно расширившие возможности оперативного вмешательства при различных по природе и тяжести заболеваниях, тогда как раньше хирургическое лечение некоторых из них было принято считать бесперспективным. Все это привело к возрастанию зна- чимости и улучшению результатов функциональной оперативной гинекологии. Наиболее переспективны следующие направления в оперативной гинекологии: использование полимеров в оперативной гинекологии, микрохирургия, эндоскопическая хирургия, применение лазеров в оперативной гинекологии, электрохирургия, криохирургия и ультразвук, применение сшивающих аппаратов, использование консервированных тканей. 7.1. ИСПОЛЬЗОВАНИЕ ПОЛИМЕРОВ Развитие реконструктивной хирургии характеризуется интенсивным поиском новых материалов, способствующих лучшему соединению и заживлению тканей, активирующих процессы ре-. паративной регенерации оперированных органов, обладающих гемостатическими и противовоспалительными свойствами. Более 20 лет в оперативной гинекологии используются полимерные материалы. Известны реконструктивно-пластические операции на матке с использованием тефлоновых и капроновых сеток, которые во ВНИЦОЗМиР применялись Н. Д. Селезневой и Л. С. Персианиновым. В свое время широкое распространение получили операции пластики шейки матки с использованием аллопластических материалов при хирургическом лечении шеечно-влагалищных свищей, предложенные В. И. Ельцовым-Стрел-ковым, а также операции при опущениях и выпадениях матки, мочеполовых и ректовагинальных свищах. Однако указанные операции в ряде случаев оказывались мелоэффективными из-за отторжения полимерных материалов и вторичного заживления швов. В последнее десятилетие с появлением новых высокомолекулярных соединений значительно расширились возможности применения различных полимерных материалов в оперативной гинекологии. В отделении оперативной гинекологии ВНИЦОЗМиР совместно со Всесоюзным центром перевязочных, шовных и полимерных материалов в медицине Института хирургии им. А. В. Вишневского АМН СССР применяются следующие материалы: медицинские клеи (МК-7, МК-7М, сульфакрилатный), коллагеновые препараты («Камбутек-2»), дренирующие сорбенты (гелевин), тампоны из гидрогеля (поли-2-гидроксилэтилметакрилат), одноразовые хирургические комплекты из нетканых материалов, эмболы из гидрогеля, шовные материалы (капрон, лавсан и др.). 7.1.1. МЕДИЦИНСКИЙ КЛЕЙ Цианакрилатные клеи — рассасывающийся аллопластический материал. Процесс рассасывания клея в живом организме начинается в первые же минуты после склеивания раны и продолжается до 1 года. Основная масса продуктов метаболизма клея выводится в первые 2—3 мес. Медицинский клей МК-7М разработан в отделе медицинских олимеров сесоюзного научно-исследовательского и испытательного института медицинской техники Минздрава СССР в 1976 г. и разрешен к применению в клинической практике Комитетом по новой медицинской технике Минздрава 24. 06. 82 г. Существуют две разновидности клея МК-7: для соединения костей и мягких тканей живого организма (МК-7М). Отечественной промышленностью (Львовский химфармзавод) осваивается серийное производство клея МК-7М. Основу его составляют мономерные эфиры альфа-цианакриловой кислоты: этоксиэтил-а-цианакрилат и этил-а-цианакрилат. Для контрастности в тканях живого организма клей имеет в своем составе краситель, обеспечивающий интенсивную зеленую окраску,— жирорастворимый зеленый ан-трахиновый. Клей МК-7М — однородная темно-зеленая жидкость плотностью 1,05—1,07 г/см3 и вязкостью до 15 СП (0,015 Па- с) при температуре 20 °С, растворимая в безводных органических растворителях (ацетон, ароматические углеводороды, хлористый этил, сложные эфиры). При контакте с водными растворами клей быстро полимеризу-ется. Время склеивания при температуре тела человека составляет 1—2 мин. Клей МК-7М аутостерилен, обладает местной антибактериальной активностью и является нетоксичным биологически совместимым препаратом. При нанесении на соединяемые ткани он полимеризуется с образованием пленки, склеивающей поверхности. Он подвергается постепенному рассасыванию в сроки от 1 до 6 мес в зависимости от толщины клеевой пленки, методики его применения и характера склеиваемых тканей. Преимуществами медицинского клея МК-7М по сравнению с предыдущими цианакрилатными клеевыми композициями являются высокая прочность и хорошие гемостатические свойства, образование более эластической отвержденной пленки, высокая стабильность при хранении, отсутствие выраженного гистотоксичного воздействия на ткани. Клей МК-7М поставляется в готовом к употреблению виде в полиэтиленовых шприц-тюбиках одноразового пользования, содержащих 1 мл. Шприц-тюбик состоит из корпуса, на горловину которого навинчивается канюля с инъекционной иглой. Игла защищена колпачком. Корпус герметически запаян. Клей хранится в герметически запаянных шприц-тюбиках при температуре не выше 5 °С в течение 6 мес с момента изготовления (список Б). Влага, находящаяся в ране, ускоряет полимеризацию клея. При избыточном количестве влаги она может быть настолько быстрой, что клеевая пленка образуется до вступления клея в контакт с тканью. В связи с этим перед нанесением клея необходимо тщательно осушить раневую поверхность. Относительная сухость склеиваемых поверхностей может достигаться сочетанием различных способов: высушивания сухими тампонами, тампонами со спиртом, эфиром, струей воздуха или кислорода, пальцевого сжа- тия органа, лигирования и электрокоагуляции кровоточащих сосудов, быстрого поверхностного замораживания. Существуют следующие методы нанесения медицинского клея на склеиваемые поверхности: 1) непосредственно из ампулы; 2) с помощью кисточек и шпателей; 3) с использованием специальных аппаратов для распыления клея; 4) с помощью безыгольных инъекторов. Широкое распространение получил метод нанесения медицинского клея непосредственно из ампулы. Капельным методом клей наносят последовательно на склеиваемые поверхности в минимальном количестве. Для гладких поверхностей считается достаточным нанесение 0,04—0,06 мл/см2, для пористых требуется несколько большее количество. Оптимальным является нанесение одной капли клея на 1 см2. Для наилучшего распределения клея его наносят с помощью кисточек и шпателей, изготовленных из инертных по отношению к клею материалов. Существенными недостатками при этом являются невозможность аппликации клея равномерным слоем, обработки больших раневых поверхностей, прилипание его к ране, инструментам, перчаткам. Устранить эти недостатки позволяет распыление клея. С помощью специальных распылителей можно быстро нанести его тонким равномерным слоем на значительные площади поверхности. Действие отечественного телескопического распылителя РТ-1 основано на том, что эвакуирующий газ, проходя через сопло, понижает давление в зоне истечения. Благодаря разности давлений клей поступает в зону истечения эвакуирующего газа и распыляется. На каждую из поверхностей напыляется два слоя клея. Этот метод нанесения клея способствует повышению прочности образующегося клеевого соединения. Общим недостатком перечисленных методов нанесения клея является необходимость тщательной предварительной обработки раневых поверхностей, что не всегда возможно и в ряде случаев неосуществимо. В 1972 г. был разработан новый метод нанесения клея с помощью безыгольного инъектора. Сущность его заключается в создании на раневой поверхности гемостатического инфильтрата. Инфильтрат образуется струйным безыгольным введением в ткани клея со стороны раневой поверхности. При этом часть клея вводится в толщу ткани на глубину 1—3 мм, а часть распыляется по поверхности раны. После склеивания тканей полимеризовав-шийся клей представляет собой единый монолитный конгломерат сложной ветвистой формы. Таким образом, склеивание тканей, обусловленное физико-химическими процессами, усиливается и механической фиксацией. Нанесение клея безыгольным инъектором может быть применено для склеивания тканей и остановки кровотечения; при этом не требуется предварительного тщательного осушения раневой поверхности. Оптимальным и эффективным является нанесение клея с по-110 мощью инъектора «Пчелка». Безыгольный инъектор БИ-1 «Пчелка» (СССР) представляет собой малогабаритный однорежимный многозарядный инъектор автономного типа с ручным встроенным приводом. Масса инъектора 250 г, габаритные размеры 219 X 83 X X 36 мм (рис. 7.1). Стерилизацию инъектора осуществляют путем холодной химической стерилизации в парах формалина. Инъекции производят следующим образом: сопло инъектора приближают к раневой поверхности на расстояние 5—25 мм (при необходимости нанесения клея на матку — на расстояние 5— 10 мм, на яичник— 15—20 мм, на параметрий или брюшину — 20—25 мм). Продольную ось инъектора располагают перпендикулярно либо под углом к плоскости раневой поверхности. После осушивания раны производят прицельную инъекцию. Биологический клей МК-7М используют при различных гинекологических операциях. При консервативной миомэктомии после восстановления целости стенки матки на линию швов с целью их укрепления и герметизации медицинский клей МК-7М наносят безыгольным инъектором (рис. 7.2). Частично внедряясь в мио-метрий и полимеризуясь на швах и прилежащих участках матки, клей надежно и герметично закрывает их, образуя единый монолитный шовно-клеевой конгломерат. При этом достигается окончательный гемостаз, так как нередко в месте прокола иглой стенки матки возникает кровотечение, требующее дополнительного наложения швов. Можно значительно уменьшить число швов, накладываемых с целью перитонизации, так как клеевая пленка герметично и полностью закрывает края разрезов. В ряде случаев, помимо нанесения клея на область швов, можно перитонизировать их приклеенной брюшиной пузырно-маточной складки либо свободным лоскутом резецированного сальника. Использовать брюшину пузырно-маточной складки в том случае можно, если узлы располагаются на передней стенке матки низко, под пузырно-маточной складкой. После рассечения этой складки и отсепаровки мочевого пузыря книзу узлы миомы вылущивают, раневые поверхности зашивают кетгутовыми нитями. Клей наносят на область швов. Через 1—2 мин (время полимеризации клея) пузырно-маточная складка прочно соединяется с маткой, полностью закрывая область швов. При дополнительном закрытии швов на матке свободным лоскутом сальника резецируют участок большого сальника необходимых размеров и наматывают его на браншу зажима. Клей инъецируют в области швов. Одновременно к клеевым пломбам быстро прижимают постепенно разматываемый сальник. Последний фиксируют в таком положении 1—2 мин. Для укрепления и герметизации линии швов на культе шейки матки после надвлагалищной ампутации можно использовать медицинский клей МК-7М. После обработки культи шейки матки и ушивания сосудистых пучков и культи безы-
гольным инъектором наносят на швы клей МК.-7М. Клеевая пленка надежно и герметично закрывает швы и прилежащие культи сосудистых пучков. Используя клей МК-7М, укрепляют и герметизируют линию швов на культе шейки матки, достигая полного гемостаза. Во время экстирпации матки при разделении обширных сращений половых и соседних органов может возникнуть капиллярное кровотечение, особенно в области крестцово-ма-точных связок, прямокишечно-маточного углубления и париетальной брюшины боковых стенок малого таза, из параметраль-ной, параректальной, паравезикальной клетчатки. Медицинский клей МК.-7М наносят модифицированным безыгольным инъектором на кровоточащие раневые поверхности. Для наилучшего доступа к мест*у нанесения клея пользуются удлиняющими насадками — прямыми и изогнутыми. Гемостатический эффект наступает непосредственно после инъекций. Эффективно использование клея при резекции яичников. На границе между опухолью или опухолевидным образованием и сохранившейся тканью яичника производят разрез и удаляют опухоль. В случаях очаговой стромальной гиперплазии, поликистозных яичников после их клиновидной резекции осуществляют бесшовное соединение раневых поверхностей по следующей методике. По краям раны яичника накладывают лигатуры-держалки. С обеих сторон на раневые поверхности безыгольным инъектором наносят клей. Края раны сближают и сопоставляют пинцетами; в таком положении их удерживают 1—2 мин. Поверх соединенных краев раны вновь наносят клей, захватывая прилежащие участки (5 мм). При этом достигаются хороший гемостатический эффект и прочное соединение ткани яичника, не требующее дополнительного наложения швов. Эта методика имеет значительное преимущество перед лигатурным способом соединения. Она менее травматична, проста в выполнении, обеспечивает надежный гемостаз и прочное соединение ткани яичника. Клеевая герметизация линии швов на яичнике в случаях его повышенной кровоточивости помогает быстро достичь полного гемостаза без дополнительного наложения швов. С помощью клея может быть осуществлено бесшовное соединение листков широких связок после удаления паровариальных кист. После вылущивания кисты 2—3 инъекциями клея производят гемостаз в ложе кисты. Пинцетом сближают рассеченные края листков широких связок и, нанося клей, постепенно соединяют листки брюшины, фиксируя их на 1—2 мин. Листки широких связок соединяются без свободных пространств между ними и хорошо удерживаются клеевой пленкой. На все манипуляции по клеевому соединению листков широких связок требуется 5— 7 мин. Эффективно применение клея во время влагалищных операций. При пластике промежности после выкраивания и отсепаровки лоскута влагалища обнажается обширная раневая поверхность. При этом нередко имеет место капиллярное или венозное кровотечение, особенно при наличии варикозно-расширенных вен около прямой кишки. Раневую поверхность осушают и осуществляют клеевой гемостаз. При наложении швов на промежность их укрепляют инъекциями клея. При биопсии шейки матки ткань шейки матки иссекают в виде клина с основанием шириной 0,5—1 см в пределах здоровой ткани. В канал шейки матки вводят маточный зонд. На рану шейки матки инъектором наносят клей. Этого достаточно для полного гемостаза и герметичного закрытия раневой поверхности. Пластика шейки матки с использованием клея производится следующим образом. Шейку ма'тки обнажают зеркалами и низводят. Канал шейки матки расширяют при помощи расширителей Гегара до № 9—10. При наличии шеечно-влагалищного свища шейку матки рассекают от свища до наружного зева. Последняя приобретает вид, схожий с деформированной шейкой при ее разрывах. Шейку матки расслаивают на два лоскута — наружный и внутренний. Внутренний лоскут образуется отсепарированным эндоцервиксом с тонким слоем подлежащих тканей. На расширителе Гегара кетгутовыми швами без прокалывания слизистой оболочки формируют канал шейки матки. После этого на вновь образованную часть шейки безыгольным инъектором наносят клей. Наружным лоскутом обертывают сформированный канал и фиксируют его по краям разрезов влагалищной части шейки матки. Клеевая пленка в толще шейки матки надежно удерживает и герметизирует внутренний ряд швов. Одновременно нанесением клея производится окончальный гемостаз, что ликвидирует возможность образования гематом в толще шейки матки. Поверх наружных швов на влагалищной части шейки матки при наличии повышенной кровоточивости дополнительно наносят клей. Во время операций на наружных половых органах, влагалище, по поводу прямокишечно- и пузырно-влагалищных свищей клей позволяет укрепить кожные швы, швы на прямой кишке и мочевом пузыре. Клеевое укрепление и герметизация швов в этих случаях уменьшают риск развития несостоятельности швов и возникновения рецидива заболевания, облегчают проведение гемостаза. Послеоперационный период у больных, перенесших операции с использованием клея, протекает благоприятно. При клеевом гемостазе кровотечений не возникает, что объясняется как механическим закрытием сосудов, так и выходом акцелератов свертывания крови в сосудистое русло. Нагноения в месте аппликации клея не наблюдается. Укрепление швов клеем может быть неэффективным в случаях сильного натяжения тканей с выраженными Рубцовыми изменениями и нарушенной трофикой, а также если не учитываются анатомо-топографические особенности тканей. Рациональная оперативная техника в таких ситуациях обеспечивает успех применения клея. Применение медицинского клея МК-7М рекомендуется для облегчения работы хирурга-гинеколога. Проведение гинекологических операций с использованием клея упрощает методику, сокращает время их выполнения и операционную кровопотерю. Медицинский клей МК-7М показан для-укрепления и герметизации швов, остановки кровотечения и бесшовного соединения тканей половых органов. Противопоказаний к применению клея нет. 7.1.2. КОЛЛАГЕНОВЫЕ МАТЕРИАЛЫ В последние годы большое внимание уделяется рассасывающимся материалам, которые, выполняя функцию временного направляющего каркаса для регенерации, постепенно замещаются собственными тканями организма. В результате многолетних исследований по применению препаратов из коллагена (гемоста-тическая губка и др.) возникло представление, что ускорение роста соединительной ткани происходит в результате стимулирующего влияния продуктов распада коллагена. Основанием для применения коллагенового препарата «Кам-бутек-2» в оперативной гинекологии явились следующие свойства этого нового пластического материала: стимуляция процессов репаративной регенерации собственных тканей организма, гемо-статический эффект, значительная абсорбция раневого экссудата, способность образовывать комплексы с биологически активными веществами (антибиотики, антисептики и др.) в отсутствие токсических канцерогенных свойств и иммунной реакции организма. Коллагеновый препарат «Камбутек-2» в виде губки разработан лабораторией перевязочных, шовных и полимерных материалов в медицине Института хирургии им. А. В. Вишневского АМН СССР совместно с ВНИИ мясной промышленности Министерства мясо-молочной промышленности СССР. «Камбутек-2» представляет собой реконструированный коллаген с небольшими (до 1,5%) добавками лекарственных антисептических, дубящих и других веществ. «Камбутек-2» — комбинированный препарат животного происхождения, пористой структуры, выпускающийся в виде пластин светло-коричневого или бежевого цвета. По данным сканирующей микроскопии и поляризационной микроскопии на тонких срезах поверхность «Камбу-тека-2» неровная и шероховатая, пористая (размер пор от 10 до 100 мкм). При контакте с жидкостью он поглощает большое количество ее. В отделении оперативной гинекологии ВНИЦОЗМиР Минздрава СССР «Камбутек-2» применяют с целью стимуляции регенерации тканей гнойных ран, как гемостатическое средство, если наложение швов представляет значительные технические трудности, а также во время операций: при чревосечениях с целью гемостаза в области параметрия и в качестве дополнительной перитонизации десерозированных поверхностей при консервативной миомэктомии и обширных дефектах брюшины. Кроме того, «Камбутек-2» используют при операции кольпопоэза в тех случаях, когда выполнить одноэтапный брюшинный кольпо-поэз невозможно или нецелесообразно (при комбинированных пороках развития половых органов, тяжелой экстрагенитальной патологии и др.). Последовательность этапов заживления раны можно представить следующим образом: очищение раны, пролиферация фиб-робластов и капилляров, накопление гликозаминогликанов, биосинтез коллагена и фибриллогенез, созревание коллагеновых волокон, созревание рубца. Биосинтез коллагена начинается на 2—3-й день после операции. Сначала формируются незрелые аргирофильные волоконца, которые затем превращаются в более грубые функцинофильные коллагеновые волокна. В дальнейшем (с 10-го дня) происходит формирование пучков из коллагеновых волокон и грануляционная ткань превращается в плотную рубцовую. При наступлении фазы рубцевания одновременно происходит значительное уменьшение раны (контракция) в основном не за счет эпителизации дефекта, а за счет стягивания краев раны рубцом и миграции кожи. «Камбутек-2» дает значительный стимулирующий эффект на всех этапах заживления ран, особенно во II фазе — в период созревания грануляционной ткани, синтеза гликозаминогликанов и коллагена, фибриллогенеза и формирования зрелых коллагеновых волокон. Препарат прикладывают ко всей раневой поверхности в виде аппликаций в один слой, пористой стороной к ране. При наличии глубоких полостей пластинкой «Камбутека-2» выстилают всю полость. Предварительно пластины перфорируют. Через 24 ч необходимо произвести повторную обработку раны антисептиками и на сухую поверхность вновь наложить коллагеновый препарат. Эту процедуру надо повторять вплоть до полного заживления и эпителизации раны. В случаях «прилипания» «Камбутека-2» к раневой поверхности последнюю не промывают, лишь на непокрытые участки накладывают свежий коллаген. Состояние раны оценивают по наличию краевой и островковой эпителизации, характеру грануляционного покрова и отделяемого. В самой коллагеновой губке наблюдается резорбция коллагена инфильтрирующими его нейтрофилами и макрофагами при одновременном освобождении связанных с «Камбутеком-2» лекарственных веществ (антисептики, гемостатические средства), оказывающих антимикробное и стимулирующее воздействие на ткань. Перечисленные свойства препарата являются основанием для использования его при лечении генитальных свищей, образовавшихся вследствие осложнений операций. «Камбутек-2» используют и при выполнении реконструктивно-пластических операций у больных с аномалиями развития матки и влагалища для выстилки искусственно образованного «тоннеля» между мочевым пузырем и стенкой прямой кишки. Опыт использования отечественного коллагенового препарата «Камбутек-2» в оперативной гинекологии позволяет считать его высокоэффективным биологическим средством для лечения ран во II фазе, после влагалищных операций для стимуляции заживления стенок влагалища и тканей промежности. «Камбутек-2» способствует заживлению генитальных свищей. Препарат дает гемостатический эффект. Он может быть использован при паренхиматозном кровотечении из обширных десерозированных поверхностей брюшной полости и параметрия, может явиться средством выбора в связи с невозможностью или опасностью наложения швов (при болезнях крови, связанных с нарушением различных звеньев гемостаза). 7.1.3. ДРЕНИРУЮЩИЕ СОРБЕНТЫ Несмотря на значительные успехи в хирургии, нагноение швов наблюдается как после чревосечений, так и после влагалищных операций. Эффективность лечения этих осложнений зависит от фазы воспалительного процесса, при которой начата терапия. Помимо общих методов лечения — медикаментозных, физических, оказывающих противовоспалительное, антибактериальное действие, стимулирующее влияние на иммунокомпетентную систему организма, необходимым условием терапии является местное лечение гнойных ран. В последние годы с целью увеличения впитываемости сорб-ционных материалов используют водонабухающие сорбенты на основе частично сшитых и привитых сополимеров поливинилового спирта, полиакрилата, полиэтиленоксида, эфиров целлюлозы. Основными функциональными свойствами сорбентов такого класса являются набухаемость в воде, физиологических жидкостях и осмотическая сила относительно воды, которая обеспечивает снятие отека, до предотвращает обезвоживание клеток тканей. Последнее свойство определяется в основном химической природой полимера. В качестве сорбента нами был использован гелевин, разработанный лабораторией перевязочных, шовных и полимерных материалов в медицине Института хирургии им. А. В. Вишневского АМН СССР совместно с объединением «Пластполимер» на основе частично сшитого водонабухающего полимера поливинилового спирта. Гелевин представляет собой порошок с частицами размером от 0,05 до 0,63 мм, обладающий высокой сорбционной способностью. При контакте с жидкой средой гелевин превращается в гель. Максимум сорбции приходится на первые 10 мин, после чего устанавливается состояние динамического равновесия, которое сохраняется до тех пор, пока гель контактирует с жидкой средой. Гелевин целесообразно применять после гинекологических операций при нагноении раны на передней брюшной стенке, пери-культитах после абдоминальной и влагалищной экстирпации матки, расхождении швов на промежности, стенках влагалища и шейке матки.после пластических операций по поводу свищей и старых разрезов, после операции кольпопоэза. Препарат используют в виде влагалищных тампонов. Применение гелевина в I фазе раневого процесса заметно ускоряет процесс очищения ран от некротических тканей и способствует быстрому образованию грануляционной ткани. Особенно благоприятно протекает раневой процесс при комбинации препарата с ферментами, антибиотиками, антисептиками. Заполнение дефекта тканей происходит на 6—8-е сутки, полное заживление ран через 14—16 сут. В процессе обработки раны гелевином нами выявлен выраженный гемостатический эффект препарата. Так, после отторжения некротического налета на культе влагалища у одной из наблюдавшихся нами больных имело место кровотечение из культи на довольно большом протяжении. Обработка обычными гемостатическими средствами (в том числе применение губки, тампонирование) не дала эффекта. Введение гелевина остановило кровотечение в течение 3—6 мин. Аналогичная ситуация имела место в другом случае при отторжении струпа после кони-зации шейки матки. В описанных наблюдениях массивные кровотечения были обусловлены заболеваниями крови (болезнь Вер-льгофа). Медико-биологические исследования показали, что гелевин сорбирует белки, кровь, экссудат, микробные тела. При цитогистологических исследованиях, проводимых в динамике лечения раневого процесса гелевином, уже на 3-й сутки отмечено значительное уменьшение воспалительного компонента за счет снижения числа нейтрофилов, активации процессов очищения раны и регенерации, о чем свидетельствовало появление в большом числе полибластов, клеток грануляционной ткани, и макрофагов, способствующих очищению раны. К 8-м суткам в цитограммах с ран, леченных гелевином, имелись единичные нейтрофилы. В контрольной группе в эти же сроки еще была выражена воспалительная фаза заживления раны (много нейтрофилов), продолжался процесс ее очищения (значительное число макрофагов), что свидетельствовало о более монотонном регенеративном процессе. При изучении динамики микрофлоры в процессе лечения выявлено снижение количества микробных тел с 108 на 1 г ткани (исходная величина) до 10 в1 степ.—10 во2 степ. к концу лечения. Подавление патогенной микрофлоры отчетливо наступало на 6—8-е сутки. Таким образом, результаты наблюдений за больными, перенесшими различные операции, позволяют рекомендовать отечест- венный дренирующий сорбен гелевин для очищения гнойных ран в I фазе и профилактики септических осложнений при влагалищных операциях. Дальнейшее изучение гелевина и его композиций будет способствовать широкому внедрению препарата в гинекологическую практику. 7.1.4. ГИДРОГЕЛЬ Новым и, на наш взгляд, очень перспективным является применение в реконструктивной хирургии препаратов из гидрогеля (полигидроксиэтилметакрилат). Известно, что после пластических влагалищных операций применение мазевых тампонов в I фазе раневого процесса нежелательно, поскольку ежедневная их замена травмирует ткани, а оставление тампонов на длительное время приводит к инфицированию раны. Методом выбора служит использование тампонов на гидрогелевой основе, содержащих антисептики. Особенностью указанных влагалищных тампонов является пролонгированное выделение медикаментозных средств в течение 48—72 ч, что позволяет проводить надежную профилактику послеоперационных инфекционных осложнений у больных группы высокого риска, особенно после операций по поводу генитальных свищей, разрывов промежности, когда только предоперационной санации недостаточно, а послеоперационная травма тканей недопустима. Указанные тампоны разработаны Институтом хирургии им. А. В. Вишневского совместно с ВНИЦОЗМиР Минздрава СССР и впервые применены в отделении оперативной гинекологии этого центра. Исследования микрофлоры влагалища до операции и введения тампона и после операции с применением тампона с хлоргек-сидином на гидрогелевой основе подтвердили стерильность посевов более чем в течение 72 ч после операции. Гидрогель применяется в оперативной гинекологии и хирургии в качестве материала для эмболизации сосудов. 7.1.5. ХИРУРГИЧЕСКОЕ БЕЛЬЕ ОДНОРАЗОВОГО ПОЛЬЗОВАНИЯ В настоящее время большое внимание уделяется проблеме внутригоспитальной инфекции, уровень которой колеблется от 0,5 до 40 %. Однако в хирургических стационарах немаловажное значение имеет и передача инфекции от больных гнойно-воспалительными заболеваниями через предметы обихода, в том числе мягкий медицинский инвентарь. Текстильные изделия, особенно после многократных стирок, являются активным источником распространения в воздухе частиц разного размера. Бактерии воздуха в основном за счет электростатического взаимодействия образуют макрочастицы, легко оседающие на стерильных поверхностях и операционном поле. Основными преимуществами одноразового хирургического комплекта, сделанного из нетканых и бумажных текстилеподоб-ных материалов, являются: 1) большая поверхностная прочность по сравнению с текстильными, что снижает запыленность воздуха; 2) высокий фильтрующий эффект при сохранении удовлетворительных гигиенических свойств (паро- и воздухопроницаемости) по сравнению с текстильными материалами, которые через 1 мин после намокания становятся микробопроницаемыми; 3) совместимость с полимерными пленками, что открывает возможность создания нового класса комбинированных материалов, являющихся непревзойденными по параметрам влаго- и микро-бонепроницаемости; 4) простота переработки; 5) легкость и надежность промышленной радиационной стерилизации в герметичной упаковке, что гарантирует сохранение стерильности изделия в течение длительного времени. В отделении оперативной гинекологии ВНИЦОЗМиР Минздрава СССР в течение последнего года используются комплекты стерильного одноразового операционного белья, акушерские комплекты и разовые бумажные изделия для ухода за тяжелобольными (абсорбирующие подстилки и защитные простыни). Указанное белье изготовлено в Советском Союзе при техническом содействии финских специалистов, в частности фирмы «Татро». В состав отечественного хирургического комплекта входят простыни для ограничения операционного поля с липким слоем для фиксации (размером 70X80 см 2 шт., 200X 140 см 2 шт.,), а также защитные простыни для покрытия операционного стола. Указанное белье изготовлено из ламинированного полиэтиленом двухслойного нетканого (или бумажного) материала. Операционные комплекты используются нами как при брюшнополостных, так и влагалищных хирургических вмешательствах. Следует отметить, что хирургические комплекты удобны в обращении, прочны, легки, эстетичны. Аллергических или каких-либо других побочных реакций у медицинского персонала при их использовании не отмечено. Они универсальны и пригодны для использования при хирургических вмешательствах различных типов. Липкая лента обеспечивает надежное крепление простыней к телу и не допускает подтекания отделяемого под простыню, за исключением тех случаев, когда производится влагалищная операция, сопровождающаяся массивным кровотечением или обильным намоканием нижнего отдела операционной раны во время зашивания мочеполовых свищей. В этих условиях нижнюю простыню дополнительно фиксируют к телу либо для предотвращения намокания нижней простыни используют адсорбирующие многослойные подстилки из стерильных акушерских комплектов. Из недостатков нетканого операционного белья следует отметить повышенную жесткость, меньшую драпируемость и в отдельных случаях трудное отделение защитного бумажного покрытия от мягкого слоя. Однако комплекс свойств, способствующих уменьшению госпитальной инфекции и профилактике септи- ческих осложнении в акушерстве и гинекологии, в сочетании с удобствами пользования и экономическими выгодами делает необходимым широкое внедрение нетканого операционного белья одноразового пользования в оперативной гинекологии. 7.1.6. ШОВНЫЕ МАТЕРИАЛЫ В оперативной гинекологии широко применяются полимеры в виде шовных материалов. Шовные материалы — капрон, лавсан, сверхтонкий ареактивныи шовный материал из полифиламентных соединений (диаметр нити № 6/0—10/0) обеспечивают надежную герметизацию тканей, снижают до минимума риск специфических осложнений в ближайшем послеоперационном периоде и позволяют считать маловероятным такое осложнение, как лигатурные и рубцовые стриктуры. Современный абсорбируемый и неабсорбируемый шовный материал не влияет на функциональное состояние половых органов, в том числе маточных труб. Оптимальным материалом является викрил и дексон. 7.1.7. СИЛИКОНОВЫЕ МАТЕРИАЛЫ Полимерные материалы в гинекологии широко используются при выполнении реконструктивно-пластических операций, например, ВМС после пластики матки по поводу пороков развития, катетеры для введения в маточные трубы и матку при пластике труб, дренажные трубки. Наилучшим пластическим материалом является силикон, отличающийся гибкостью и эластичностью, ареактивностью. Наиболее совершенны двухпросветные силиконовые дренажные трубки для аспирационно-промывного дренирования. Они используются также при контрольной лапароскопии после реконструктивно-пластических операций на матке и маточных трубах (см. раздел 7.3). Применяются силиконовые протекторы в виде воронки, используемые как приемник фолликулярной жидкости и яйцеклетки во время овуляции при абсолютном трубном бесплодии (см. раздел 7.8). Анализ представленных данных показывает высокую эффективность применения различных полимерных материалов в оперативной гинекологии, что способствует как совершенствованию техники реконструктивно-пластических операций, так и профилактике и лечению послеоперационных осложнений. 7.1.8. ЭМБОЛИЗАЦИЯ СОСУДОВ ТАЗА В практической медицине нередки ситуации, когда применение обычных методов остановки кровотечений невозможно или сопряжено с проведением сложных операций, порой представляющих риск для жизни больного. Все известные хирургические методы предполагают воздействие на сосуд извне (перевязка, электрокоагуляция, иссечение кровоточащего участка или даже удаление целого органа). Однако они не всегда выполнимы при тяжелом состоянии больной. Новым направлением в хирургии является внутрисосудистое перекрытие русла кровоточащего сосуда с помощью искусственных частиц — эмболов. Одновременно с решением клинических задач постоянно шел поиск оптимального окклюзирующего материала. Основное требование к ним — это «медицинская чистота», отсутствие низкомолекулярных примесей, способных оказать на организм вредное воздействие. Кроме того, материал должен быть биосовместим, т. е. вызывать минимальную воспалительную реакцию, не оказывать общего токсического, канцерогенного, аллергизирующего действия и обладать высокой устойчивостью к воздействию внутренней среды живого организма. С этих позиций весьма удачными оказались эмболы из гидрогеля или точнее поли-2-гидроксиэтилметакрилата, созданные совместно сотрудниками Института хирургии им. А. В. Вишневского АМН СССР, Института макромолекулярной химии ЧССР и Института химической физики АН СССР. Эмболы, как правило, представляют собой шарики диаметром от 0,05 до 1,5 мм или цилиндры разной толщины (0,5—4 мм) и длины (рис. 7.3). Они имеют губчатую структуру. Поры в них занимают около 50—60 % по объему, причем величину и форму пор можно регулировать. Установлено, что лечебная эмболизация в 1-е сутки вызывает гиперкоагуляционную реакцию, т. е. резко усиливает свертываемость крови. Сразу после введения эмболов повышается агрегация тромбоцитов, затем активируются и другие гемостатичес-кие факторы. Гиперкоагуляция возрастает до 3—5-х суток, затем ослабевает и нормализуется к 10—-15-м суткам после эмболиза-ции. Существенно, что активация тромбообразующих факторов наблюдается даже у больных с тяжелыми гипокоагуляционными нарушениями, у которых кровотечения носят угрожающий характер. Введенные в сосуд эмболы набухают и тем самым обеспечивают стойкий закупоривающий эффект. Несмотря на плотное прилегание набухающих эмболов к стенке сосуда, они не оказывают на него раздражающего и повреждающего действия. Параллельно с гиперкоагуляционной реакцией происходит адсорбция белков крови на поверхности эмбола, что усиливает процесс местного тромбообразования. Со временем тромб прорастает соединительной тканью, проникающей также в поры эмбола. В результате, что крайне важно, исключаются восстановление проходимости эмболизированного сосуда и повторные кровотечения. Новое поколение рентгеноконтрастных эмболов дает возможность наблюдения за динамикой их движения. Кроме того, рент-геноконтрастные эмболы с йодидом серебра обладают еще антимикробным действием, что исключает возможность местного инфицирования тканей вокруг эмболов. Эмболизация применяет-
ся с целью как остановки кровотечения, так и профилактики массивных кровопотерь у больных группы высокого риска возникновения кровотечений. Показаниями к эмболизации в акушерстве и гинекологии являются ангиодисплазии таза и ангиомы в сочетании с любой гени-тальной патологией, требующей оперативного вмешательства: -опухоли матки и придатков, аномалии развития, генитальные свищи, забрюшинные опухоли таза больших размеров, беременность и роды при наличии выраженных нарушений развития сосудистого русла бассейна малого таза, варикозного расширения вен таза, а также массивные коагулопатические маточные кровотечения, сопровождающиеся ДВС-синдромом, вызванные акушерской ситуацией или заболеванием крови (болезнь Верльгофа, болезнь Виллебранда и т. д.), когда в связи с общим тяжелым состоянием больных обычное оперативное вмешательство крайне опасно или невозможно. Применяются два вида эмболизации: закрытый селективный и открытый интраоперационный. Эти методы не конкурируют друг с другом, применяются каждый по своим показаниям, а иногда сочетаются при лечении одной больной. При закрытом селективном методе эмболизацию проводят в специальной рентгеновской операционной, снабженной электронно-оптическим преобразователем с телевизионным устройством. Выполняют ее с помощью катетера, введенного под местным обезболиванием в сосудистую систему через бедренную артерию. После внутривенного введения верографина выполняют ангиографию, чтобы определить характер поражения сосудов и локализацию источника кровотечения, а также уточнить положение катетера в просвете сосуда. Затем через катетер вводят эмболы (30—40 на процедуру), взвешенные в 3—5 мл изотонического раствора хлорида натрия до полной окклюзии сосуда. Завершают эмболизацию контрольной ангиографией, уточняя локализацию конгломерата эмболов и эффект их воздействия. При открытой (интраоперационной) эмболизации, применяемой при ангиодисплазиях таза и забрюшинных опухолях, эмболы вводят через специальный шприц в обнаженный при операции приводящий (по отношению к ангиоме) магистральный сосуд. 7.2. ИСПОЛЬЗОВАНИЕ КОНСЕРВИРОВАННЫХ ТКАНЕЙ В ряде случаев эффективность оперативных' вмешательств остается недостаточно высокой, особенно при повторных операциях, когда имеют место значительные дефекты и рубцовые перерождения тканей. Несмотря на положительные результаты внедрения в оперативную гинекологию некоторых полимерных материалов, остается довольно высокой отторгаемость лавсановых и капроновых сеток. Это наблюдали все авторы, применяющие их при реконструктив-но-пластических операциях у больных с миомой матки, шеечно-влагалищными, мочеполовыми и кишечно-влагалищными свищами. Следовательно, является оправданным применение консервированных тканей для замещения дефектов мышечной ткани и укрепления швов при выполнении реконструктивно-пластических операций в гинекологии. Методом выбора является консервированная твердая мозговая оболочка. Еще в годы Великой Отечественной войны было отмечено свойство твердой мозговой оболочки (ТМО) противостоять инфекции [Шамов В. И. и др., 1950]. Это замечательное свойство оказалось характерным и для ее трансплантатов. В последние годы трансплантаты ТМО применяются не только нейрохирургами, но также абдоминальными, торакальными, кардиальными, сосудистыми хирургами, ортопедами-травматологами, отоларингологами, офтальмологами, урологами и др. при различных пластических и восстановительных операциях. Трансплантатами ТМО удается надежно ликвидировать обширные дефекты стенки груди и живота, герметизировать ненадежные культи бронхов и легкого, воссоздавать клапанный аппарат сердца, закрывать окон-чатые дефекты кровеносных сосудов и полых пищеварительных органов, ликвидировать свищи и дефекты мочеполовых органов вплоть до замещения части стенки мочевого пузыря и уретры. Подвергнутые консервирующей обработке (замораживание, лиофилизация либо химическое воздействие смесью 0,5—4 % раствора формалина, 96 % глицерина, 0,5—2 % раствора этиле-ноксида илир-пропиолактона) трансплантаты ТМО хорошо сохраняют структурные и функциональные свойства до момента использования при операции. Большое количество коллагеновых и эластических волокон, переплетающихся в трех различных направлениях, обеспечивает высокие механические свойства ТМО. Ограниченное количество клеточных элементов обусловливает весьма низкую иммунологическую активность ее трансплантатов и отсутствие клинических, морфологических признаков отторжения либо явлений сенсибилизации реципиента. Весьма важным свойством трансплантатов ТМО является их тканевая адаптивность. Не вызывая вокруг себя грубых разрастаний соединительной ткани, они подвергаются постепенному замещению тканями реципиента. Так, В. Г. Дунаев (1975) в опытах по замещению сухожилий и связок при наблюдении от 10 до 250 дней констатировал преобразование трансплантатов ТМО в сухожилиеподобную ткань. Полученные нами результаты оперативных вмешательств с использованием консервированных тканей позволяют рекомендовать консервированную ТМО для реконструктивно-пластических операций в гинекологии при выраженных дефектах и Рубцовых изменениях тканей (пороки развития матки, миома матки, влагалищные операции). Приводим описание способа зашивания с помощью ТМО старых разрывов шейки матки III степени и высоких рецидивирующих шеечно-влагалищных свищей. Шейку Матки захватывают пулевыми щипцами и подтягивают книзу. Канал шейки матки расширяют при помощи расширителей Гегара до № 12. Производят расщепление тканей шейки матки на внутренний и наружный лоскуты вокруг свищевого хода и на 1,5—2 см выше верхнего края (при разрыве шейки матки III степени расщепление по линии рубца и на 1,5—2 см выше с отсе-паровкой стенки влагалища в области влагалищного свода). Область внутреннего зева укрепляют 2—3 швами из хромированного кетгута или ареактивного синтетического материала (викрил, дексон). Канал шейки матки формируют отдельными кетгутовыми швами узлами внутрь на расширителе. Между расщепляемыми и мобилизованными тканями вводят каркас из консервированной ТМО размером 1,5X2,5 см (или более при больших дефектах). Каркас четырьмя отдельными хромированными кетгутовыми швами по углам фиксируется к мобилизованной верхней границе свиЩа или разрыва. Наружный лоскут расщепленной шейки матки ушивают отдельными кетгутовыми швами. Наружный зев формируют отдельными тонкими кетгутовыми швами, наложенными в радиальном направлении. Шейку матки и влагалища санируют раствором диоксидина через двухпросветную силиконовую дренажную трубку в течение 36—48 ч. С целью профилактики расхождения швов можно накладывать на область
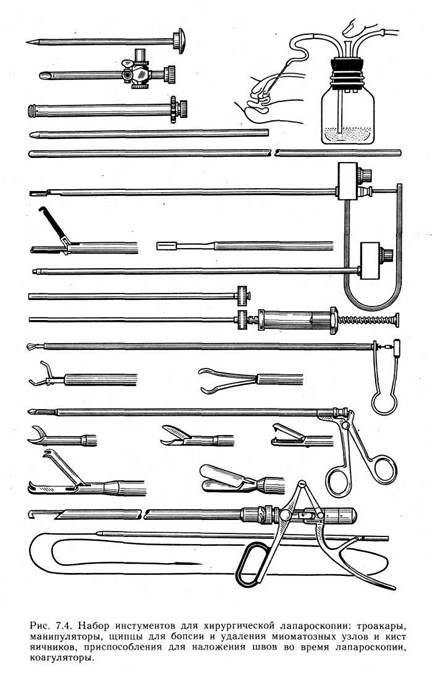
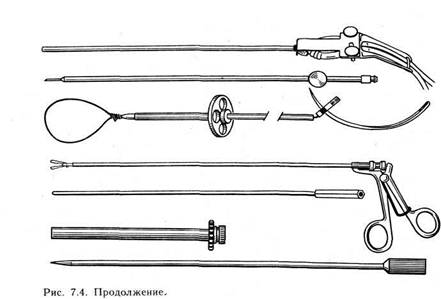
шва тампон из гидрогеля с хлоргексидином размером 1,5X3 см (концентрация 0,15 в тампоне на 72 ч). Применение указанной методики способствует профилактике рецидивов и более благоприятному течению послеоперационного периода. 7.3. ЭНДОСКОПИЧЕСКАЯ ХИРУРГИЯ ВНУТРЕННИХ ПОЛОВЫХ ОРГАНОВ Благодаря успехам общей эндоскопии, совершенству современных лапаро- и гистероскопов стало возможным выполнение многих гинекологических лечебных манипуляций и операций без чревосечения. Для хирургической лапароскопии необходима оптическая система, лучше с троакаром диаметром 11 мм, позволяющим производить фотографирование и телесъемку. Для пневмопери-тонеума применяют углекислый газ, подачу которого контролируют автоматически с помощью электронной установки, что позволяет поддерживать постоянное давление в брюшной полости в процессе манипуляций подачей 4,5 л газа в минуту. Необходимыми компонентами для выполнения хирургических манипуляций при лапароскопии являются инструменты для остановки кровотечения и специальный набор хирургических инструментов для лапароскопии (рис. 7.4). Подготовка больной к хирургической лапароскопии такая же, как к чревосечению. Обезболивание должно быть общим, поскольку оно позволяет мобилизовать и рассмотреть тазовые органы, провести диагностические и лечебные манипуляции.
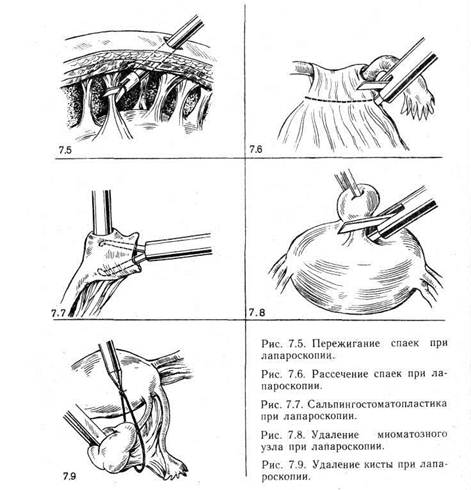
Типичными лапароскопическими процедурами являются разделение спаек в малом тазе и пункция овулирующего фолликула с целью аспирации фолликулярной жидкости и яйцеклетки при необходимости экстракорпорального оплодотворения. Кроме того, производят биопсию половых желез, пункционную биопсию и энуклеацию кист яичников, частичную резекцию или удаление яичников и придатков матки. При патологических процессах в маточных трубах выполняют сальпинголизис, фимбриопластику, сальпингостомию, удаление плодного яйца при трубной беременности, стерилизацию, консервативную миомэктомию при небольших подбрюшинных миомах, коагуляцию очагов эндометриоза, резекцию яичников при эндометриоидных кистах. На органах брюшной полости могут производиться разделение спаек между петлями кишечника, аппендэктомия. Основные варианты операций представлены на рис. 7.5—7.9 [Semm K-, 1983]. Особую роль лапароскопия играет в диагностике и лечении бесплодия. В тех случаях, когда хирург обнаруживает доброкачественную опухоль или опухолевидное образование, эндометриоз в начальных стадиях заболевания, имеется возможность выполнить традиционные оперативные вмешательства путем лапароскопии. Оперативное лечение при лапароскопии имеет ряд недостатков: не обеспечивается полная абластичность, невозможно во всех случаях удалить капсулу кистозного образования (которое может оказаться кистомой яичника). При необходимости проведения обширных коагуляций, с целью остановки кровотечения, выжигания мелких миоматозных узлов, ликвидации очагов эндометриоза и эндометриоидных кист лучше выполнить лапарото-мию, которая дает возможность более полноценно произвести удаление этих образований. Мы придаем особое значение лапароскопии как процедуре контроля эффективности лечения эндометриоза и трубного бесплодия. Нами разработана методика лапароскопии, выполняемой в первые 4—5 сут после реконструктивно-пластических операций на маточных трубах. Она позволяет практически без анестезии производить осмотр тазовых органов в динамике послеоперационного периода, контролировать проходимость маточных труб, состояние швов, по показаниям проводить санацию и разделение спаек. С этой целью после реконструктивной операции в брюшной полости оставляют две двухпросветные дренажные силиконовые трубки диаметром 6 мм и длиной 11 см. Рекомендуется располагать дренажную трубку со стороны оперируемого органа для наилучшей визуализации при лапароскопии. В 1-е сутки указанные трубки являются пассивными или активными дренажами для эвакуации жидкости из брюшной полости. На 4—5-е сутки после операции производят контрольную лапароскопию. При этом перекрывают одну из трубок, а через другую (после укорочения и специальной обработке изнутри и снаружи) создают пневмоперитонеум углекислым газом. Для обычной диагностической лапароскопии достаточно ввести в брюшную полость около 1,5—2 л газа. В просвет широкой (12 мм) дренажной трубки вводят оптическую систему, через более узкую дренажную трубку вводят манипулятор. Следует обратить внимание на состояние брюшины малого таза, количество и характер экссудата в брюшной полости, состояние тканей оперированного органа (наличие гиперемии, отека, налетов, расположение швов). По показаниям можно проверить проходимость труб раствором индигокармина, введенного в матку через специальную канюлю или катетером Фолея. Образовавшиеся свежие спайки разделяют и коагулируют. Брюшную полость промывают изотоническим раствором хлорида натрия или 0,01 % раствором хлоргексидина.
Проведение контрольной лапароскопии мы считаем важным, поскольку она позволяет не только уточнить состояние оперированных органов, особенности репаративных процессов, но и своевременно установить наличие осложнений и устранить их. Простота и легкость выполнения контрольной лапароскопии, минимальная опасность осложнений, отсутствие необходимости в глубокой и длительной анестезии позволяют считать эти манипуляции методом выбора. 7.4. ИСПОЛЬЗОВАНИЕ ЛАЗЕРОВ Использование лазерной техники при хирургических вмешательствах в гинекологии не получило еще широкого распространения, хотя рядом авторов (О. К. Скобелкин, М. Ф. Стельмах и др.) составлены методические письма, которые должны облегчить внедрение этой методики в хирургическую практику вообще и в операционную гинекологию в частности. Лазеры (оптические квантовые генераторы) — приборы, преобразующие один из видов энергии (электрическая, световая, тепловая, механическая) в монохроматическое когерентное излучение электромагнитных волн ультрафиолетового, видимого и инфракрасного диапазонов. Генерация излучения лазеров может осуществляться в режиме либо молниеносных импульсов, либо непрерывного излучения. Лазеры непрерывного действия осуществляют рассечение тканей, т. е. могут использоваться в качестве светового скальпеля. Многообразие эффектов, которыми сопровождается воздействие лазерного излучения на биологические ткани, обеспечивает оптическим квантовым генераторам широкую сферу использования для различных биологических и медицинских задач. В настоящее время в основе применения лазера в медицине лежит преобразование световой энергии в механическую и тепловую. Принципы лазерного излучения впервые были описаны в 1958 г., а первая лазерная установка сконструирована двумя годами позднее. Название «лазер» состоит из начальных букв английских слов Light amplification by Stimulated Emission of Radiation — усиление света в результате вынужденного излучения. Основным элементом лазера является устройство, содержащее активное вещество, которое при воздействии импульсной лампы и резонатора переходит в возбужденное состояние, излучая монохроматический свет. По виду активного вещества лазеры подразделяются на газовые, твердотельные и работающие на полупроводниках. Излучение лазера имеет три основные характеристики: когерентность, монохроматичность и коллимантность. Когерентное излучение — это излучение, в котором все волны совпадают по фазе в любой точке времени и пространства. Монохроматическое излучение — излучение, в котором все волны имеют одинаковую длину. Коллимантность — это параллельность всех волн. Благодаря этим свойствам излучение может концентрироваться на малых площадях, создавая высокие величины энергии. Хирургические лазеры, т. е. лазеры большой мощности, в настоящее время нашли широкое применение в различных областях медицины: офтальмологии, отоларингологии, урологии, дерматологии, общей хирургии и др. Первое сообщение о применении хирургического лазера в гинекологии относится к 1973 г. В настоящее время в гинекологии применяется пять типов лазера: СО2-лазер, Nd:YAGлa3ep, аргоновый, калий-титаново-фосфатный и гелий-неоновый лазеры. Излучение каждого из этих лазеров имеет специфическую длину волны и вследствие этого различные характеристики. В настоящее время в гинекологии используется в основном СО2-лазер. Излучение СОг-лазера имеет длину волны 10,6 мкм и находится в инфрасветовой части спектра, которая недоступна восприятию человеческим глазом. Это излучение обладает определенными свойствами: 1) энергия хорошо поглощается неотражающими твердыми веществами и жидкостями, в том числе водой, которая является основным содержимым биологических клеток. В воде лучевая энергия поглощается практически полностью на глубине 100 мкм от поверхности; 2) поглощение излучения одинаково в тканях различного цвета; 3) рассеивание в точке воздействия минимально; 4) луч лазера, несущий энергию, может эффективно отражаться зеркалами и хорошо полированными металлами без потери эффективности; 5) эффект воздействия основан на переходе световой энергии в тепловую. При контакте излучения СОг-лазера с биологическими тканями происходит их деструкция, механизм которой изучен рядом исследователей. Ткань разрушается вследствие выпаривания клеточной жидкости. При контакте с лазерным лучом вне- и внутриклеточная жидкость немедленно закипает. Образовавшийся пар деформирует и разрывает тканевые элементы, унося клеточные осколки из раны. Часть этих осколков, проходя через лазерный луч, обугливается, а часть воспламеняется и сгорает. В точке приложения луч лазера разрушает ткани только за счет выпаривания жидкости. Венозные и артериальные сосуды диаметром до 0,5 мм коагулируются. Латеральное распространение эффекта из точки воздействия лазерного излучения невелико. При гистологическом исследовании установлено, что клетки повреждаются на протяжении 500 мкм от точки воздействия и глубина термического некроза не превышает 100 мкм. Из применявшихся в гинекологии хирургических лазеров только СО2-лазер обеспечивает выпаривание и рассечение тканей с достаточной степенью эффективности. Недостатками его являются невидимость излучения, громоздкая система подведения излучения к тканям (необходима система зеркал и линз, так как излучение не может передаваться по имеющимся в настоящее время оптическим волокнам), образование большого количества дыма при выпаривании, что требует применения специального вентиляционного оборудования для его удаления. Аргоновый лазер — газовый лазер, продуцирующий излучение с длиной волны 0,5 мкм, не поглощаемое жидкостями, со слабой возможностью рассеивания и довольно низкой мощностью. Излучение избирательно поглощается пигментами красного цвета, проникает в ткани на глубину до 0,5 мм. Основной эффект — коагуляция тканей. Применение ограничено коагуляцией очагов при малых формах эндометриоза. NdiYAG-лазер (иттрий-алюминиевый гранатовый лазер) — твердотельный лазер на основе легированного неодимом кристалла иттрий-алюминиевого граната, продуцирующий излучение с длиной волны 1,06 мкм, слабо поглощаемое в жидкостях, с умеренным рассеиванием луча и глубоким проникновением в ткани (до 4 мм). Наибольший эффект локализуется не на поверхности ткани, а на глубине 2—3 мм. Основной эффект на тканях — коагуляция, но усовершенствованный Nd:YAG^a3ep с использованием искусственного сапфира может применяться и для рассечения тканей. В гинекологии применялся для коагуляции очагов эндометриоза при лапароскопии и гистероскопической коагуляции эндометрия с целью лечения меноррагий. КТР/532-лазер представляет собой модифицированный Nd:YAG-fla3ep, активным веществом в нем является легированный неодимом кристалл иттрий-алюминиемого граната, продуцирующий излучение. Излучение этого лазера не поглощается жидкостями, имеет тенденцию к умеренному рассеиванию. Глубина проникновения излучения в ткани сходна с таковой аргонового лазера. Основной эффект — коагуляция. Применяется в гинекологии для коагуляции очагов газового эндометриоза I и II стадии. Все перечисленные лазеры имеют одно главное преимущество по сравнению с СО2-лазером: продуцируемое ими излучение может передаваться к месту воздействия по гибкому оптическому волокну. Излучение всех трех типов лазеров видимое, что исключает необходимость применения дополнительных средств для наводки луча в точку воздействия. Поскольку основным эффектом этих лазеров является коагуляция, а не выпаривание тканей, не возникает и проблемы удаления дыма. Однако в связи с гораздо большей по сравнению с СОг-лазером способностью излучения к рассеиванию необходимо уделять большое внимание обеспечению безопасности больного и хирурга, особенно при работе с Nd:YAG- и КТР/532-лазерами. Тем же объясняется гораздо большая зона коагуляционного некроза тканей при использовании этих лазеров. Nd:YAG^a3ep опасен при использовании его вблизи жизненно важных органов вследствие максимального проявления эффекта на большой глубине (2—3 мм) без нарушения целости поверхности тканей. Излучение гелий-неонового лазера, имеющее очень низкую мощность и интенсивный красно-оранжевый цвет, используется в СО2-лазерных хирургических системах для наведения луча СО2-лазера в точку воздействия. Имеются также сообщения о терапевтическом применении гелий-неонового лазера для стимуляции восстановительных процессов.. В Советском Союзе промышленность выпускает лазерные хирургические установки на углекислом газе (СО2-лазеры) «Скальпель-1» мощностью около 25 Вт, «Скальпель-2», «Ромашка- 1» и «Ромашка-2», «Радуга». Аналогичные установки производятся за рубежом. Отечественные лазерные хирургические установки предназначены для работы в обычных операционных стационаров и поликлиник. Энергопитание установки «Скальпель-1» осуществляется от сети напряжением 220 В, потребляемая мощность не более 1,4 кВт. Аналогичны параметры установки «Ромашка-2». Установка «Ромашка-1» включается в трехфазную сеть с напряжением 380 В, потребляемая мощность не более 3 кВт. Охлаждение приборов производится от водопроводной сети с расходом воды до 2 л/мин для установок «Скальпель-1» и «Ромашка-2», около 6 л/мин — для установки «Ромашка-1». Установки всех трех типов смонтированы на колесах и могут свободно перемещаться по операционной. Каждая установка снабжена паспортом, подробной инструкцией по эксплуатации и запасными лампами (лазерами). Монтаж установок производят представители завода-изготовителя. Требования, предъявляемые к операционной, монтажу и эксплуатации установок, в соответствии с современными нормами санитарно-гигиенического режима и мерами защиты от лазерного излучения изложены в «Санитарных нормах и правилах устройства и эксплуатации лазеров» (Москва, 1982). Лазерные разрезы тканей и органов практически бескровны, что связано с коагуляцией крови в просвете кровеносных сосудов диаметром до 0,5 мм в зоне коагуляционного некроза и образованием коагуляционного «лазерного» тромба. Вместе с тем лазерный коагуляционный некроз отличается от некроза, вызываемого электротермическим воздействием или сверхнизкими температурами, тем, что его зона в несколько раз меньше и не оказывает существенного влияния на процессы заживления. Более того, при заживлении лазерных ран на границе поврежденных и неизмененных тканей наблюдается меньшая лейкоцитарная инфильтрация. Благодаря сокращению фазы экссудации и пролиферации заживление лазерных ран происходит быстрее, чем при использовании других инструментов. Преимущества связаны со способностью лазерного луча бескровно в условиях асептики пересекать и испарять разрезаемую ткань, причиняя ей минимальные повреждения. Лазерный скальпель позволяет сократить длительность операции, поскольку отпадает необходимость в наложении зажимов на мелкие кровоточащие сосуды и уменьшается площадь некротизированной ткани. Лазерное излучение обеспечивает стерильность послеоперационной раны, абластичность и, следовательно, снижает опасность развития гнойных осложнений в послеоперационном периоде, ускоряет процесс регенерации в ране. Лазерная хирургическая установка «Скальпель-1» смонтирована в виде вертикальной стойки, внутри которой расположен СОг-лазер мощностью 40 Вт, с диаметром сфокусированного луча 0,5—2 мм и электронные блоки его питания. К. верхней части стойки присоединен зеркальный светопровод, конечная часть которого снабжена фокусирующей линзой. Подвод лазерного излучения по световоду к биологическому объекту не требует существенных усилий со стороны оперирующего. Для удаления дыма, образующегося в процессе рассечения тканей, установка снабжена системой дымоотсоса. Питание осуществляется от сети переменного тока. Существенным достоинством лазерной установки «Скальпель-1» является удобство манипуляций специальным наконечником, через который лазерный луч фокусируется на оперируемую ткань с помощью подводящего устройства в виде металлической указки. Однако в ней, как и в других, не предусмотрено специальных средств защиты от случайного поражения лазерным излучением близлежащих органов оперируемой больной. Хирургу при работе с лучом лазера необходимо надевать очки. Инструменты, применяемые в операционной, должны иметь темное покрытие (чернение) с целью профилактики осложнений, связанных с эффектом отражения от зеркал и других инструментов. Медицинский и технический персонал, допущенный к работе с лазерными хирургическими установками, должен пройти соответствующую подготовку. Наиболее часто СОг-лазер используется при лечении диспла-зий шейки матки, влагалища и наружных половых органов, остроконечных кондилом, эндометриоза. При реконструктивно-пластических операциях СОг-лазер применяется с целью разделения спаек, имплантации и анасто-мозирования маточных труб, сальпингостомии и фимбриопласти-ки, выпаривании внематочной беременности, клиновидной резекции яичников, миомэктомии и метропластики. Особое значение приобретает лечение СО2-лазером при комплексной терапии больных эндометриозом, когда наряду с выпариванием очагов эндометриоза производят дополнительную обработку ложа эндомет-риоидных кист, очага ретроцервикального эндометриоза. Начиная с 1979 г., при использовании СОг-лазера его лучи направляют через операционный канал лапароскопа, что позволяет производить разделение спаек при бесплодии, фимбрио- и стоматопластику, коагуляцию очагов эндометриоза. Положительное действие лазерного излучения при рассечении тканей (быстрое заживление лазерных ран с формированием более нежного рубца, лучший гемостаз во время проведения опе- раций, абластичность, уменьшение количества спаек после операции) легло в основу использования нами высокоэнергетического СОг-лазера при выполнении органосохраняющих операций на половых органах. Мы применяем лазерную хирургическую установку «Ромаш-ка-2». Она обеспечивает два режима работы — ручной и автоматический. В ручном режиме установку включают и выключают при помощи ножной педали. В автоматическом режиме включение осуществляют нажатием на педаль, а отключение происходит автоматически через промежуток времени, заданный хирургом с помощью реле времени, расположенного на лицевой панели пульта управления. Передача излучения Со2-лазера от излучателя к операционному полю происходит с помощью шарнирного световода, который прикрепляется к кольпоскопу. Конструкция лазерной установки «Ромашка-2» позволяет монтировать ее с кольпоскопом для проведения оперативных вмешательств на шейке матки. Луч СОг-лазера невидим, поэтому лазерная установка снабжена видимым лучом гелий-неонового лазера, дающего свечение в виде красного пятна, которое сфокусировано в центре поля зрения кольпоскопа. Лазерный луч перемещают при помощи рукоятки микроманипулятора, расположенного на корпусе кольпоскопа. Дата добавления: 2014-12-12 | Просмотры: 2897 | Нарушение авторских прав |