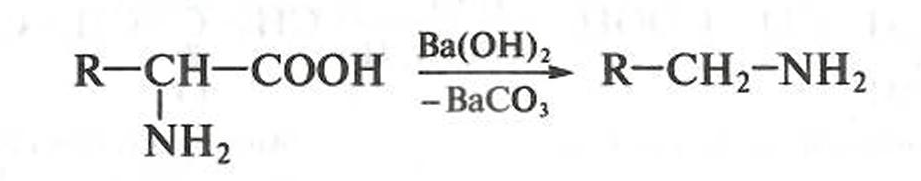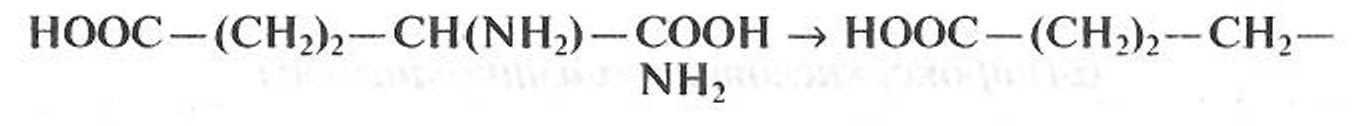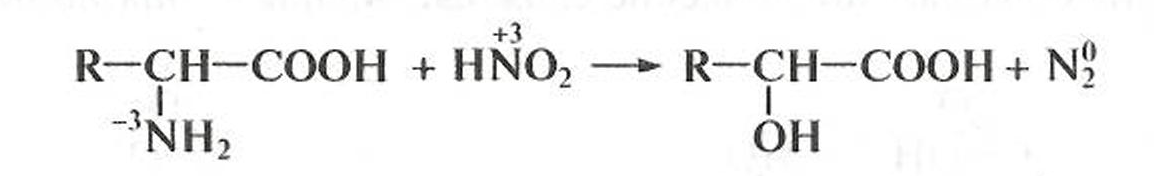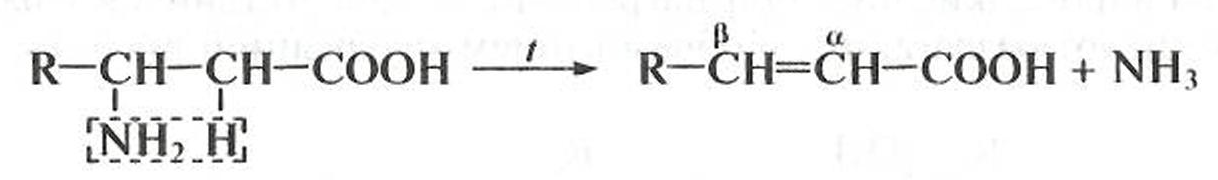|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Гидроксикислоты и аминокислоты
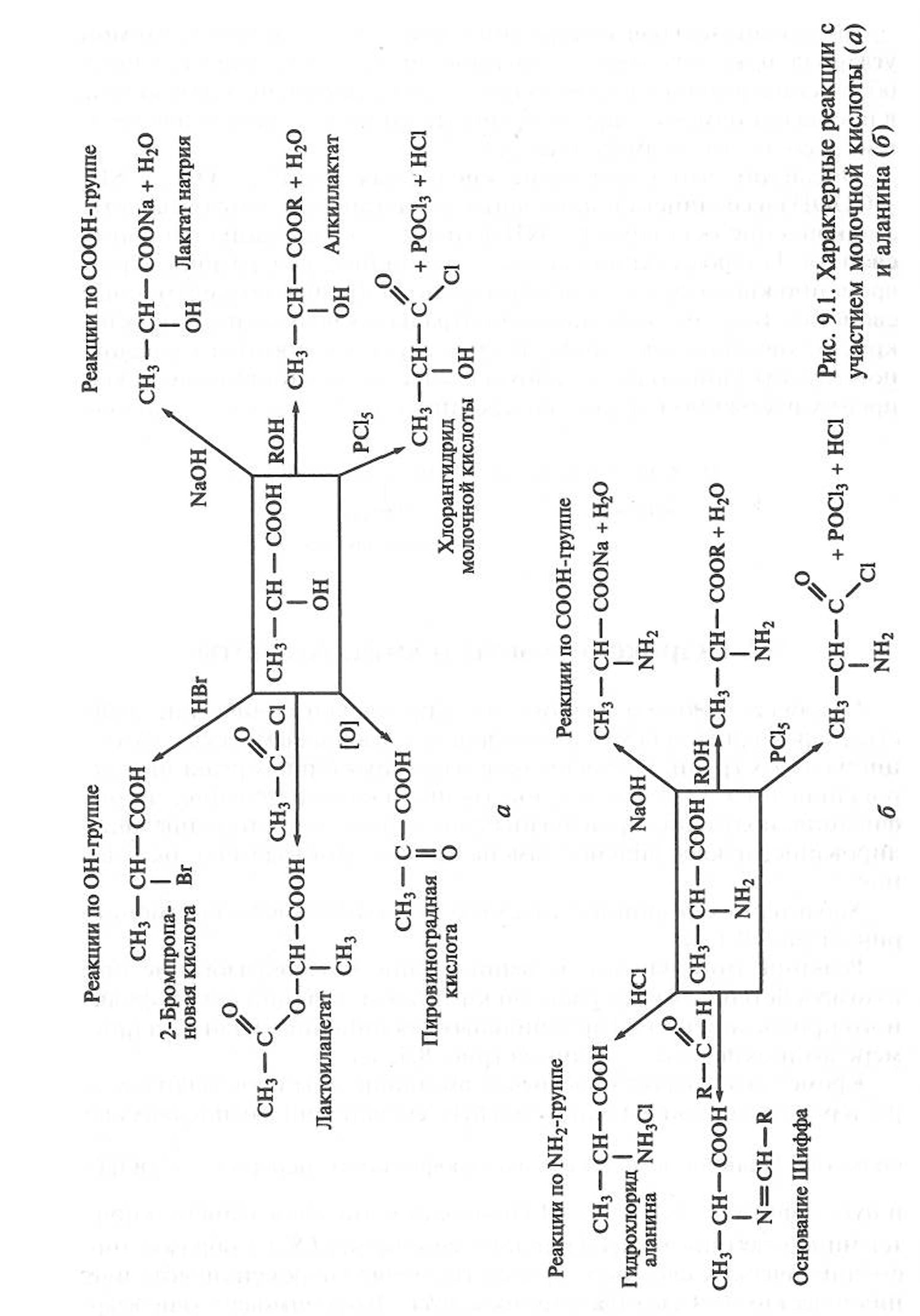
Гидроксикислоты и аминокислоты проявляют химические свойства, характерные для каждой из присутствующих в молекуле функциональных групп. Примеры наиболее характерных реакций гидроксикислот по карбоксильной группе: солеобразование, этерификация, получение производных; по гидроксильной группе: ацилирование, нуклеофильное замещение на атом галогена, окисление. Характерные реакции с участием молочной кислоты демонстрирует рис. 9.1, а. Реакции аминокислот по аминогруппе (солеобразование при взаимодействии с минеральными кислотами, реакции нуклеофильного присоединения к карбонильным соединениям) даны на примере аминокислоты — аланина (рис. 9.1, б) Кроме того, гидроксикислоты и аминокислоты проявляют нехарактерные для монофункциональных соединений специфические свойства. Наличие в молекуле электрофильного центра и нуклеофила
висимости от расположения функциональных групп может протекать внутри- или межмолекулярно. α-Гидроксикислоты и α-аминокислоты При близком расположении функциональных групп реакция дегидратации проходит межмолекулярно, при этом α-гидроксикислоты образуют циклические сложные эфиры — лактиды:
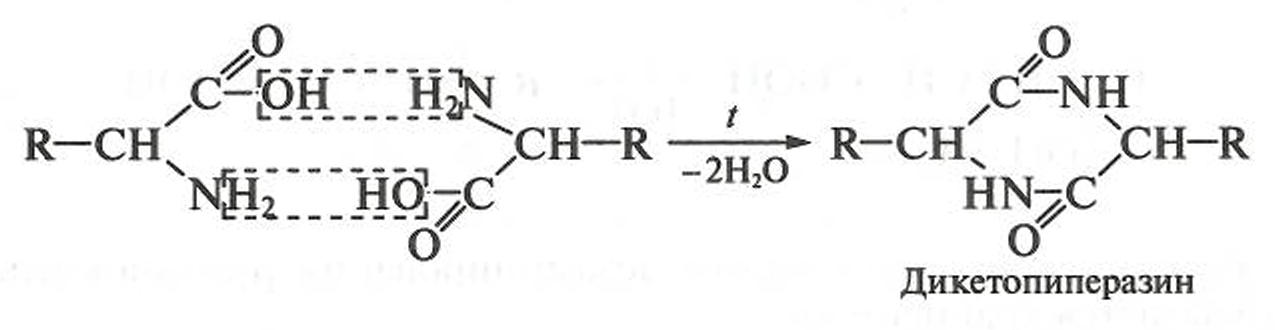
α-Аминокислоты в этих условиях (при незначительном нагревании) образуют циклические амиды — дикетопиперазины:
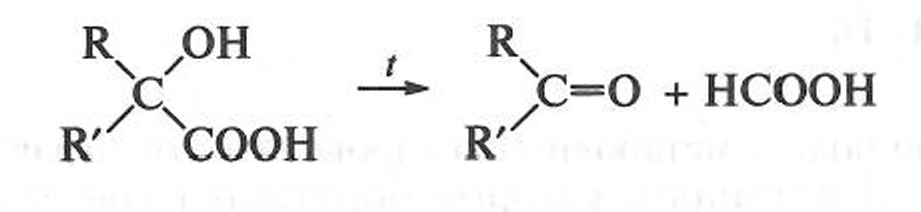
α-Гидроксикислоты при нагревании в присутствии минеральных кислот разлагаются с образованием муравьиной кислоты:
α-Аминокислоты при нагревании (в присутствии гидроксида бария) подвергаются декарбоксилированию:
В условиях организма аналогичные реакции (реакции ферментативного декарбоксилирования) протекают в присутствии фермента декарбоксилазы и кофермента — пиридоксальфосфата. На-
пример, декарбоксилирование глутаминовой кислоты приводит к образованию γ-аминомасляной кислоты:
α-Аминокислоты подвергаются окислительному дезаминированию при действии азотистой кислоты:
β-Гидроксикислоты и β-аминокислоты Для этих соединений преобладают реакции элиминирования (Е), происходящие при незначительном нагревании и приводящие к образованию α,β-ненасыщенных карбоновых кислот. Реакция дегидратации β-гидроксикислот протекает по схеме:
Реакция неокислительного дезаминирования β-аминокислот описывается уравнением
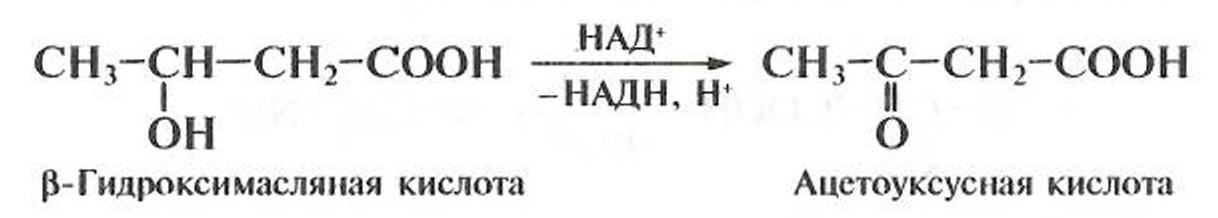
Большую роль в метаболизме гидроксикислот играют реакции окисления, в результате которых образуются соответствующие оксокислоты, например:
В условиях организма реакция осуществляется в виде произ-водных кофермента А (тиоэфиров) при участии кофермента НАД+ в качестве окислителя (см. гл. 5).
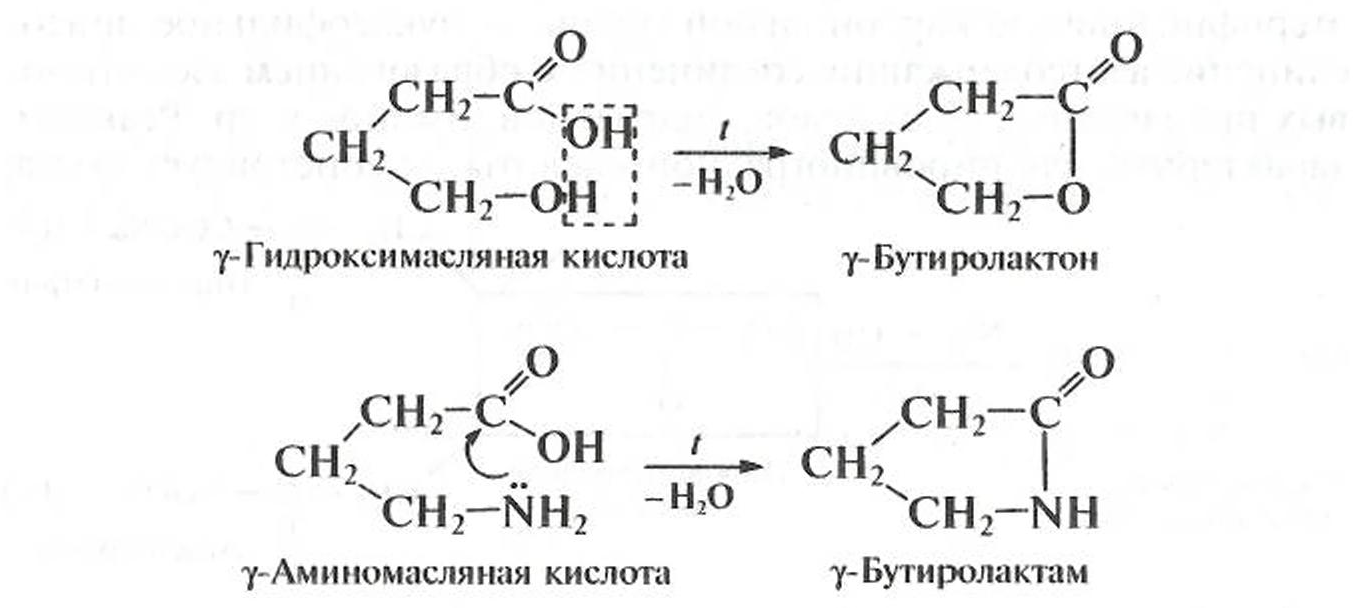
γ-Гидроксикислоты и γ-аминокислоты Значительная удаленность функциональных групп друг от друга в молекуле (в γ- и δ-положении) обусловливает протекание реакций дегидратации внутримолекулярно. Такое протекание реакций оказывается энергетически более выгодно, так как приводит к замыканию устойчивых пяти- и шестичленных циклов; кроме того, внутримолекулярной реакции способствует сближенность в пространстве функциональных групп за счет нелинейной конформации молекулы. В результате реакций дегидратации образуются циклические продукты — циклические эфиры — лактоны и циклические амиды — лактамы:
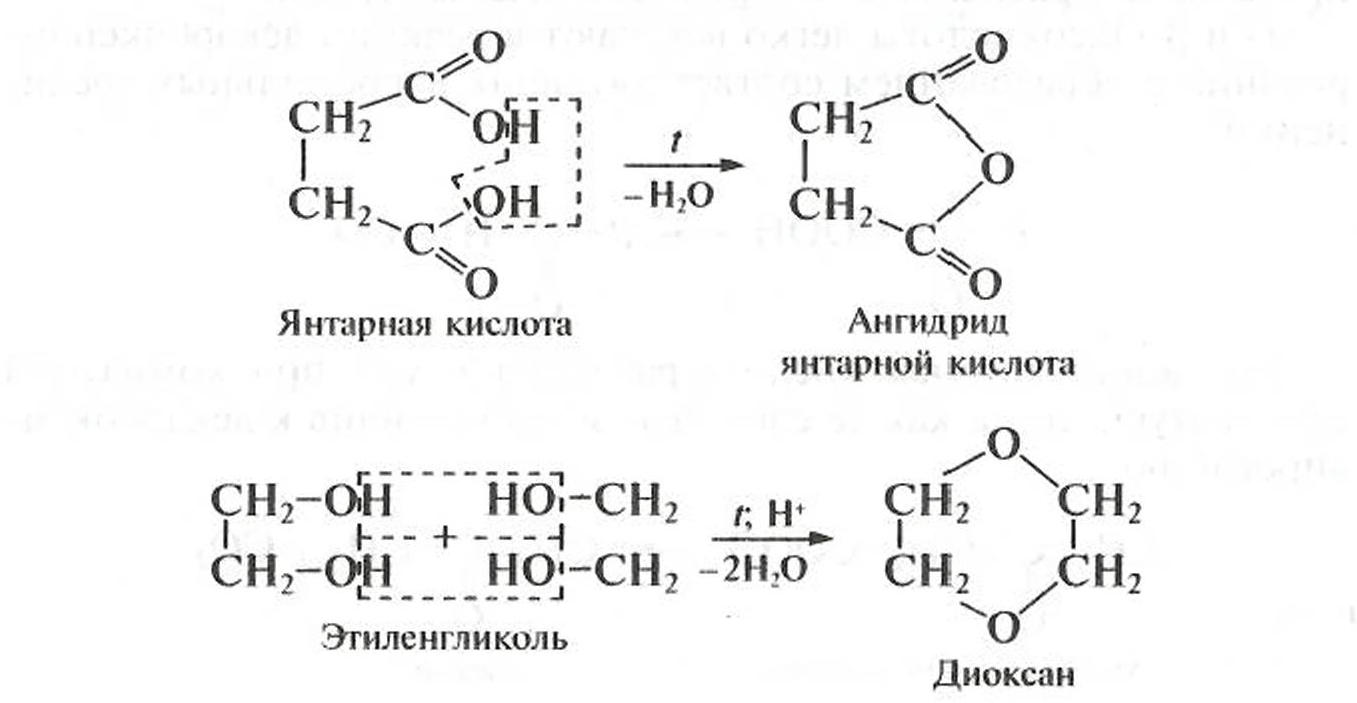
Реакции циклизации также имеют большое значение для полифункциональных соединений, при этом сохраняется общая закономерность: при близком расположении функциональных групп преобладает межмолекулярный механизм реакций, а при удаленном — внутримолекулярный, например:
В более сложных условиях в результате межмолекулярной дегидратации этиленгликоля образуются макроциклические полиэфиры (краун-эфиры; см. подразд. 1.2.4). Внутримолекулярная дегидратация этиленгликоля с образованием оксида этилена (эпоксида) не происходит.
Дата добавления: 2015-01-18 | Просмотры: 3956 | Нарушение авторских прав |
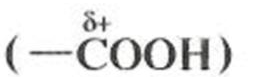
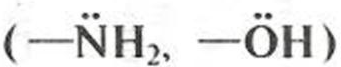 приводит к атаке последнего и протеканию реакции нуклеофильного замещения (S N) с образованием циклических сложных эфиров (в случае гидроксикислот) или циклических амидов (для аминокислот). Это взаимодействие в за-
приводит к атаке последнего и протеканию реакции нуклеофильного замещения (S N) с образованием циклических сложных эфиров (в случае гидроксикислот) или циклических амидов (для аминокислот). Это взаимодействие в за-