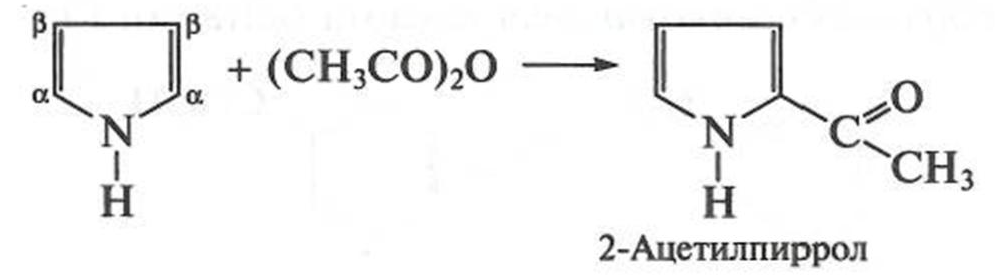|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
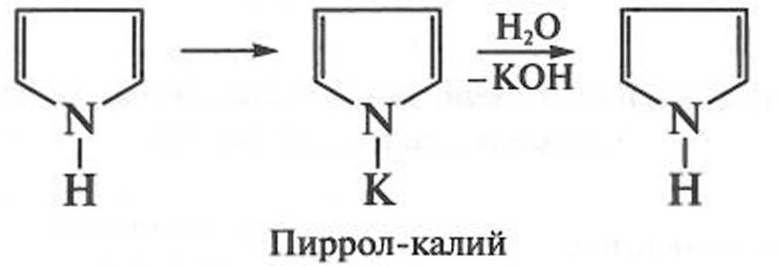
Химические свойства азотсодержащих ароматических гетероциклических соединенийПиррол проявляет слабо выраженные кислотные свойства при взаимодействии с щелочными металлами (калием, натрием) и их амидами (NaNH2, KNH2):
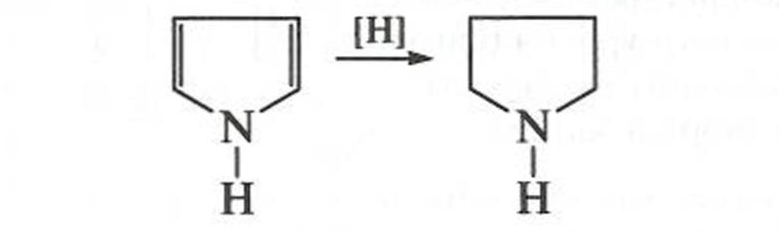
Пиррол восстанавливается в жестких условиях сильными восстановителями с образованием циклического амина — пирролидина, обладающего сильноосновными свойствами:
При нагревании (без катализатора) пиррол легко ацилируется при действии ангидридов и галогенангидридов кислот. Реакция
идет по механизму S E В наиболее реакционноспособное в пирроле α-положение:
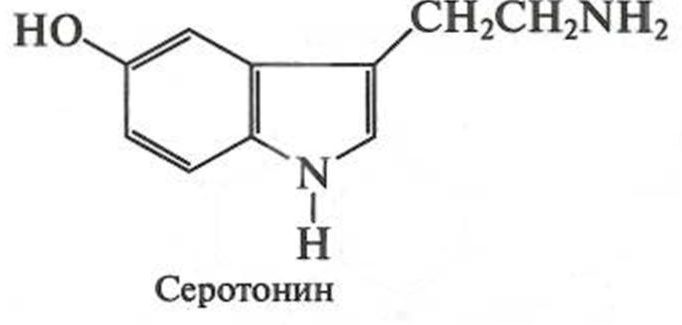
Пиррол проявляет ацидофобные свойства, т.е. не переносит присутствия кислот. Пиррольное ядро входит в состав порфина, порфирина, билирубина, индола (см. далее рис. 9.2). Ядро пирролидина входит в состав природных соединений: алкалоидов, α- аминокислоты пролина. Химические свойства индола во многом аналогичны свойствам пиррола: он практически не обладает основными свойствами, проявляет ацидофобность, ведет себя как слабая NH-кислота, легко окисляется на воздухе. Индол достаточно активен в реакциях S E, но более реакционноспособно β-положение гетероцикла. Ядро индола входит в состав природной аминокислоты триптофана, из которой он образуется в результате последовательно протекающих реакций гидроксилирования и декарбоксилирования. Биологически важные производные индола — скатол, серотонин — нейромедиаторы головного мозга:
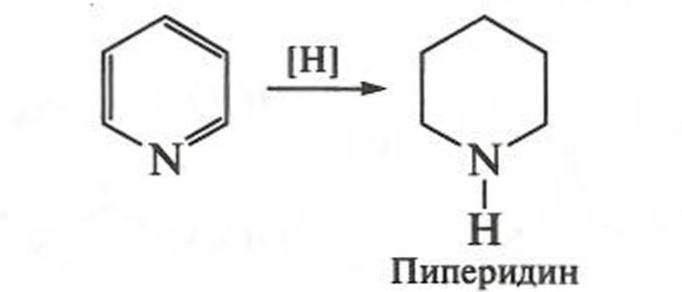
Пиридин проявляет слабые основные свойства, взаимодействуя с кислотами с образованием солей пиридиния, легко восстанавливается мягкими восстановителями — водородом на катализаторе и амидом натрия — с образованием сильноосновного пиперидина:
Пиридиновый цикл, как и бензольный, устойчив к действию окислителей, однако гомологи пиридина легко окисляются даже в мягких условиях. Так, при окислении р-пиколина (3-метилпи- ридина) образуется никотиновая кислота (витамин РР):
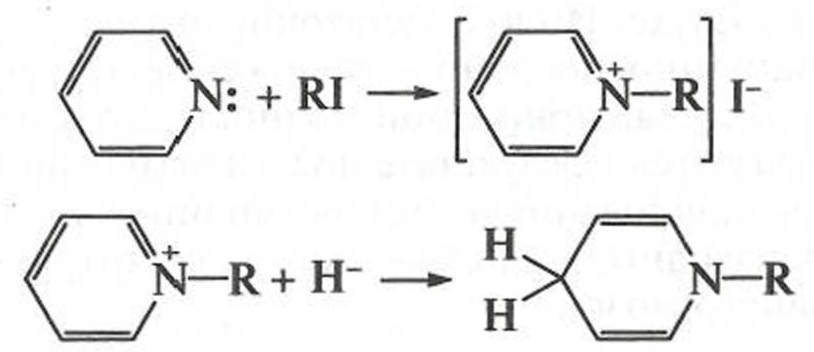
Ядра пиридина и пиперидина входят в состав витаминов (РР, группы В), анестетиков и т.д. Пиридиновый атом азота проявляет нуклеофильные свойства, реагируя с галогеналкапами, при этом образуются алкилпиридиниевые ионы, которые с такими сильными нуклеофилами, как гидрид-ион дают четвертичные алкилпиридиниевые соли. Реакция лежит в основе действия кофермента НАД+ (см. гл. 5), содержащего замещенный катион пиридиния:
Химические свойства хинолина
во многом аналогичны свойствам пиррола. Он проявляет основный характер, при действии алкилгалогенидов образует четвертичные хинолиниевые соли. Окислению легче подвергается бензольное ядро хинолина с образованием 2,3-пиридиндикарбоновой (хинолиновой) кислоты:
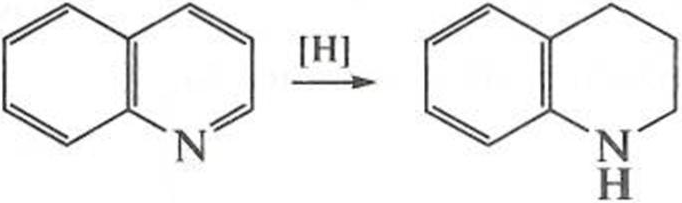
а восстановлению — пиридиновое, при этом образуется тетрагидрохинолин:
Реакции S Е для хинолина идут труднее, чем для бензола, но легче, чем для пиридина, и преимущественно в положении 5 и 8 бензольного ядра. Сочетание в молекуле двух пиридиновых атомов азота приводит к увеличению дефицита электронов внутри цикла и еще большему по сравнению с пиридином понижению активности соединений в реакциях SЕ, а также уменьшению их основности по сравнению с пиридином. Так, шестичленный гетероцикл с двумя пиридиновыми атомами азота — пиримидин — в реакции с серной кислотой образует соли только по одному атому азота:
Производные пиримидина входят в состав ряда алкалоидов и сульфаниламидов. В состав нуклеиновых кислот входят гидроксипроизводные и аминопроизводные пиримидина — урацил, цитозин, тимин (пиримидиновые основания) и аминопроизводные пурина — аденин, гуанин (пуриновые основания). Производные пиримидина — бар-
Таблица 9.6
Дата добавления: 2015-01-18 | Просмотры: 1506 | Нарушение авторских прав |