|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Общая характеристика
Гетероциклические соединения — циклические органические соединения, включающие в цикл кроме атомов углерода один или несколько атомов других элементов (гетероатомов). Гетероциклические системы лежат в основе структуры соединений многих классов биологически активных веществ, таких как дезоксирибонуклеиновые кислоты (ДНК), рибонуклеиновые кислоты (РНК), многих лекарственных препаратов, а также алкалоидов. Последние представляют собой азотсодержащие гетероциклические соединения растительного происхождения, обладающие выраженным физиологическим действием. К ним относятся различные наркотические средства, никотин, кофеин, морфин, атропин и др. Согласно современной классификации гетероциклические соединения делят на три группы: предельные, непредельные и ароматические. Внутри каждой группы соединения различаются по таким признакам, как размер цикла, число гетероатомов и тип гетероатома. Наибольшее значение для организма имеют ароматические азотсодержащие гетероциклические соединения — сопряженные системы, содержащие атом (атомы) азота и удовлетворяющие критерию ароматичности. Приведем важнейшие ароматические гетероциклические системы, для которых по правилам номенклатуры IUPAC сохранены тривиальные названия:
И конденсированные гетероциклические системы:
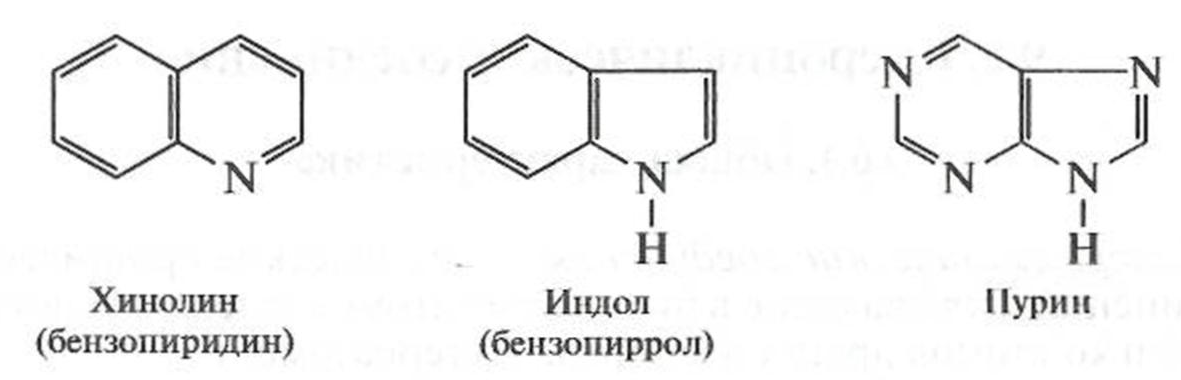
Азотсодержащие ароматические гетероциклические системы можно подразделить на три группы (табл. 9.5). 1. π-Избыточные системы — молекулы с повышенной электронной плотностью внутри цикла. Это происходит, когда пара p-электронов атома азота вступает в сопряжение с π-электронами атомов углерода (р,π-сопряжение). В этом случае гетероатом является электронодонором, а повышение электронной плотности внутри цикла облегчает протекание реакций по механизму SE (в α-положение к гетероатому); соединения легко окисляются. Простейший пример π-избыточной гетероциклической системы — пиррол:
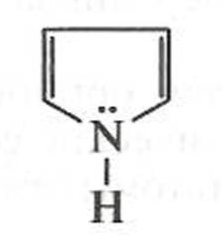
Электронодонорный атом азота, называемый пиррольным, является NH-кислотным центром. Кислотные свойства выражены очень слабо взаимодействием пиррола с щелочными металлами и их амидами. Восстанавливается пиррол с трудом, в жестких условиях, образуя гетероциклическое соединение пирролидин, обладающий сильноосновными свойствами. 2. π-Дефицитные системы — гетероциклические системы с пониженной электронной плотностью внутри цикла. В этом случае в сопряжении с π-электронами атомов углерода участвует только один π-электрон атома азота, а электронодефицитное состояние обусловлено большей по сравнению с атомом углерода электроотрицательностью атома азота. В этом случае гетероатом служит акцептором протона за счет пары электронов, не участвующей в сопряжении, и проявляет основные свойства (пиридиновый атом азота). Электронодефицитное состояние ароматической системы приводит к затруднению реакции S Е (в β-положение к гетероатому). Простейшим примером такой гетероциклической системы является пиридин:
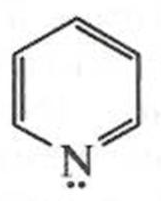
Соединения, содержащие пиридиновый цикл, с трудом окисляются, но легче восстанавливаются (гидрируются). 3. π-Амфотерные системы — наличие в молекуле двух гетероатомов приводит к неравномерному распределению электронной плотности. Так, в молекуле имидазола:
наряду с π-избыточным центром (пиррольным атомом азота) имеется атом с высокой π-дефицитностью (пиридиновый атом азота). Взаимное влияние двух разных по природе гетероатомов сказывается в том, что неподеленная электронная пара пиррольного гетероатома значительно больше вовлечена в образование ароматической π-сопряженной системы, чем у пиррола. Поэтому имидазол обладает выраженными кислотными свойствами: способен образовывать соли с щелочными и щелочноземельными металлами легче, чем пиррол, способен образовывать N-алкил- и N-ацилпроизводные. С другой стороны, сочетание в одной молекуле пир-
Таблица 9.5
Особенности строения и свойства π-избыточных и π-дефицитных гетероциклических систем
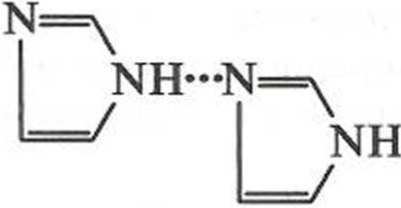
рольного и пиридинового атомов азота обусловливает амфотерные свойства, которые выражены слабо вследствие «слабости» кислотного (—NH) и основного (N:) центров. Таким образом, не происходит полного переноса протона, как в случае аминокислот, однако возможно образование межмолекулярных водородных связей:
Ядро имидазола входит, в частности, в состав аминокислоты гистидина и продукта ее декарбоксилирования биогенного амина — гистамина. Имидазол, а также другие соединения, содержащие атомы пир- рольного и пиридинового типа в одном ядре (оксазол, тиазол, пиразол и др.), называют π-амфотерными гетероциклическими.
Дата добавления: 2015-01-18 | Просмотры: 3504 | Нарушение авторских прав |