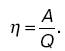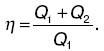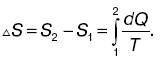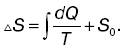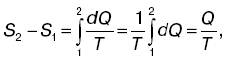|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Второе начало термодинамики. ЭнтропияСуществует несколько формулировок второго закона термодинамики: теплота сама собой не может переходить от тела с меньшей температурой к телу с большей температурой (формулировка Клаузиуса), или невозможен вечный двигатель второго рода (формулировка Томсона). Процесс называют обратимым, если можно совершить обратный процесс через все промежуточные состояния так, чтобы после возвращения системы в исходное состояние в окружающих телах не произошло каких-либо изменений. Коэффициентом полезного действия тепловой машины, или прямого цикла, называют отношение совершенной работы к количеству теплоты, полученному рабочим веществом от нагревателя:
Так как работа тепловой машины совершается за счет количества теплоты, а внутренняя энергия рабочего вещества за цикл не изменяется (DU = 0), то из первого закона термодинамики следует, что работа в круговых процессах равна алгебраической сумме количеств теплоты: A = Q1 + Q2. Следовательно:
Количество теплоты Q1, полученное рабочим веществом, положительно, количество теплоты Q 2, отданное рабочим веществом холодильнику, отрицательно. Сумму приведенных количеств теплоты для обратимого процесса можно представить как разность двух значений некоторой функции состояния системы, которую называют энтропией:
где S2 и S1 – энтропия соответственно в конечном втором и начальном первом состояниях. Энтропия есть функция состояния системы, разность значений которой для двух состояний равна сумме приведенных количеств теплоты при обратимом переходе системы из одного состояния в другое. Физический смысл энтропии:
Если система перешла от одного состояния к другому, то независимо от характера процесса изменение энтропии вычисляется по формуле для любого обратимого процесса, происходящего между этими состояниями:
где Q – полное количество теплоты, полученное системой в процессе перехода из первого состояния в состояние второе при постоянной температуре Т. Эту формулу используют при вычислении изменения энтропии в таких процессах, как плавление, парообразование и т. п. Дата добавления: 2015-02-02 | Просмотры: 850 | Нарушение авторских прав |