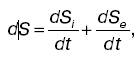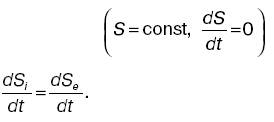|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Стационарное состояниеПринцип производства энтропии. Организм как открытая система Выше была описана направленность термодинамических процессов в изолированной системе. Однако реальные процессы и состояния в природе и технике являются неравновесными, а многие системы – открытыми. Эти процессы и системы рассматриваются в неравновесной термодинамике. Аналогично тому как в равновесной термодинамике особым состоянием является состояние равновесия, так в неравновесной термодинамике особую роль играют стационарные состояния. Несмотря на то что в стационарном состоянии необходимые процессы, протекающие в системе (диффузия, теплопроводность и др.), увеличивают энтропию, энтропия системы не изменяет. Представим изменением энтропии DS системы в виде суммы двух слагаемых: DS =DSi + DSl, где DSi – изменение энтропии, обусловленное необратимыми процессами в системе; DSl – изменение энтропии, вызванное взаимодействием системы с внешними телами (потоки, проходящие через систему). Необратимость процессов приводит к DSi > 0, стационарность состояния – к DSi = 0; следовательно: DSl = DS – DSi < 0. Это означает, что энтропия в продуктах (вещество и энергия), поступающих в систему, меньше энтропии в продуктах, выходящих из системы. Начальное развитие термодинамики стимулировалось потребностями промышленного производства. На этом этапе (XIX в.) основные достижения заключались в формулировке законов, разработке методов циклов и термодинамических потенциалов применительно к идеализированным процессам. Биологические объекты являются открытыми термодинамическими системами. Они обмениваются с окружающей средой энергией и веществом. Для организма – стационарной системы – можно записать dS = 0, S = = const, dS i> 0, dSe < 0. Это означает, что большая энтропия должна быть в продуктах выделения, а не в продуктах питания. При некоторых патологических состояниях энтропия биологической системы может возрастать (dS > 0), это связано с отсутствием стационарности, увеличением неупорядоченности. Формула может быть представлена:
или для стационарного состояния
Из этого видно, что при обычном состоянии организма скорость изменения энтропии за счет внутренних процессов равна скорости изменения отрицательной энтропии за счет обмена веществ и энергией с окружающей средой. Дата добавления: 2015-02-02 | Просмотры: 926 | Нарушение авторских прав |