|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Анаеробне перетворення вуглеводів (дихотомічний розпад)Перетворення (розпад) вуглеводів може відбуватися двома шляхами: анаеробним (за відсутності кисню) і аеробним (у присутності кисню). Аеробні організми використовують молекулярний кисень у якості кінцевого акцептора електронів, тоді як анаероби – проміжні продукти метаболізму. Ще на початку XX ст. російський учений Л.О. Іванов на рослинних об'єктах показав, що розпад глюкози з утворенням етилового спирту і СО2 прискорюється в присутності фосфатної кислоти та її солей. Пізніше А. Гарден і В. Йонг при вивченні дріжджів і Г. Ембден при дослідженні м'язової тканини підтвердили дослідження Л.О. Іванова. Було також доведено, що розщеплення глікогену та глюкози з утворенням молочної кислоти в м'язовій тканині може відбуватись у безкисневому середовищі. При анаеробному розпаді вуглеводів в організмі людини головним енергетичним субстратом є глюкоза, оскільки метаболізм інших вуглеводів однаково пов'язаний з обміном глюкози. Анаеробне перетворення глюкози може здійснюватися шляхом глікогенолізу (якщо процес починається з розпаду глікогену, гліколізу та спиртового бродіння. 4.2.1. Глікогеноліз. У процесі анаеробного розпаду глікогену (глікогенолізу) першим етапом є утворення глюкозо-1-фосфату в присутності ферменту глікогенфосфорилази:
Утворений глюкозо-1-фосфат перетворюється на глюкозо-6-фосфат. Ця реакція каталізується ферментом фосфоглюкомутазою:
Стан рівноваги настає в тому випадку, коли утворюється 95 % глюкозо-6-фосфату і 5 % глюкозо-1-фосфату. Після утворення глюкозо-6-фосфату подальші шляхи глікогенолізу та гліколізу співпадають.
Перша стадія підготовча. Не зважаючи на те, що в реакціях гліколізу окиснюється головним чином глюкоза, поряд з нею в процес можуть вступати інші гексози (фруктоза, маноза, галактоза), які, фосфорилуючись за рахунок АТФ, перетворюються на глюкозо-6-фосфат. Утворення глюкозо-6-фосфату - це практично необоротна реакція, оскільки супроводжується вона вивільненням достатньо великої кількості енергії (рис. 4.3). Реакція каталізує фермент гексокіназа, інгібітором якої є глюкозо-6-фосфат, тобто останній слугує не лише продуктом реакції, а й алостеричним інгібітором. У печінці крім гексокінази існує глюкокіназа, яка каталізує фосфорилування лише глюкози, тоді як гексокіназа – зазначені вище гексози. Далі під впливом ферменту фосфоглюкоізомерази глюкозо-6-фосфосфат перетворюється на фруктозо-6-фосфат. останній у присутності ферменту фосфофруктокінази та за участю АТФ перетворюється на фруктозо-1,6-дифосфат. Фосфофруктокіназа належить до алостеричних ферментів: інгібується АТФ і стимулюється АМФ. При високому показнику АТФ/АМФ активність цього ферменту пригнічується, а гліколіз сповільнюється. Ця реакція аналогічна гексогіназній і практично також незворотна, вона перебігає в присутності іонів магнію і є самою повільною реакцією гліколізу. Утворений фруктозо-1,6-дифосфат під впливом ферменту альдолази (фруктозодифосфатальдолази) розщеплюється на 2 фосфотріози: гліцеральдегід-3-фосфат і діоксіацетонфосфат.
Друга стадія - окиснювальна (рис..4.4). Гліцеральдегід-3-фосфат під впливом ферменту тріозофосфатдегідрогенази окиснюється, при цьому утворюється фермент-субстратний комплекс, який, приєднуючи молекулу неорганічної фосфатної кислоти, перетворюється на 1,3-дифосфогліцерат. Акцептором водню в цій реакції є НАД+, який є коферментом дегідрогенази гліцеральдегід-3-фосфату. Отже, в окисненні гліцеральдегід-3-фосфату беруть участь Н3РО4 і НАД+, останній, відновлюючись, перетворюється на НАДН2. Внаслідок цієї реакції утворюється 1,3-дифосфогліцерат, високоенергетична сполука, яка має макроергічний зв'язок. Наступним кроком є перенесення макроергічного зв'язку з 1,3-дифосфогліцерату на АДФ, внаслідок чого утворюються 3-фосфогліцерат і АТФ. Реакція каталізується ферментом фосфогліцераткіназою. Таким чином, завдяки наявності тріозофосфатдегідрогенази та фосфогліцераткінази енергія, яка вивільняється при окисненні альдегідної групи гліцеральдегід-3-фосфату до карбоксильної групи, запасається в формі енергії АТФ. На відміну від окснювального фосфорилування утворення АТФ з високоенергетичних сполук (тих, що містять макроергічний зв'язок) називається субстратним фосфорилуванням. 3-Фосфогліцерат у присутності ферменту фосфогліцеромутази за рахунок внутрішньомолекулярного перенесення фосфатної кислоти перетворюється на 2-фосфогліцерат. Під впливом ферменту фосфопіруватгідратази (енолази) 2-фосфогліцерат втрачає молекулу води і перетворюється на фосфоенолпіруват, а фосфатний зв'язок в другому положенні стає макроергічним. Наступна реакція характеризується розривом макроергічного зв’язку і перенесенням фосфатного залишка з фосфоенолпірувату на АДФ (реакція субстратного фосфорилування). Реакцію каталізує піруваткіназа, для функціонування якої необхідні іони магнію, а також одновалентні катіони лужних металів (К+ тощо). Далі відбувається відновлення піровиноградної кислоти і утворюється молочна кислота. Реакція перебігає під впливом лактатдегідрогенази і завершує процес гліколізу (чи глікогенолізу):
Реакція відновлення пірувату завершує внутрішній окисно-відновний цикл гліколізу. НАД+ при цьому лише відіграє роль проміжного переносника водню від гліцеральдегід-3-фосфату на піровиноградну кислоту, при цьому сам він регенерується і знову може брати участь у циклічному процесі, який називають гліколітичною оксиредукцією. 4.2.2.1. Човникові механізми перенесення відновленого НАДН із цитоплазми у мітохондрії. У процесі перетворення гліцеральдегід-3–фосфату утворюється дві молекули НАДН, які при окисненні дають не 6 молекул АТФ, а лише 4. Це відбувається тому, що молекули позамітохондріального НАДН не здатні проникати всередину мітохондрій, але електрони, які вони віддають, можуть включатися у мітохондріальний ланцюг біологічного окиснення за допомогою гліцерофосфатногочовникового механізму. Як видно з рис. 4.5, цитоплазматичний НАДН спочатку реагує з цитоплазматичним діоксіацетонфосфатом, утворюючи гліцерол-3-фосфат. Реакція каталізується НАД-залежною цитоплазматичною гліцерол-3-фосфат-дегідрогеназою:
Утворений гліцерол-3-фосфат легко проникає через мітохондріальну мембрану. Всередині мітохондрії інша (мітохондріальна) гліцерол-3-фосфат-дегідрогеназа знову окиснює гліцерол-3–фосфат до діоксіацетонфосфату:
Таким чином, пара електронів (із 1 молекули цитоплазматичного НАДН), що передається у дихальний ланцюг за допомогою гліцерофосфатного човникового механізму дає не 3 АТФ, а 2 молекули АТФ. Така човникова система перенесення відновлених еквівалентів від цитозольного НАДН у мітохондрії існує тільки у скелетних м'язах і мозку.
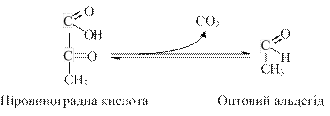
Встановлено, що спочатку від цитозольного НАДН відновлювальні еквіваленти за участю малатдегідрогенази переносяться на цитозольний оксалоацетат. У результаті утворюється малат. останній за допомогою системи, що транспортує дикарбонові кислоти, проникає через внутрішню мембрану мітохондрій у матрикс. Тут малат окиснюється до оксалоацетату, а матриксний НАД+ відновлюється до НАДН, який може тепер передавати свої електрони на ланцюг дихальних ферментів, що локалізований на внутрішній мембрані мітохондрій. У свою чергу, утворений оксалоацетат у присутності глутамату і фермента АсАТ вступає в реакцію трансамінування. Утворені аспарат і α-кетоглутарат за допомогою спеціальних транспортних систем здатні переноситися через мембрану мітохондрій. Трансамінування в цитозолі регенерує оксалоацетат, запускає наступний цикл. У цілому процес включає зворотні реакції, відбувається без затрати енергії,"рушійною силою" його є постійне відновлення НАД+ у цитозолі гліцеральдегід-3-фосфатом, який утворюється при катаболізмі глюкози. Завдяки функціонуванню малат-аспартатного човникового механізму в результаті повного окиснення 1 молекули глюкози може утворитися не 36, а 38 молекул АТФ. 4.2.2.2. Ефект Л. Пастера. Зниження швидкості споживання глюкози і припинення накопичення лактату в присутності кисню носить назву ефекту Пастера. Вперше це явище спостерігав Л. Пастер під час своїх досліджень процесів бродіння при виготовленні вина. В подальшому було показано, що ефект Пастера спостерігається також у тварин, де кисень гальмує анаеробний гліколіз. Значення ефекту Л. Пастера, тобто переходу в присутності кисню від анаеробного гліколізу або бродіння до дихання, полягає в переході клітини на більш ефективний і економний шлях отримання енергії. У результаті швидкість споживання субстрату, наприклад, глюкози, у присутності кисню знижується. Молекулярний механізм ефекту Пастера, очевидно, полягає в конкуренції за АДФ, який використовується для утворення АТФ, між системами дихання та гліколізу (бродіння). В аеробних умовах значно ефективніше, ніж в анаеробних, відбувається зменшення концентрації Фн і АДФ – необхідних субстратів та активаторів ферментів гліколізу і підвищення рівня АТФ, а також відновлення НАД+. АТФ, як алостеричний ефектор фосфофруктокінази, гальмує її активність, що призводить до нагромадження глюкозо-6-фосфату із фруктозо-6-фосфату. Глюкозо-6-фосфат інактивує гексокіназу, що призводить до гальмування використання глюкози клітиною. Тобто, зменшення в присутності кисню кількості Фн і АДФ та відповідне збільшення кількості АТФ призводять до гальмування анаеробного гліколізу. Ефект Кребтрі, або обернений пастерівський ефект, полягає в гальмуванні дихання надлишком глюкози. Спочатку цей ефект був продемонстрований на клітинах пухлин, а потім і н деяких нормальних клітинах. Механізм цього ефекту, очевидно, також пов'язаний з конкуренцією за Фн і АДФ. Надлишок глюкози, яка виступає "пасткою" для фосфату, призводить до підвищення концентрації АДФ у цитоплазмі і дає можливість гліколітичним ферментам ефективніше конкурувати за АДФ з диханням. У клітинах пухлин координація дихання та гліколізу порушена. У них ці два процеси роз'єднані: активніше відбувається гліколіз, що призводить до утворення лактату та дихання. Зазвичай процес гліколізу та дихання функціонують узгоджено: як тільки рівень АТФ у мітохондріях та цитоплазмі досягне певного значення, подальше його утворення в дихальному ланцюзі та гліколізі гальмується. 4.2.2.3. Порушення гліколізу. При недостатній активності ферментів гліколізу (глюкозофосфатізомерази, фосфофруктокінази, фосфогліцератфосфомутази або піруваткінази) порушується процес перетворення глюкози по гліколітичному шляху і, отже, утворення АТФ в процесі гліколітичного фосфорилування. Через відсутність мітохондрій для еритроцитів гліколіз є єдиним джерелом АТФ, яке використовується, головним чином Nа+, К+-АТФазою для створення натрій-калієвого градієнта на мембрані. При блокуванні гліколізу порушується транспорт кисню, відбувається вирівнювання трансмембранного градієнта іонів Na+ і К+ і загибель еритроцитів. Розвивається природжена гемолітична анемія. Це відбувається тому, що при порушенні процесу гліколізу в еритроцитах не утворюється 2,3-дифосфогліцерат, який за умов норми зв’язується з гемоглобіном, знижуючи його спорідненість до кисню та сприяючи, тим самим, дисоціації оксигемоглобіну і переходу кисню в тканини. Біологічне значення та енергетичний баланс анаеробного окиснення глюкози. Біологічне значення процесу гліколізу, перш за все, полягає в утворенні багатих на енергію фосфорних сполук. На перших стадіях гліколізу затрачається 2 молекули АТФ (гексокіназна та фосфофруктокіназна реакції), а в наступних - утворюється 4 молекули АТФ (фосфогліцераткіназна та піруваткіназна реакції). Таким чином, енергетична ефективність гліколізу в анаеробних умовах становить 2 молекули АТФ на одну молекулу глюкози. Відомо, що зміна вільної енергії при розщепленні глюкози до двох молекул молочної кислоти становить приблизно 210 кДж/моль. З цієї кількості енергії приблизно 126 кДж розсіюється у вигляді тепла, а 84 кДж накопичується в формі багатих на енергію фосфатних зв’язках АТФ (макроергічний зв’язок у молекулі АТФ відповідає приблизно 33,6 – 42,0 кДж/моль. Таким чином, коефіцієнт корисної дії анаеробного гліколізу наближається до 0,4 (84/210). У процесі глікогенолізу у вигляді макроергічних сполук накопичуються на дві, а три молекули АТФ, оскільки не витрачається АТФ на утворення глюкозо-6-фосфату. Проте. Якщо врахувати затрати АТФ на біосинтез глікогену (2 молекули АТФ), то чистий вихід становить лише 1 молекулу АТФ на 1 молекулу глюкози. 4.2.4. Спиртове бродіння. Дуже близьким до гліколізу є перетворення вуглеводів у дріжджових клітинах у результаті спиртового бродіння. До утворення піровиноградної кислоти всі етапи перетворення для гліколізу і спиртового бродіння однакові. Подальше перетворення піровиноградної кислоти при спиртовому бродінні відбувається інакше. Якщо при гліколізі або глікогенолізі піровиноградна кислота відновлюється до молочної кислоти, то при спиртовому бродінні вона за допомогою ферменту піруватдекарбоксилази декарбоксилується.
Утворений оцтовий альдегід відновлюється під впливом алкогольдегідрогенази до етилового спирту за рахунок водню, відновленого НАДН, який утворюється, як і у випадку гліколізу, на етапі окиснення гліцеральдегіду-3-фосфату.
Етиловий спирт і СО2 є кінцевими продуктами спиртового бродіння. Цей процес в організмі людини відбувається в порожнині кишки, за добу там утворюється приблизно 1,5 г етанолу. Дата добавления: 2015-11-25 | Просмотры: 2019 | Нарушение авторских прав |


 4.2.2. Гліколіз - це складний анаеробний ферментативний процес послідовних реакцій розпаду глюкози до молочної кислоти з утворенням АТФ. Реакції гліколізу перебігають у кожній клітині людського організму в дві стадії.
4.2.2. Гліколіз - це складний анаеробний ферментативний процес послідовних реакцій розпаду глюкози до молочної кислоти з утворенням АТФ. Реакції гліколізу перебігають у кожній клітині людського організму в дві стадії. Обидві фосфотріози в присутності тріозофосфатізомерази можуть перетворюватися одна в одну, але, оскільки в подальші реакції гліколізу може безпосередньо включатися лише гліцеральдегід-3-фосфат, то в ході подальших перетворень діоксіацетонфосфат перетворюється на гліцеральдегід-3-фосфат.
Обидві фосфотріози в присутності тріозофосфатізомерази можуть перетворюватися одна в одну, але, оскільки в подальші реакції гліколізу може безпосередньо включатися лише гліцеральдегід-3-фосфат, то в ході подальших перетворень діоксіацетонфосфат перетворюється на гліцеральдегід-3-фосфат.


 Відновлений флавопротеїн передає за допомогою КоQ отримані ним електрони в ланцюг біологічного окиснення та спряженого з ним окисного фосфорилування, а діоксіацетонфосфат виходить із мітохондрій у цитоплазму і може знову взаємодіяти з цитоплазматичним НАДН.
Відновлений флавопротеїн передає за допомогою КоQ отримані ним електрони в ланцюг біологічного окиснення та спряженого з ним окисного фосфорилування, а діоксіацетонфосфат виходить із мітохондрій у цитоплазму і може знову взаємодіяти з цитоплазматичним НАДН. У клітинах печінки, нирок і серця діє більш складний малат-аспартатний човниковий механізм, який забезпечує утворення 3 молекул АТФ на одну молекулу цитоплазматичного НАДН (рис. 4.6). Дія такого човникового механізму стає можливою завдяки присутності малатдегідрогенази та аспартатамінотрансферази як в цитозолі, так і в мітохондріях.
У клітинах печінки, нирок і серця діє більш складний малат-аспартатний човниковий механізм, який забезпечує утворення 3 молекул АТФ на одну молекулу цитоплазматичного НАДН (рис. 4.6). Дія такого човникового механізму стає можливою завдяки присутності малатдегідрогенази та аспартатамінотрансферази як в цитозолі, так і в мітохондріях.