 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
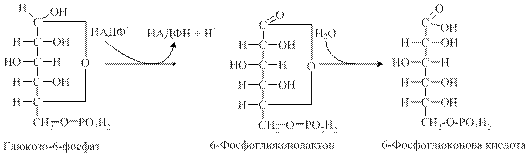
Ферментативні реакції пентозофосфатного шляхуІ Стадія: 1. Спочатку глюкозо-6-фосфат окиснюється НАДФ-залежною глюкозо-6-фосфатдегідрогеназою з утворенням 6-фосфоглюконолактону та НАДФН (для перебігу реакції необхідні іони магнію або кальцію). 2. За допомогою специфічного ферменту глюконолактонази та іонів магнію, марганцю або кальцію 6-фосфоглюконолактон перетворюється на 6-фосфоглюконову кислоту:
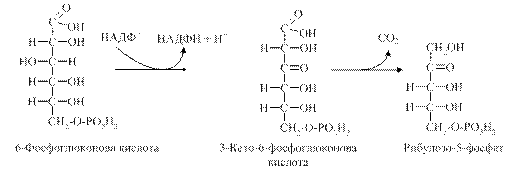
3. Наступним етапом є реакція окиснення 6-фосфоглюконової кислоти під дією фосфоглюконатдегідрогенази (декарбоксилюючої), коферментом якої є також НАДФ. Утворена при цьому 3-кето-6-фосфоглюконова кислота декарбоксилується під дією цього ж ферменту, утворюючи рибулозо-5-фосфат.
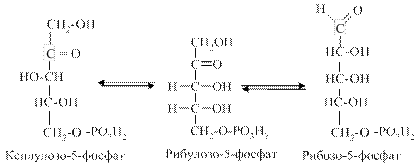
4. Рибулозо-5-фосфат під дією ферменту пентозофосфатізомерази перетворюється на рибозо-5-фосфат, а з нього під дією ферменту епімерази утворюється ксилулозо-5-фосфат.
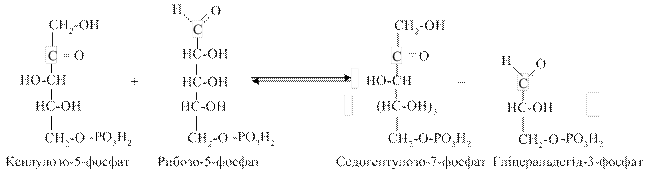
Утворенням рибулозо-5-фосфату (який може легко перетворюватися на свій ізомер рибозо-5-фосфат), тобто окиснювальною стадією, може завершуватися функціонування ПФШ. Така метаболічна ситуація відбувається в печінці, надниркових і статевих залозах, молочній залозі при лактації, тобто в тканинах з переважанням анаболічних процесів із збалансованою потребою в НАДФН (необхідному для синтезу жирних кислот, стероїдів) та рибозо-5-фосфаті (необхідному для синтезу нуклеотидів, нуклеїнових кислот). ІІ стадія. Реакції цього типу не пов’язані з використання кисню та перебігають в анаеробних умовах. Ключовими реакціями цієї стадії є транскетолазна та трансальдолазна. 1. Коферментом у транскетолазній реакції виступає ТПФ, який є проміжним переносником глікольальдегідної групи з ксилулозо5-фосфату на рибозо-5-фосфат:
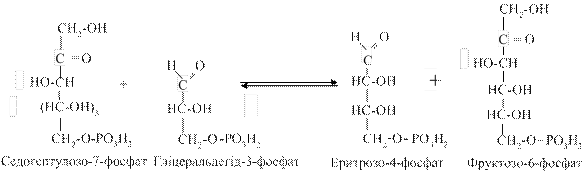
2. Трансальдолазна реакція— взаємодія двох молекул седогептулозо-7-фосфату з двома молекулами гліцеральдегід-3-фосфату з утворенням еритрозо-4-фосфату та фруктозо-6-фосфату (по дві молекули, відповідно):
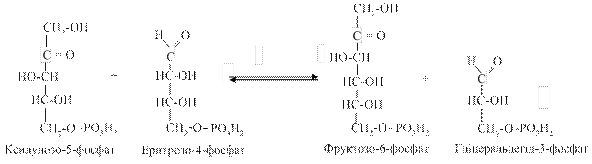
3. Друга транскетолазна реакція полягає у взаємодії двох молекул ксилулозо-5-фосфату (утворених у першій реакції) із двома молекулами еритрозо-4-фосфату з утворенням гліцеральдегід-3-фосфату та фруктозо-6-фосфату (по дві молекули):
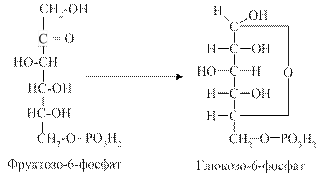
Ці етапи є перетином ПФШ із гліколізом: утворений гліцеральдегід-3-фосфат може надходити до фонду метаболітів гліколізу. Можлива також конденсація двох молекул гліцеральдегід-З-фосфату (через стадію ізомеризації в діоксіацетонфосфат) з утворенням фруктозо-6-фосфату. 4. Ізомеризація п'яти молекул фруктозо-6-фосфату в п'ять молекул глюкозо-6-фосфату (фермент - фосфогексоізомераза) завершує пентозофосфатний шлях.
Вибір напрямку і варіанту ПФШ визначається наявністю субстратів і потребою клітини в продуктах. Так, при потребі в НАДФН і рибозо-5-фосфаті ПФШ може закінчуватись утворенням пентоз і сумарне рівняння буде таким:
Коли потреба в НАДФН перевищує потребу в пентозах, окисна стадія доповнюється переходом пентоз у глюкозо-6-фосфат, який знову окиснюється до пентоз. Сумарний процес можна представити, розглядаючи 6 молекул глюкозо-6-фосфату:
Сумуючи рівняння (1) і (2), отримаємо:
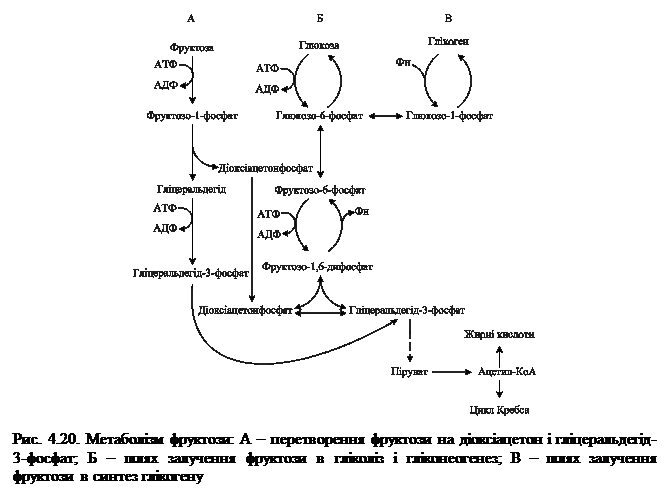
Слід зауважити, що всі молекули СО2 утворюються із різних молекул глюкозо-6-фосфату. Значною потребою в НАДФН відрізняються жирова тканина, молочна залоза в період лактації, печінка (для синтезу жирних кислот), кора надниркових залоз і сім'яники (для синтезу стероїдних гормонів), еритроцити (для відновлення окисненого глутатіону). Тому в цих тканинах велика частина глюкози окиснюється пентозофосфатним шляхом. Коли потреба в рибозо-5-фосфаті для синтезу нуклеотидів значно більша, ніж потреба в НАДФН, то відбувається його утворення з фруктозо-6-фосфату реакціями неокисної стадії ПФШ. Рибозо-5-фосфат, що утворюється при розпаді нуклеотидів і нуклеїнових кислот, через реакції неокисної стадії ПФШ включається в гліколіз та аеробний розпад і, таким чином, може служити джерелом енергії. Регуляторний фермент ПФШ - глюкозо-6-фосфатдегідрогеназа. Активність його гальмується продуктом реакції – НАДФН, таким чином інтенсивність ПФШ залежить від швидкості використання НАДФН у реакціях анаболізму та контролюється співвідношенням у клітині НАДФ+/НАДФН. 4.6.1.1. Біологічне значення ПФШ. Роль ПФШ пов'язана з утворенням двох речовин – НАДФН, необхідного для синтезу різних речовин, і метаболіту – рибозо-5-фосфату. До основних функцій пентозофосфатного обміну можна віднести: 1. за рахунок цього процесу в організмі утворюється приблизно ½ пулу НАДФН (решта - в результаті дії НАДФ-залежних ізоцитратдегідрогенази та малатдегідрогенази), який використовується у відновному синтезі жирних кислот і стероїдів, у знешкодженні аміаку при відновному амінуванні. 2. ПФШ є джерелом рибозо-5-фосфату, який використовується для утворення нуклеотидів нуклеїнових кислот ДНК та РНК, коферментних біомолекул НАД (НАДФ), ФАД, АТФ, КоА, циклічних нуклеотидів 3',5'-АМФ та 3',5'-ГМФ, у синтезі гістидину; ПФШ в еритроцитах генерує НАДФН, необхідний для протидії пероксидному окисненню ненасичених жирних кислот фосфоліпідів еритроцитарних мембран, тобто для попередження гемолізу еритроцитів. У зв'язку із зазначеними біохімічними функціями, реакції ПФШ найактивніше перебігають у тканинах із вираженим анаболізмом, а у клітинах, де найінтенсивніше відбувається синтез ліпідів, вільних нуклеотидів і нуклеїнових кислот (жирова тканина, печінка, молочна залоза в період лактації, кора надниркових залоз, сім'яники). У тканинах з переважанням окиснювального метаболізму, зокрема, у скелетних м'язах, реакції ПФШ протікають дуже повільно. 4.6.1.2. Порушення ПФШ. Відомо приблизно 80 варіантів глюкозо-6-фосфатдегідрогенази еритроцитів, які відрізняються за каталітичною активністю, спорідненістю до субстратів, чутливістю до температури, рН, інгібіторів, електрофоретичною рухливістю. Активність ферменту може бути зниженою різною мірою, аж до нульової. Наявність у людини варіанту глюкозо-6-фосфатдегідрогенази з активністю, близькою до нуля, клінічно проявляється гемолітичною анемією. Механізм розвитку гемолітичної анемії полягає в наступному: в еритроцитах НАДФ+ переводить окиснений глутатіон у відновлений. Останній попереджує пероксидне окиснення ліпідів мембран, захищає від окиснення SН-групи білків, підтримує відновлений стан заліза в гемоглобіні. Знижена продукція НАДФН внаслідок вираженої недостатності глюкозо-6-фосфатдегідрогенази зумовлює зниження рівня в еритроцитах відновленого глутатіону, накопичення Н2О2 і, як наслідок, гемоліз еритроцитів. При вираженій недостатності ферменту (активність нижча 10 %) анемія розвивається під впливом деяких лікарських засобів, які володіють властивостями оксидантів (протималярійних, сульфаніламідних тощо). Або після споживання в їжу бобів Vicia Faba (кінські боби). У людей із менш вираженою недостатністю ферменту клінічні прояви, як правило, відсутні. 4.6.2. Метаболізм фруктози. Важливими субстратами енергетичного обміну є моносахариди – фруктоза та галактоза, які надходять в організм людини переважно з харчовими дисахаридами рослинного і тваринного походження: фруктоза – у складі сахарози, що гідролізується в кишечнику ферментом сахаразою до глюкози і фруктози, галактоза – в складі “молочного цукру” лактози, що розщеплюється кишковою лактазою до галактози та глюкози. Після проникнення через плазматичні мембрани всередину клітин фруктоза та галактоза включаються в обмінні процеси шляхом їх перетворення на фосфорильовані ефіри глюкози або її метаболітів – інтермедіатів гліколізу. Основним джерелом фруктози в організмі людини є її надходження з продуктами харчування, певна кількість синтезується в спеціалізованих тканинах (у сім'яних везикулах). Її концентрація в сім'яній рідині досягає 10 ммоль. За рахунок здатності мітохондрій сперматозоїдів окиснювати фруктозу в процесі фруктолізу, вона є енергетичним джерелом для руху сперматозоїдів. У певній концентрації фруктоза міститься в кришталику ока, де вона також утворюється з глюкози через сорбітол. Активність цього метаболічного шляху збільшується при цукровому діабеті; оскільки проникнення сорбітолу через клітинні мембрани є утрудненим, він разом із фруктозою нагромаджується в кришталику, що становить біохімічну основу розвитку діабетичної катаракти. Включення фруктози в обмін глюкози здійснюється двома шляхами: 1. Під впливом неспецифічної гексокінази, що каталізує фосфорилування різних гексоз:
Утворений D-фруктозо-6-фосфат є метаболітом гліколітичного окиснення глюкози. Цей шлях метаболізму фруктози реалізується в клітинах багатьох органів, особливо в м'язах і нирках. 2. Під впливом специфічної фруктокінази, яка каталізує фосфорилування фруктози не за 6-м, а за 1-м вуглецевим атомом (рис. 4.20):
Цей шлях перетворення фруктози функціонує в печінці. Утворений D-фруктозо-1-фосфат розщеплюється під дією альдолази (фруктозо-1-фосфатальдолази) на дві тріози:
Діоксіацетонфосфат, що утворився, є інтермедіатом гліколізу і перетворюється на гліцеральдегід-3-фосфат при дії тріозофосфатізомерази Інший продукт альдолазної реакції, гліцеральдегід, фосфорилується також з утворенням гліцеральдегід-3-фосфату (фермент — тріозокіназа):
Таким чином, фруктокіназний шлях обміну фруктози перетинається з гліколізом на етапі утворення двох молекул фосфотріози — гліцеральдегід-3-фосфату.
Оскільки перетворення фруктози на тріози здійснюється без участі двох регуляторних реакцій гліколізу (гексокіназної та фосфофруктокіназної), які обмежують швидкість процесу, катаболізм фруктози відбувається значно швидше порівняно з глюкозою. Синтез ендогенної фруктози відбувається через утворення шестиатомного спирту сорбітолу з глюкози за схемою:
4.6.2.1. спадкові ензимопатії метаболізму фруктози. Ці патології пов'язані з генетичними дефектами синтезу ферментів метаболізму фруктози. До них належать: а) непереносимість фруктози — захворювання, молекулярною основою якого є уроджена недостатність фруктозо-1 -фосфатальдолази, що спричиняє накопичення в тканинах фруктозо-1-фосфату, який є інгібітором деяких ферментів вуглеводного обміну, зокрема фосфорилази глікогену. Патологія зазвичай виявляється під час переходу від грудного годування дітей до їжі, що містить цукор і проявляється фруктоземією, фруктозурією та тяжкою гіпоглікемією, яка розвиваються після споживання продуктів, що містить фруктозу; б) фруктоземія — патологія обміну фруктози, спричинена недостатністю фруктокінази. Ензимопатія характеризується порушенням клітинної утилізації фруктози без суттєвих клінічних проявів. 4.6.3. Метаболізм галактози. Галактоза включається в процес гліколізу складнішим порівняно з фруктозою шляхом (рис. 4.21).
Специфічна галактокіназа каталізує фосфорилування галактози на галактозо-1-фосфат. У наступній реакції бере участь УДФ-глюкоза, яка використовується також для синтезу глікогену. Фермент печінки галактозо-1-фосфат-уридилтрансфераза каталізує обмінну реакцію між галактозо-1-фосфатом і УДФ-глюкозою. Далі залишок галактози в УДФ-галактозі під дією УДФгалактозо-4-епімерази переходить на залишок глюкози (реакція епімеризації біля 4-го атому вуглецю). УДФ-глюкоза може знову взаємодіяти з галактозо-1-фосфатом або перетворюватися на глюкозо-1-фосфат, чи використовуватися на синтез глікогену.
4.6.3.1. Спадкові ферментопатії метаболізму галактози. Спадковий дефект синтезу галактозо-1-фосфатуридилтрансферази проявляється природженою ензимопатією — галактоземією. Внаслідок неспроможності біохімічних систем організму перетворювати галактозу на глюкозу, у крові та внутрішніх органах хворих нагромаджується галактоза та галактозо-1-фосфат, спостерігається тенденція до гіпоглікемії, спостерігається компенсаторна мобілізація жирів, все це клінічно проявляється гепатомегалією, цирозом печінки, порушенням функцій нирок, помутнінням кришталика, затримкою розумового розвитку. Патологію виявляють у ранньому дитячому віці при споживанні молока, її розвиток може бути сповільнений дотриманням певної дієти (виключення з харчового раціону продуктів, що містять галактозу). Дуже рідко, але все ж зустрічаються дефекти галактокінази та уридилфосфат-4-епімерази. Вони проявляються галактоземією, галактозурією, проте тяжкі клінічні прояви при цьому відсутні. Дата добавления: 2015-11-25 | Просмотры: 2251 | Нарушение авторских прав |
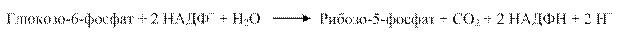
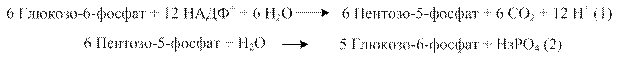
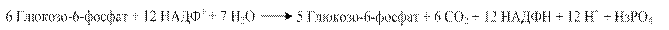
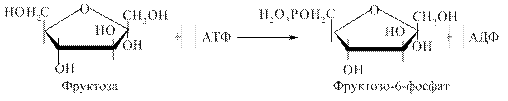
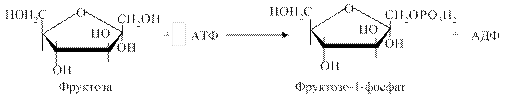
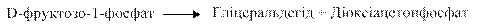
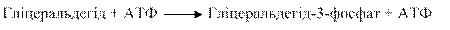
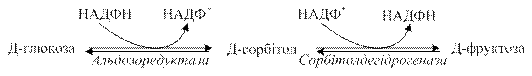

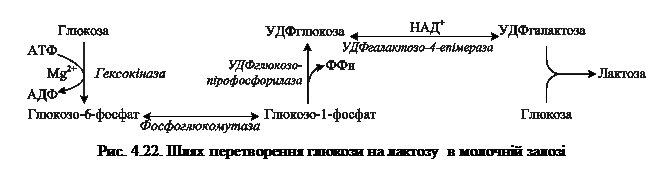 У молочній залозі УДФ-галактоза використовується як донор галактози в реакціях синтезу лактози, глікопротеїнів і гліколіпідів, протеогліканів (рис. 4.22).
У молочній залозі УДФ-галактоза використовується як донор галактози в реакціях синтезу лактози, глікопротеїнів і гліколіпідів, протеогліканів (рис. 4.22).