 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Метаболізм глікогенуГлікоген печінки є резервним вуглеводом організму. Його кількість у дорослої людини може досягати 150-200 г. Процес утворення глікогену - глікогенез відбувається швидко навіть при відносно повільному поступленні цукру в кров. Для активної м’язової роботи потрібна енергія, яка, в першу чергу, вивільняється у процесі розпаду глікогену до молочної кислоти (глікогеноліз). Остання поступає в кров, а потім у печінку, де з неї утворюється глюкоза в процесі глюконеогенезу. З печінки глюкоза з кров’ю надходить до м’язів і використовується для утворення енергії, а також запасається у вигляді глікогену. Надлишок глюкози крові використовується для біосинтезу глікогену, який здійснюється у всіх клітинах організму (крім еритроцитів), але найактивніше він протікає в скелетних м'язах і печінці. 4.4.1. Синтез глікогену. Біосинтез глікогену здійснюється за аеробних умов. На першому етапі відбувається утворення глюкозо-6-фосфату за рахунок фосфорилування глюкози під впливом глюкокінази (упечінці) або гексокінази (в усіх інших органах і тканинах) з використанням однієї молекули АТФ (рис.4.9).
Дифосфат (Н4Р2О7) відразу ж гідролізується дифосфатазою до двох молекул неорганічного фосфату, тому реакція перебігає у напрямку незворотного утворення УДФ-глюкози. Далі залишок глюкози з УДФ-глюкози переноситься на кінець уже існуючої молекули глікогену («затравки»). Реакцію каталізує глікогенсинтаза, яка належить до трансфераз, а не до синтетаз. У цій реакції утворюється новий α-1,4-глікозидний зв'язок між першим атомом вуглецю залишку глюкози, який приєднується, і гідроксилом біля С-4 кінцевого залишку глюкози ланцюга глікогену: УДФ, який вивільняється, перетворюється знову на УТФ за рахунок витрати 1 молекули АТФ:
Реакції багаторазово повторюються. При відсутності у клітинах молекул глікогену, наприклад, коли внаслідок голодування запаси його повністю вичерпані, залишок глюкози із УДФ-глюкози переноситься на гідроксильну групу специфічного білка з подальшим нарощуванням вуглеводного ланцюга. Тому молекули глікогену містять сліди білка.
Розгалужена структура глікогену має важливе значення. По-перше, вона забезпечує наявність великої кількості кінців у молекулі, що обумовлює швидке приєднання або звільнення молекул глюкози. І, по-друге, цим досягається компактність, щільність упаковки молекул, які депонуються у клітинах у вигляді гранул діаметром 20 мкм. Із гранулами пов'язані ферменти синтезу й розпаду глікогену. Молекулярна маса молекул значно коливається (105-108). Основні запаси глікогену в організмі містяться в скелетних м'язах і печінці. Вміст у печінці становить 2 – 8 % від маси органа і залежить від регулярності харчування і фізичного навантаження. Концентрація глікогену в скелетних м'язах, що знаходяться у стані спокою, — тільки 0,5 - 1 %, але через велику масу м'язів більша частина глікогену знаходиться в них. У середньому у дорослої людини після споживання їжі в печінці міститься приблизно 100 г глікогену, а в м'язах (стан спокою) — 400 г. Глікоген м'язів служить джерелом енергії під час скорочення м'язів, а функція глікогену печінки — підтримувати постійність концентрації глюкози в крові. 4.4.1.1. Регуляція активності глікогенсинтетази. Глікогнсинтаза належить до регуляторних ензимів і може знаходитися як в активній (нефосфорильованій), так і в неактивній (фосфорильованій) формах. На глікогенсинтазу можуть діяти шість різних ензимів: дві Са2+-кальмодулінзалежні (одна з них – кіназа фосфорилази): інші – цАМФ-залежні протеїнкінази. Реакцію фосфорилування глікогенсинтази каталізує цАМФ-залежна протеїнкіназа. Під час реакції фосфатна група переноситься з АТФ на гідроксильну групу двох залишків серину молекули ензиму і переводить його в неактивну форму. Протеїнфосфатази каналізують протилежну реакцію – відщеплють фосфатні групи шляхом гідролізу і переводять глікогенсинтазу в дефосфорильовану, активну, форму. Детально механізм регуляції глікогенсинтази подано на рис.4.11.
4.4.2. Розпад глікогену. Шлях розпаду глікогену (глікогенез) не є оберненим до синтезу процесом. Ключовими ферментами цього процесу є глікогенфосфорилази (фосфорилази), завдяки їм відбувається перехід вуглеводів із запасної форми в метаболічно активну форму. Під впливом глікогенфосфорилази а відбувається відщеплення глюкозних залишків від ланцюга глікогену з утворенням глюкозо-1-фосфату. Цей процес відбувається до тих пір, поки у ланцюгу глікогену не залишиться 4 глюкозні залишки до точки розгалуження.
Тоді фермент α-(1-6)-глікозидаза переносить триглюкозний фрагмент на кінець сусіднього ланцюга, а четвертий залишок глюкози, що зв’язаний α-(1-6)-глікозидним зв’язком, цей фермент відщеплює у вигляді вільної глюкози. Далі глікогенфосфорилаза знову відщеплює глюкозні залишки в лінійній послідовності аж до точки розгалуження. Молекули глюкозо-1-фосфату перетворюються на глюкозо-6-фосфат під впливом ферменту фосфоглюкомутази.
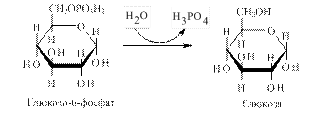
Глюкозо-6-фосфатаза забезпечу перетворення глюкозо-6-фосфату на глюкозу, яка надходить у кров.
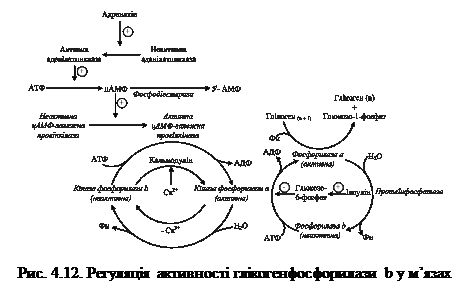
Особливістю цього моменту є той факт, що даний фермент знаходиться лише в печінці та нирках, тому розпад глікогену до глюкози можливий лише в цих органах, і мусить кількісно забезпечувати весь організм. У скелетних м’язах і мозку цей фермент відсутній, тому там процес розпаду глікогену закінчується утворенням глюкозо-6-фосфату, який там і використовується. 4.4.2.1. Регуляція активності глікогенфосфорилази. Як вже зазначалося, ключовим ферментом розпаду глікогену є глікогенфосфорилаза, яка існує в двох формах: активній (фосфорилаза a) та неактивній (фосфорилаза b). Обидві форми можуть дисоціювати на субодиниці. Фосфорилаза b складається з двох субодиниць, а фосфорилаза а – з чотирьох. Перетворення фосфорилази b на фосфорилазу а відбувається шляхом фосфорилування білка за участі кінази фосфорилази а: 2 Фосфорилаза b + 4 АТФ ® Фосфорилаза а + 4 АДФ Детально процес регуляції глікогенфосфорилази подано на рис. 4.12.
Зворотне перетворення фосфорилази а на фосфорилазу b каталізує фермент протеїнфосфатаза (ця реакція практично незворотна).
Неактивна протеїнкіназа складається із двох каталітичних і двох регуляторних субодиниць. При підвищенні концентрації у клітині цАМФ він зв'язується з регуляторними субодиницями, що викликає розпад тетрамерної форми протеїнкінази. Звільнені каталітичні субодиниці протеїнкінази каталізують реакцію фосфорилування кінази фосфорилази, що переводить її в активну форму і, таким чином, зумовлює утворення фосфорилази а. Одночасно каталітичні субодиниці протеїнкінази каталізують фосфорилування глікогенсинтази, цим самим перетворюючи її в неактивну форму. Багатостадійність передачі сигналу від гормона до фосфорилази, яка безпосередньо каталізує розпад глікогену, має важливе значення, оскільки в такому каскадному процесі досягається швидке підсилення сигналу. Так, зв'язування декількох молекул адреналіну зумовлює синтез більшої кількості молекул цАМФ, а далі кожна молекула ферменту активує велику кількість молекул наступного ферменту (протеїнкіназа — кіназа фосфорилази — глікогенфосфорилаза). Активність глікогенфосфорилази досягає максимуму вже через декілька хвилин після зв'язування адреналіну клітинами печінки, а підсилення сигналу становить приблизно 25 млн. разів (декілька молекул гормону викликають надходження із печінки в кров декількох грамів глюкози). Послідовність реакцій, що призводять до інактивації глікогенсинтази, коротша від послідовності активування глікогенфосфорилази на одну стадію, тому підсилення гормонального сигналу більше у системі розпаду глікогену. Максимальна швидкість синтезу глікогену м'язів не перевищує 0,3 % максимальної швидкості глікогенолізу. При припиненні секреції адреналіну або глюкагону аденілатциклаза переходить в неактивний стан. Наявний цАМФ розпадається під дією фосфодіестерази до АМФ, і в результаті утворюється тетрамерна неактивна форма протеїнкінази. Фосфатази каталізують дефосфорилування кінази фосфорилази, фосфорилази а і глікогенсинтази. Таким чином, виключається розпад глікогену і стає можливим його синтез. 4.4.4. Гормональна регуляція обміну глікогену. Гормон надниркових залоз адреналін стимулює розпад і гальмує синтез глікогену в печінці, скелетних м'язах, міокарді (табл. 4.4). Секреція його у стресових ситуаціях зумовлює вивільнення глюкози з печінки у кров для постачання інших органів, а в м'язах — розпад глікогену до молочної кислоти з виділенням енергії, що забезпечує швидке зростання м'язової активності. Глюкагон стимулює розпад глікогену печінки, але не впливає на глікоген м'язів. Секретується підшлунковою залозою при зниженні концентрації глюкози в крові.
Таблиця 4.4. Механізми гормональної регуляції метаболізму глікогену
Гормон підшлункової залози інсулін стимулює надходження глюкози в клітини і синтез глікогену. Механізми його дії ще до кінця не з'ясовані. Одним із них є активація інсуліном фосфодіестерази цАМФ, що призводить до зниження внутрішньоклітинного рівня цАМФ, у результаті стимулюється утворення неактивної глікогенфосфорилази й активної глікогенсинтази. У гепатоцитах інсулін підвищує активність глюкокінази. 4.4.5. Спадкові порушення метаболізму глікогену. Дефектиферментів метаболізму глікогену спричинюють розвиток спадкових хвороб, які називають глікогенозами, або хворобами нагромадження глікогену. При цьому в тканинах відбувається нагромадження глікогену нормальної або зміненої структури. Вперше ця патологія була описана Гірке в 1929 році, а природу ферментативного порушення, пов’язаного з глюкозо-6-фосфатазою, встановили Карл і Герті Корі в 1952 році. З тих пір охарактеризовано цілу низку хвороб нагромадження глікогену (табл..4.5). Таблиця 4.5. Спадкові порушення обміну глікогену
Дата добавления: 2015-11-25 | Просмотры: 2078 | Нарушение авторских прав |
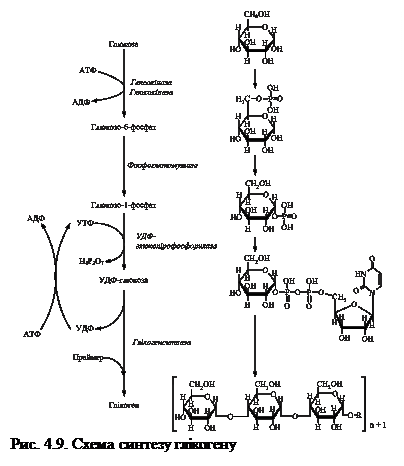 Для подальшого синтезу полісахаридних ланцюгів глікогену глюкозо-6-фосфат повинен спочатку перетворитись на більш реакційноздатну форму — уридиндифосфатглюкозу (УДФ-глюкозу), яка є безпосереднім донором залишків глюкози в процесі синтезу. Для цього спочатку відбувається перетворення глюкозо-6-фосфату на глюкозо-1-фосфат під дією фосфоглюкомутази, який у наступній реакції взаємодіє з уридинтрифосфатом (УТФ). Реакцію каталізує глюкозо-1-фосфатуридилтрансфераза (УДФ-глюкозодифосфорилаза).
Для подальшого синтезу полісахаридних ланцюгів глікогену глюкозо-6-фосфат повинен спочатку перетворитись на більш реакційноздатну форму — уридиндифосфатглюкозу (УДФ-глюкозу), яка є безпосереднім донором залишків глюкози в процесі синтезу. Для цього спочатку відбувається перетворення глюкозо-6-фосфату на глюкозо-1-фосфат під дією фосфоглюкомутази, який у наступній реакції взаємодіє з уридинтрифосфатом (УТФ). Реакцію каталізує глюкозо-1-фосфатуридилтрансфераза (УДФ-глюкозодифосфорилаза).
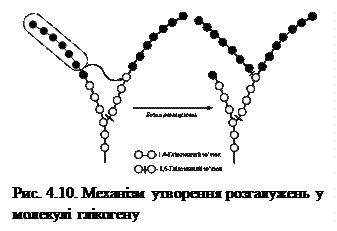 Утворення α-1,6-глікозидних зв'язків, які знаходяться у місцях розгалуження глікогену, каталізує фермент глікозил-(4-6)-трансфераза (фермент розгалужень). Це відбувається шляхом відриву фрагмента із 5-7 залишків глюкози із кінця лінійного ланцюга і перенесення його на гідроксил 6-го вуглецю залишку глюкози, розміщеного ближче до внутрішньої частини молекули (рис. 4.10). Після цього глікогенсинтаза приєднує до ланцюгів нові залишки глюкози. Точки розгалужень утворюються приблизно через кожні 8-12 залишків вздовж α -1,4-ланцюга.
Утворення α-1,6-глікозидних зв'язків, які знаходяться у місцях розгалуження глікогену, каталізує фермент глікозил-(4-6)-трансфераза (фермент розгалужень). Це відбувається шляхом відриву фрагмента із 5-7 залишків глюкози із кінця лінійного ланцюга і перенесення його на гідроксил 6-го вуглецю залишку глюкози, розміщеного ближче до внутрішньої частини молекули (рис. 4.10). Після цього глікогенсинтаза приєднує до ланцюгів нові залишки глюкози. Точки розгалужень утворюються приблизно через кожні 8-12 залишків вздовж α -1,4-ланцюга.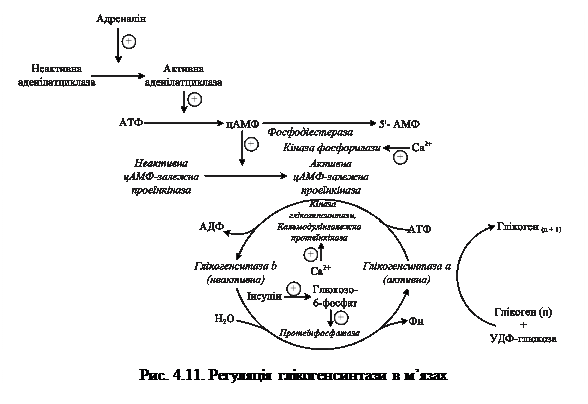
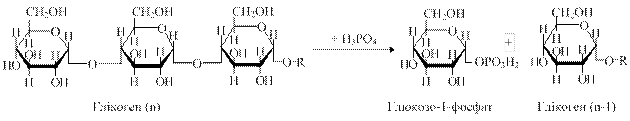
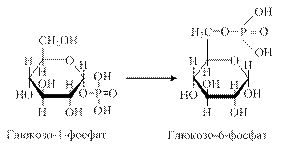
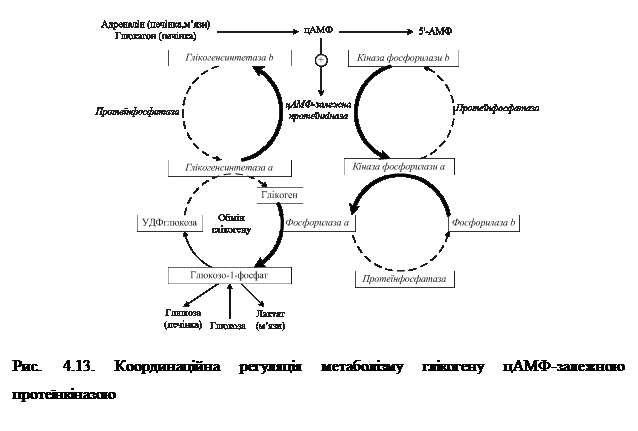 4.4.3. Координаційна регуляція глікогенолізу та глікогенезу. Синтез і розпад глікогену знаходяться під гормональним контролем. Синтез глікогену стимулює інсулін, а розпад — адреналін і глюкагон, дія яких опосередковується через вторинний посередник — цАМФ. Зв'язування їх зі своїми рецепторами, локалізованими у клітинній мембрані, зумовлює активацію аденілатциклази, яка каталізує синтез цАМФ із АТФ (рис. 4/13). цАМФ активує протеїнкіназу.
4.4.3. Координаційна регуляція глікогенолізу та глікогенезу. Синтез і розпад глікогену знаходяться під гормональним контролем. Синтез глікогену стимулює інсулін, а розпад — адреналін і глюкагон, дія яких опосередковується через вторинний посередник — цАМФ. Зв'язування їх зі своїми рецепторами, локалізованими у клітинній мембрані, зумовлює активацію аденілатциклази, яка каталізує синтез цАМФ із АТФ (рис. 4/13). цАМФ активує протеїнкіназу.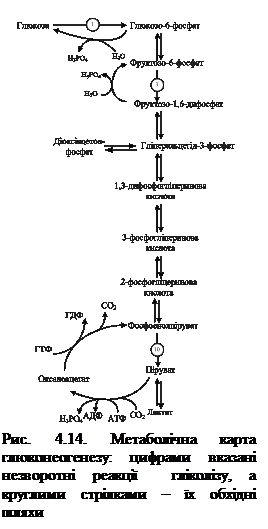 Аглікогенози – спадкові хвороби накопичення глікогену, в основі яких лежать генетичні дефекти, які спричинюють порушення утворення глікогенсинтетази. При цьому клітини печінки не спроможні накопичувати глікоген і тому в перервах між прийманням їжі хворі страждають від тяжкої гіпоглікемії, оскільки запаси глікогену в тканинах різко знижені або відсутні. Захворювання супроводжується втратою свідомості, блюванням, судомами, відставанням у розумовому розвитку. Часто хворі помирають у ранньому віці.
Аглікогенози – спадкові хвороби накопичення глікогену, в основі яких лежать генетичні дефекти, які спричинюють порушення утворення глікогенсинтетази. При цьому клітини печінки не спроможні накопичувати глікоген і тому в перервах між прийманням їжі хворі страждають від тяжкої гіпоглікемії, оскільки запаси глікогену в тканинах різко знижені або відсутні. Захворювання супроводжується втратою свідомості, блюванням, судомами, відставанням у розумовому розвитку. Часто хворі помирають у ранньому віці.