 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Глюконеогенез
Глюконеогенез – це процес синтезу глюкози з невуглеводних сполук, якими є, глікогенні амінокислоти, гліцерин, а також лактат, піруват або будь-яка речовина, яка перетворюється в процесі катаболізму на піруват або в один із проміжних продуктів циклу трикарбонових кислот. Відбувається глюконеогенез у печінці й, невеликою мірою, в кірковій речовині нирок. Завдяки цьому процесу підтримується концентрація глюкози в крові після того, як вичерпаються запаси глікогену при вуглеводному або повному голодуванні. Надзвичайно важливе значення глюконеогенезу для організму тварин і людини зумовлюється тим, що мозок має дуже малі запаси глікогену, а глюкоза крові служить основним джерелом енергії для нього. при зменшенні концентрації глюкози в крові нижче певної критичної межі порушується функціонування мозку і може наступити смерть. Більшість стадій глюконеогенезу – це зворотні реакції гліколізу, за виключенням трьох незворотних реакцій - гексокіназної, фосфофруктокіназної та піруваткіназної). Тому в процесі глюконеогенезу на цих трьох етапах використовуються інші ферменти та, відповідно, відбуваються інші реакції, які називають «обхідними шляхами» (рис. 4…). Обхідні реакції також є незворотними, але вони спрямовані не на розпад, а на синтез глюкози. Перша незворотна стадія — перетворення пірувату на фосфоенолпіруват (сполуку з макроергічним зв'язком) здійснюється через проміжну речовину — оксалоацетат. Спочатку мітохондріальний фермент піруваткарбоксилаза каталізує АТФ-залежне карбоксилування пірувату:
Алостеричним активатором піруваткарбоксилази служить ацетил-КоА. Піруваткарбоксилазна реакція також постачає оксалоацетат для циклу лимонної кислоти. Далі оксалоацетат під дією фосфоенолпіруваткарбоксикінази перетворюється на фосфоенолпіруват:
Одночасно відбуваються декарбоксилування та фосфорилування. ГТФ, який використовується в цій реакції, регенерується шляхом взаємодії ГДФ з АТФ. Таким чином, при перетворенні пірувату на фосфоенолпіруват витрачаються 2 молекули АТФ, тоді як у процесі гліколізу при перетворенні фосфоенолпірувату в піруват синтезується лише 1 молекула АТФ.
Утворений фосфоенолпіруват перетворюється за допомогою зворотних реакцій гліколізу на фруктозо-1,6-дифосфат. фермент фруктозодифосфатаза каталізує гідроліз фруктозо-1,6-дифосфату до фруктозо-6-фосфату:
При цьому вивільняється неорганічний фосфат, а енергія макроергічного фосфодіефірного зв'язку виділяється у вигляді тепла. У наступній зворотній реакції фруктозо-6-фосфат перетворюється на глюкозо-6-фосфат, який в обхідній реакції під дією глюкозо-6-фосфатази гідролізується до вільної глюкози:
Глюкозо-6-фосфат може використовуватись також і для синтезу глікогену. Враховуючи необхідність двох молекул пірувату для утворення молекули глюкози, сумарне рівняння глюконеогенезу записується так:
Таким чином, на синтез глюкози з пірувату затрачається значно більше енергії, ніж її утворюється під час гліколізу (шість молекул АТФ проти двох).
Іншим важливим субстратом глюконеогенезу є молочна кислота, яка нагромаджується в організмі під час інтенсивної м'язової роботи внаслідок анаеробного розпаду глікогену. У період відновлення після напруженої роботи молочна кислота переноситься кров'ю з м'язів до печінки, де під дією лактатдегідрогенази окиснюється до пірувату. Частина останнього використовується для глюконеогенезу, а частина розпадається аеробним шляхом, забезпечуючи процес глюконеогенезу енергією АТФ. Глюкоза потрапляє назад у скелетні м'язи і використовується для відновлення запасу глікогену. Поєднання процесу анаеробного гліколізу в скелетних м'язах і глюконеогенезу в печінці називається циклом Корі (глюкозо-лактатним циклом) і зображено на рис. 4.16.
Регуляторними ферментами глюконеогенезу і гліколізу є ті, що каталізують незворотні реакції та не беруть участі в протилежному процесі. Наприклад, піруваткарбоксилаза (активатор — ацетил-КоА) і фруктозодифосфатаза (активатор—цитрат, інгібітори — АМФ і фруктозо-2,6-дифосфат). Деякі ефектори одночасно впливають на активність регуляторних ферментів в обох процесах. Так, ацетил-КоА служить активатором піруваткарбоксилази й інгібітором піруваткінази. Крім того, ацетил-КоА є інгібітором піруватдегідрогеназного комплексу і, сповільнюючи розпад пірувату до ацетил-КоА, сприяє перетворенню пірувату на глюкозу. АМФ інгібує фруктозодифосфатазу і разом з тим активує відповідний фермент гліколізу — фосфофруктокіназу. І навпаки, цитрат — активатор фосфатази й інгібітор кінази. Глюконеогенез стимулюється також інгібіторами регуляторних ферментів гліколізу (АТФ, аланін, жирні кислоти). Таким чином, коли в клітині є достатня концентрація палива для циклу лимонної кислоти (ацетил-КоА, оксалоацетату, цитрату, жирних кислот, аланіну) або висока концентрація АТФ і низька – АДФ та АМФ, посилюється біосинтез глюкози та гальмується гліколіз. У протилежній ситуації стимулюється гліколіз і гальмується глюконеогенез. На процес глюконеогенезу впливають гормони підшлункової залози (глюкагон, інсулін) і кори надниркових залоз (глюкокортикоїди). При голодуванні глюкагон посилює розпад жирів у жировій тканині. Жирні кислоти надходять у печінку, де розпадаються до ацетил-КоА. Швидкість окиснення ацетил-КоА в циклі лимонної кислоти відстає від швидкості його утворення, і підвищений рівень ацетил-КоА в клітині активує піруваткарбоксилазу. У результаті посилюється глюконеогенез.
Фруктозо-2,6-дифосфат активує фермент гліколізу фосфофруктокіназу і гальмує активність ферменту глюконеогенезу фруктозо-1,6-дифосфатази. Утворення фруктозо-2,6-дифосфату гальмується глюкагоном, який шляхом цАМФ-залежного фосфорилування інактивує фосфофруктокіназу й активує фруктозо-2,6-дифосфатазу. Таким чином, при голодуванні глюкагон знижує внутрішньоклітинну концентрацію фруктозо-2,6-дифосфату, що викликає стимуляцію глюконеогенезу і гальмування гліколізу.
Аланін, утворений у м'язах під час їх роботи, потрапляє в кров, а потім поглинається гепатоцитами (після перетворення на піруват) і використовується в глюконеогенезі (рис. 4.18). У результаті стимуляції глюконеогенезу глюкокортикоїди збільшують концентрацію глюкози в крові та синтез глікогену в печінці. Інсулін протидіє стимулюючій дії глюкагону і глюкокортикоїдів на глюконеогенез. Дата добавления: 2015-11-25 | Просмотры: 1801 | Нарушение авторских прав |

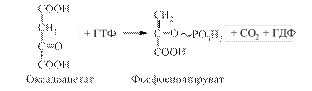
 Труднощі викликає різна локалізація ферментів у клітині (рис. 4.15). Фосфоенолпіруваткарбоксикіназа знаходиться в цитоплазмі, а оксалоацетат, який утворюється в мітохондріях, не проникає через мітохондріальну мембрану. Тому оксалоацетат відновлюється в матриксі мітохондрій під дією ферменту циклу Кребса малатдегідрогенази до малату, який може виходити з мітохондрій. Цитоплазматична малатдегідрогеназа окиснює малат назад в оксалоацетат.
Труднощі викликає різна локалізація ферментів у клітині (рис. 4.15). Фосфоенолпіруваткарбоксикіназа знаходиться в цитоплазмі, а оксалоацетат, який утворюється в мітохондріях, не проникає через мітохондріальну мембрану. Тому оксалоацетат відновлюється в матриксі мітохондрій під дією ферменту циклу Кребса малатдегідрогенази до малату, який може виходити з мітохондрій. Цитоплазматична малатдегідрогеназа окиснює малат назад в оксалоацетат.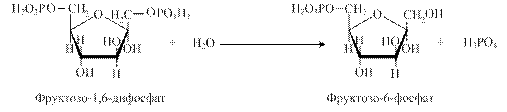

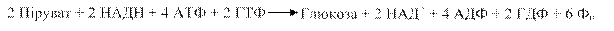
 4.5.1. Взаємозв’язок глюконеогенезу та гліколізу. Глікогенні амінокислоти залучаються в процес гліконеогенезу здебільшого при голодуванні та цукровому діабеті. За цих умов розпадаються жири жирової тканини, при цьому жирні кислоти використовуються як джерело енергії в м'язах, печінці тощо, а гліцерин у печінці шляхом глюконеогенезу перетворюється на глюкозу.
4.5.1. Взаємозв’язок глюконеогенезу та гліколізу. Глікогенні амінокислоти залучаються в процес гліконеогенезу здебільшого при голодуванні та цукровому діабеті. За цих умов розпадаються жири жирової тканини, при цьому жирні кислоти використовуються як джерело енергії в м'язах, печінці тощо, а гліцерин у печінці шляхом глюконеогенезу перетворюється на глюкозу. У клітинах печінки здійснюється координована регуляція гліколізу та глюконеогенезу відповідно до фізіологічних потреб усього організму. Зміна в печінці гліколітичного напрямку на глюконеогенез і навпаки відбувається при зміні абсорбтивного стану на постабсорбтивний (чи голодування). Система контролю включає алостеричну регуляцію активності ензимів, їх ковалентну модифікацію шляхом фосфорилування-дефосфорилування, індукцію/репресію синтезу ключових ферментів і, звичайно, гормональний контроль. На рис 4.17 вказані регуляторні пункти гліколізу та глюконеогенезу.
У клітинах печінки здійснюється координована регуляція гліколізу та глюконеогенезу відповідно до фізіологічних потреб усього організму. Зміна в печінці гліколітичного напрямку на глюконеогенез і навпаки відбувається при зміні абсорбтивного стану на постабсорбтивний (чи голодування). Система контролю включає алостеричну регуляцію активності ензимів, їх ковалентну модифікацію шляхом фосфорилування-дефосфорилування, індукцію/репресію синтезу ключових ферментів і, звичайно, гормональний контроль. На рис 4.17 вказані регуляторні пункти гліколізу та глюконеогенезу. Глюкагон активує глюконеогенез ще одним способом — через фруктозо-2,6-дифосфат, який утворюється з фруктозо-6-фосфату при дії фосфофруктокінази, а розщеплюється фруктозо-2,6-дифосфатазою.
Глюкагон активує глюконеогенез ще одним способом — через фруктозо-2,6-дифосфат, який утворюється з фруктозо-6-фосфату при дії фосфофруктокінази, а розщеплюється фруктозо-2,6-дифосфатазою. При тривалому голодуванні зростає секреція корою надниркових залоз глюкокортикоїдів, які посилюють у печінці синтез ферментів глюконеогенезу (фосфоенолпіруваткарбоксикінази, глюкозо-6-фосфатази) й амінотрансфераз – ферментів, які каталізують перетворення глікогенних амінокислот на піруват і оксалоацетат. Важливим субстратом у печінці є аланін, який може утворюватися у скелетних м'язах у зворотній реакції трансамінування пірувату з глутаматом ((Піруват + Глутамат ® Аланін + a-Кетоглутарат)
При тривалому голодуванні зростає секреція корою надниркових залоз глюкокортикоїдів, які посилюють у печінці синтез ферментів глюконеогенезу (фосфоенолпіруваткарбоксикінази, глюкозо-6-фосфатази) й амінотрансфераз – ферментів, які каталізують перетворення глікогенних амінокислот на піруват і оксалоацетат. Важливим субстратом у печінці є аланін, який може утворюватися у скелетних м'язах у зворотній реакції трансамінування пірувату з глутаматом ((Піруват + Глутамат ® Аланін + a-Кетоглутарат)