 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ СЕКРЕТОРНОГО ПРОЦЕССАСекретообразование тесно связано с функционированием секреторных клеток альвеолярного эпителия и их структурных компонентов. Наиболее важные звенья в цепи клеточных процессов, обеспечивающих образование и выделение из клетки секреторно- го продукта, следующие: а) синтез различных типов РНК (рРНК, мРНК, тРНК), обусловленный генетической информацией, содержащейся в ядре; б) участие мРНК и тРНК в синтезе белка на рибосомах (полисомах); в) деятельность структур эндоплазма™ -ческого ретикулума в сегрегации и перемещении секреторного продукта; г) концентрация и «упаковка» секреторного продукта структурами комплекса Гольджи. Понятие «организация секреторного процесса» включает и строгую регламентацию секретообразования. Многообразные процессы синтеза и преформирования первичных и промежуточных форм секреторного продукта строго локализованы и проходят в определенные промежутки времени. Эта пространственно-временная последовательность обязательно укладывается в рамки секреторного цикла. Весьма важной особенностью многих клеток является изменение их морфологических параметров на всех его этапах. Методы электронной микроскопии и авторадиография, а также цитофизиологические наблюдения в ходе прижизненного исследования позволили выявить конкретные этапы секреторного цикла: 1) поступление веществ — предшественников секрета в тело клетки; 2) синтез первичного секрета; 3) внутриклеточный транспорт, дальнейшая обработка и накопление секреторного продукта; 4) удаление из клетки, выведение секрета (экструзия). Таким образом, секреторный цикл — это последовательное прохождение клеткой стадий метаболических и структурных перестроек, обеспечивающих полное превращение секреторного продукта от поступления веществ-предшественников до вывода из тела клетки готового сформированного продукта секреции. Изменения, происходящие в секреторном эпителии при интенсификации секреции, указывают на то, что некоторые процессы приходятся на начало секреторного цикла — активация ядерного аппарата совпадает с интенсификацией транспортных процессов. На первых этапах секреторного цикла, сразу после удаления ранее синтезированного секрета, происходит значительное увеличение объема секреторных клеток и изменение их формы от уплощенной к цилиндрической; при одновременной интенсификации транспортных и синтетических процессов меняется биоэлектрическая активность клетки: Функциональное набухание обусловлено быстрым поступлением в клетку осмотически активных веществ — глюкозы, аминокислот и электролитов. Удлинение эпителиальных клеток связано с сократительной активностью внутриклеточных цитоскелетных структур: разрушение их с помощью колхицина предупреждает изменение формы клеток. На начальных стадиях секреторного цикла в несколько раз усиливается активность таких транспортных ферментов, как, например, щелочная фосфатаза. С увеличением объема цитоплазмы секреторной клетки совпадает повышение уровня содержания РНК. Новообразование РНК и транспорт ее в цитоплазму вызва-
В ходе секреторного цикла на полисомах, расположенных на поверхности каналов эндоплазматического ретикулума, происходит синтез пептидных цепей. В полисоме на одну молекулу мРНК приходится несколько рибосом; образование полисомных комплексов обеспечивает наиболее эффективное использование мРНК. Пройдя через одну и ту же серию кодонов мРНК, рибосомы синтезируют однотипный белок. На рибосомах синтез белка осуществляется за 2...3 мин, в течение следующих 10 мин меченые аминокислоты обнаруживаются в составе пептидной или белковой молекулы в просвете каналов эндоплазматического ретикулума. В клетках молочной железы эндоплазматический ретикулум участвует и в синтезе молочного жира. Затем секреторный продукт поступает в комплекс Гольджи, где полипептидные цепи формируют мицеллы казеина за счет образования фосфатных и кальциевых связей. Структуры комплекса Гольджи осуществляют еще одну функцию секреторной клетки — синтез молочного сахара (лактозы). Лактоза, сформированная за время прохождения компонентов комплекса Гольджи, по цитоплазме вместе с гранулами казеина переходит в полость альвеолы при опорожнении везикул. Очевидно, это наиболее удачный путь выхода молочного сахара из клетки, поскольку лактоза неспособна проникать через клеточную мембрану. Располагающийся в конденсирующих везикулах комплекса Гольджи секреторный продукт, состоящий из казеина и лактозы, а также липидные глобулы для выведения из клетки перемещаются в ее апикальную зону. Это направленное перемещение связано с электрической поляризацией клеток альвеолярного эпителия: внутриклеточные везикулы перемещаются к положительному полюсу клетки. При действии физиологически активных веществ, усиливающих выделение секрета из клеток, развивается гиперполяризация клеточной мембраны, усиливающая степень поляризации клетки. Вместе с этим в процессах выведения секрета за пределы секреторной клетки, несомненно, участвуют сократительные элементы: ци-тоскелета при обработке молочной железы колхицином, веществом, разрушающим микротрубочки, экструзия прекращается. Электронномикроскопическое исследование секреторных клеток позволяет детализировать процесс удаления секрета. Крупная жировая капля (глобула) приближается к апикальной мембране и облекается ею. По мере увеличения контакта с плазматической мембраной капля все больше выступает в просвет альвеолы. Огибая жировую каплю, плазматическая мембрана сужается у основания и перешнуровывается, а затем отрывается и попадает в по- лость альвеолы. Выведение из клетки белка и лактозы происходит иначе: заключенные в мембраны конденсирующие вакуоли подходят к апикальной мембране. Мембрана вакуоли соединяется с плазматической мембраной, затем полость вакуоли полностью раскрывается и ее содержимое опорожняется в просвет альвеолы. Заметим, что плазматическая мембрана после того, как ее часть пошла на покрытие молочного жирового шарика, восстанавливается за счет расправления на апикальной ее поверхности стенки везикулы, приносящей белковые секреторные гранулы. Следует подчеркнуть, что декапитация и, следовательно, апокриновый тип секреции в молочной железе не происходит. Белок выходит из клетки по мер-окриновому типу, а для удаления жира используется леммокрино-вый (лат. lemma — оболочка) принцип экструзии. Альвеола — структурно-функциональная единица молочной железы. Как показали исследования на культивированных изолированных клетках молочной железы, уровень их секреции оказывается значительно ниже, чем в клеточном сообществе. То есть для сохранения секреторной функции железистых органов и, в частности, молочной железы, необходима целостность клеточного комплекса как функциональной единицы. Для большинства экзокринных желез, включая молочную, такой «неделимой» единицей является альвеола или ацинус. При анализе принципов объединения клеток в альвеолярном комплексе наиболее важными являются межклеточное взаимодействие и последовательность развития реакций в отдельных компонентах клеточного ансамбля. Взаимодействие между секреторными клетками обусловлено функционированием межклеточных контактов, расположенных на сопредельных поверхностях клеток. При внутриклеточной инъекции флюоресцентной метки в одну из клеток альвеолы уже через 10...15 мин флуорохром обнаруживается в 2...3 расположенных рядом клетках, что свидетельствует о существовании межклеточного обмена крупными молекулами. При развитии физиологических реакций альвеолы первыми реагируют (около 25 % клеток), и только затем через 10... 15 мин в реакцию вовлекаются остальные клетки. Система высокопроницаемых контактов объединяет клетки в функциональный синцитий при сохранении клеточной обособленности. При повреждении соседних клеток оставшиеся целыми клетки «отключают» высоко-проницаемые контакты и распространение информации по альвеоле прекращается. Барьерные свойства секреторного эпителия формируются за счет наличия специального замыкательного комплекса плотного контакта, расположенного на границе между апикальной и латеральной зонами клеточной мембраны. Через альвеолярный барьер i ie проникают специальные вещества (пероксидаза и флуоресцеин натрия). Все вещества, попадающие в просвет альвеолы, обязательно должны пройти через секреторную клетку.
Взаимодействие между миоэпителиальными и секреторными Сокращение миоэпителиальных клеток развива- > ется при действии окситоцина и ацетилхолина, причем клетки об- \ ладают самостоятельными окситоциновыми и холинорецептора- i ми. Атропин не прекращает сократительной реакции альвеолы, а совместный эффект действия ацетилхолина и окситоцина оказывается сильнее, чем каждого из них в отдельности. Существенное изменение сократительной активности миоэпителия наступает под влиянием катехоламинов, блокирующих сокращения альвеол в ответ на действие окситоцина. Подавление сокращений миоэпи-телиальной клетки связано с реакцией Р-адренорецепторов, предотвращающих последующую сократительную активность. Сокращения миоэпителия развиваются при деполяризации мембраны, в том числе и под действием электрического тока с длительностью импульса не менее 350 мс. Сократительный аппарат миоэпителиальных клеток аналоги- < чен таковому у клеток гладкой мускулатуры и представлен мио-фибриллами, заполняющими тело и отростки клеток. Каждая мио-фибрилла построена из ориентированных в продольном направлении миофиламент толщиной от 50 до 80 нм. Обнаруживается
Рис. 10.2. Схема межклеточных взаимоотношений в альвеолах молочной железы: МЭП— миоэпителиальная клетка; ЯГ—секреторная клетка; ПА — полость альвеолы; К— капилляр; В —везикулы; ЖК— жировая клетка; ФБ — фибробласт; НВ — нервы центральная линия прикрепления — аналог Z-мембраны. Наряду с аналогом Z-мембраны выявлены электронноплотные и элект-роннопрозрачные участки, подобные дискам А и I. Соединенные друг с другом и с Z-мембраной миофиламенты заполняют пространство отростков миоэпителиальных клеток, причем в месте прикрепления к плазматической мембране увеличена электронная плотность хемидесмосома. Сокращения миоэпителия связаны с повышением концентрации кальция внутри клетки. Обнаружено два места депонирования ионизированного кальция — это каналы эндоплазматического ретикулума и примембранные везикулярные структуры. При действии окситоцина и развитии сокращения миоэпителиальной клетки ионизированный кальций обнаруживается в пространстве между миофиламентами. Кровоснабжение альвеол существенно меняется в ходе секреторного цикла, причем расширение микрососудов и раскрытие дополнительных капилляров обеспечивают рабочую гиперемию органа. Регистрация кровенаполнения сосудов, окружающих альвеолу, позволяет обнаружить наличие двухфазной реакции кратковременной вазоконстрикции (сужения сосудов), обусловленной действием окситоцина (структурного аналога вазопрессина) и длительной вазодилятацией (расширением сосудов). Интенсивность секретообразования тесно связана с полноценным кровоснабжением органа: объемный кровоток значительно возрастает при становлении лактации и увеличении молочной продуктивности в лактационный период. Нарушение образования
Дата добавления: 2015-12-15 | Просмотры: 800 | Нарушение авторских прав |
 ны, в свою очередь, активацией генома клетки. Интенсификация транскрипционной активности хроматина проявляется в повышении содержания деконденсированного хроматина и усилении связывания флюоресцентных индикаторов, указывающих на дерепрессию определенных участков генома.
ны, в свою очередь, активацией генома клетки. Интенсификация транскрипционной активности хроматина проявляется в повышении содержания деконденсированного хроматина и усилении связывания флюоресцентных индикаторов, указывающих на дерепрессию определенных участков генома.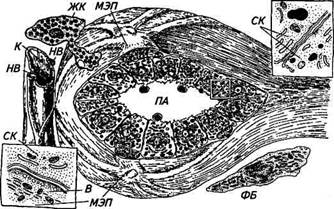

 молока при гипогалактии обычно связано и с отклонениями в гемодинамике. По данным реологического исследования, существенно снижается амплитуда пульсовой волны, сглаживаются ка-такрота и анакрота, что указывает на спазм микрососудов молочной железы. Вместе с этим падение молочной продуктивности сопровождается снижением кожной температуры молочной железы наО,5...1,5°С.
молока при гипогалактии обычно связано и с отклонениями в гемодинамике. По данным реологического исследования, существенно снижается амплитуда пульсовой волны, сглаживаются ка-такрота и анакрота, что указывает на спазм микрососудов молочной железы. Вместе с этим падение молочной продуктивности сопровождается снижением кожной температуры молочной железы наО,5...1,5°С.