|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Водородные связи
Третичная структура – форма белковой молекулы; трёхмерная структура белка. Укладка нерегулярных областей и a и b-структур в глобулу определяет третичную структуру белка. Взаимодействия остатков a-аминокислоты в третичной структуре:
· Ковалентных связей (дисульфидные –S–S– связи в цистине) · Ионных связей (Глу-COO- H3N+-Лиз) · Водородных связей (Глу-COO-…HO-Тир) · Гидрофобных взаимодействий(Вал, Лей, Иле, Фен) По третичной структуре белки делят на: · глобулярные - для них характерна a-спиральная структура (яичный белок, ферменты, глобин в составе гемоглобина); · Глобулярные белки выполняют функции, требующие подвижности и, следовательно, растворимости. Они участвуют в регуляции жизненных процессов: гемоглобин переносит кислород из лёгких в ткани, ферменты катализируют многочисленные химические реакции, протекающие в организме, антитела обеспечивают защиту от чужеродных организмов и т.д. Фибриллярные белки нерастворимы, склонны к образованию волокон и потому служат основным строительным материалом животных клеток. К числу фибриллярных белков относятся кератин (в коже, волосах, рогах, ногтях, перьях), коллаген (в сухожилиях), миозин (в мышцах). Фолдинг – сворачивание белковой цепи с образованием нативной структуры. Домены – глобулярные области в пределах одной белковой молекулы. Домены соединены шарнирным участком. Четвертичная структура - агрегат нескольких белковых молекул, образующих одну структуру.
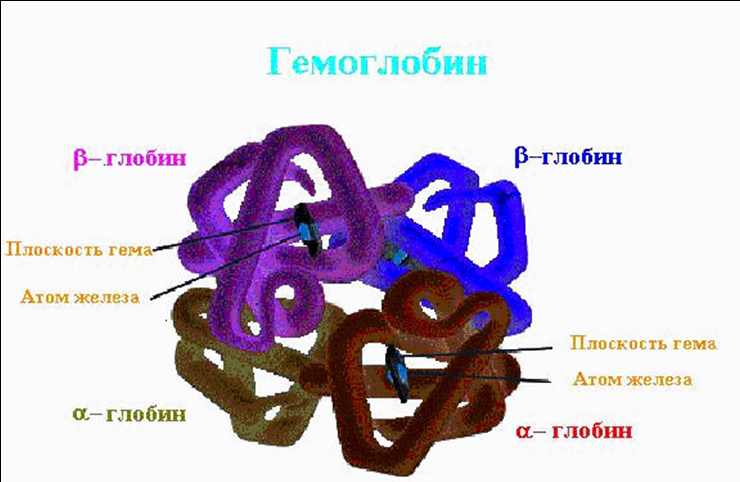
Молекула гемоглобина состоит из 4-х субъединиц, каждая из которых включает в себя активный центр – гем. Субъединицы удерживаются друг около друга гидрофобными связями. Молекула гемоглобина состоит из 4-х субъединиц, каждая из которых включает в себя активный центр – гем. Субъединицы удерживаются друг около друга гидрофобными связями. Дата добавления: 2015-12-15 | Просмотры: 882 | Нарушение авторских прав |

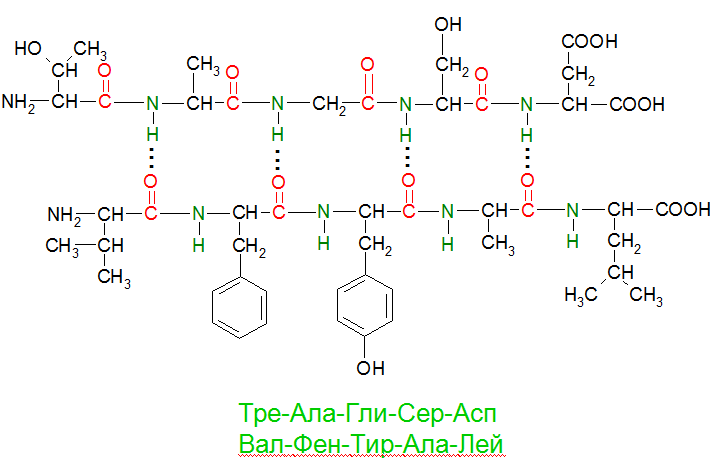
 a-Аминокислоты в белковой глобуле взаимодействуют за счёт:
a-Аминокислоты в белковой глобуле взаимодействуют за счёт: фибриллярные - для них характерна b-структура (белки мышечной ткани - миоинозин, бетта-кератин волос).
фибриллярные - для них характерна b-структура (белки мышечной ткани - миоинозин, бетта-кератин волос). Взаимодействия: ионные, водородные, гидрофобные, ковалентные (дисульфидные). Протомер - отдельная полипептидная цепь. Субъединица - функциональная единица.
Взаимодействия: ионные, водородные, гидрофобные, ковалентные (дисульфидные). Протомер - отдельная полипептидная цепь. Субъединица - функциональная единица.