 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ВОПРОС №64: МЕТОДЫ УЧЕТА МУТАЦИЙ И МИКРООРГАНИЗМОВ.Такой эксперимент достаточно просто провести на гаплоидных микроорганизмах, у которых каждая клетка на плотной среде может образовывать отдельную колонию, представляющую собой клон, и все эти клоны проверяют по интересующему признаку. Если исследуют мутации, дающие селективное преимущество, то мутантов легко выявить методом отпечатков, или реплик, предположенным Э. и Дж. Ледерберг. Например, при изучении мутаций устойчивости E.coli к бактериофагу Т1 клетки бактерии высевают на агаризованную среду в чашки Петри таким образом, чтобы на них образовались отдельные колонии. Затем при помощи бархатной печатки эти колонии перепечатывают на чашки с нанесенной суспензией частиц фага Т1. Большая часть клеток исходной (чувствительной) культуры не будет образовывать колонии, поскольку их лизирует бактериофаг. Вырастут лишь отдельные мутантные колонии, устойчивые к фагу. Сравнивая частоту мутантов в контрольном и опытном вариантах, легко определить частоту индуцированных мутаций. Эксперимент можно выполнить проще: достаточно приготовить суспензию клеток E.coli, разделить ее на две части, из которых одна контрольная, а другая обрабатывается мутагеном. Обе суспензии высевают на среду без бактериофага – для подсчета числа жизнеспособных клеток, образующих колонии, и на среду с бактериофагом – для учета числа устойчивых клеток. Сложнее определить частоту спонтанного мутирования. Число мутантов, встреченных в контрольном варианте, обычно прямо не отражает частоту мутирования, а лишь показывает концентрацию мутантов, которые могли некогда возникнуть и размножиться в культуре. Современные методы определения частоты спонтанного мутирования представляют собой модификации подхода, использованного С. Лурия и М. Дельбрюком. Эти авторы впервые исследовали распределение числа мутантных клеток в параллельных клонах – бактериальных культурах. Рассмотрим один из вариантов определения частоты спонтанного мутирования на конкретном примере исследования мутаций: Ade à Ade+ у мутанта по гену ade2 дрожжей-сахаромицетов. Этот пример удобен тем, что колонии, образуемые исходной культурой, красные и нуждаются в аденине. Мутанты же (в данном случае ревертанты) белые и в аденине не нуждаются. Это позволяет для выявления мутантов применять селективный метод. Прежде всего нужно узнать распределение спонтанных мутантов среди клонов, содержащих одинаковое число клеток. В данном случае удобнее всего использовать предложенный Н.Н. Хромовым-Борисовым метод упорядоченного посева на среде, полуобогащенной ограничивающим фактором роста. Капли суспензии исходной культуры равного объема наносят специальным репликатором на плотную среду, содержащую количество аденина, необходимое для нескольких делений клеток ade2. Благодаря тому, что штыри репликатора расположены в углах правильной тригональной решетки, все колонии оказываются на равном расстоянии друг от друга и имеют одинаковый размер, а следовательно, и число клеток. Вариабельность не превышает 1%. После прекращения роста колоний из-за истощения аденина в среде на них появляются колонии вторичного роста, или «бородавки» мутантов Ade+. Они образуются в результате продолжающихся делений мутантных клеток, не нуждающихся в аденине. Белые бородавки Ade+ хорошо заметны на фоне красных колоний Ade-. Тогда частоту мутаций (m) в пересчете на клетку за одно клеточное деление вычисляют по формуле m=(
Дата добавления: 2015-12-16 | Просмотры: 844 | Нарушение авторских прав |
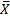 *
* 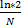 ) /
) / 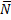 , где X- среднее число бородавок на одну колонию, N-среднее число клеток в колонии. Ту же задачу можно решать и другим способом. Поскольку спонтанные мутации-события редкие, распределение мутантов по колониям соответствует распределению Пуассона. Если известна доля колоний, вообще не содержащих мутантов, Р0, то lnP0= -
, где X- среднее число бородавок на одну колонию, N-среднее число клеток в колонии. Ту же задачу можно решать и другим способом. Поскольку спонтанные мутации-события редкие, распределение мутантов по колониям соответствует распределению Пуассона. Если известна доля колоний, вообще не содержащих мутантов, Р0, то lnP0= - 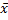 *ln2)/
*ln2)/