 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ГЛАВА 10. СОСУДИСТЫЕ ЗАБОЛЕВАНИЯ НЕРВНОЙ СИСТЕМЫСосудистые заболевания нервной системы являются одной из наиболее частых причин летальности и инвалидности. Особенности кровоснабжения головного мозга. Деятельность головного мозга в целом и все специфические для нервной ткани процессы (проведение нервного импульса, синаптогенез, хранение и переработка поступающей информации, поддержание пространственно-функциональной архитектоники мозга, образование функциональных ансамблей нейронов и др.) находятся в тесной зависимости от уровня энергетического обмена, определяемого прежде всего поступлением с кровотоком кислорода и глюкозы в нервную ткань. Составляя около 2% массы тела человека, головной мозг потребляет 20-25% поступающего в организм кислорода и до 70% свободной глюкозы, образующейся в печени. Однако нервная ткань имеет ограниченные энергетические ресурсы. Собственные запасы глюкозы в ткани мозга чрезвычайно малы по сравнению с интенсивностью ее потребления и только для процессов окисления могут быть израсходованы за 3-6 мин. Таким образом, функционирование головного мозга полностью зависит от постоянного притока глюкозы. При критическом снижении ее концентрации в крови для поддержания окислительных процессов ткань мозга начинает использовать свободную фракцию гликогена, но из-за небольших ее размеров полное окисление гликогена мозга заканчивается через 5-7 мин. Полное прекращение кровотока в мозге на 5-8 мин ведет к необратимым изменениям. В связи с этим стабильно высокая перфузия мозга - непременное условие его функциональной активности и жизнеспособности. Важной особенностью кровоснабжения мозга является эффективная система анастомозов (см. главу 2.6), способной обеспечить стабильность мозгового кровотока в условиях стеноза или даже полной онклюзии одной из четырех магистральных артерий, питающих головной мозг. Определенная автономность мозгового кровоснабжения обеспечивается механизмом ауторегуляции. Его физиологическая суть - констрикция или дилатация мозговых артерий в ответ на повышение или снижение системного АД соответственно. В норме при колебаниях систолического АД от 60 до 180 мм рт. ст. мозговой кровоток остается относительно стабильным. При различных патологических состояниях (артериальная гипертензия, острые расстройства мозгового кровообращения, черепно-мозговая травма, опухоли мозга) механизмы ауторегуляции оказываются неэффективными, и при колебаниях системного АД мозговой кровоток пассивно изменяется вслед за АД. Классификация. Выделяют хронические нарушения мозгового кровообращения (ХНМК) и острые нарушения мозгового кровообращения (ОНМК). Отдельно рассматриваются нарушения мозгового кровообращения, обусловленные врожденными аномалиями сосудов мозга. 10.1. Хроническая недостаточность мозгового кровообращения ХНМК (дисциркуляторная энцефалопатия) - наиболее частое проявление цереброваскулярной патологии. Обычно возникает на фоне атеросклероза, артериальной гипертензии и их сочетания. В патогенезе ХНМК имеют значение морфологические изменения экстра- и интракраниальных отделов магистральных сосудов головы, снижение компенсаторных возможностей коллатерального кровообращения, нарушения ауторегуляции мозгового кровообращения; расстройства центральной гемодинамики, изменения реологических и свертывающих свойств крови, нарушения метаболизма мозга. Ведущим патогенетическим механизмом является несоответствие между потребностью вещества головного мозга в кислороде и глюкозе и их доставкой кровотоком. Клинические проявления. В ранних стадиях заболевания преобладает субъективная симптоматика в виде снижения памяти и умственной работоспособности, головных болей, ощущения тяжести, шума в голове, фотопсий (ощущение мелькания предметов перед глазами), эпизодов головокружения. Отмечаются нарушения сна, повышенная утомляемость. Указанные расстройства возникают, как правило, после физического или эмоционального перенапряжения, под влиянием неблагоприятных метеорологических факторов. Неврологический осмотр позволяет выявить снижение темпа и качества умственной деятельности, ограничение способности к усвоению и обработке новой информации, признаки вегетососудистой дисфункции, иногда - нерезко выраженные симптомы орального автоматизма. По мере прогрессирования заболевания жалобы становятся более стойкими. Более значительными становятся интеллектуально-мнести- ческие расстройства (снижается внимание, затрудняется усвоение нового материала, постепенно сужается круг интересов, прогрессирует нарушение памяти). Затрудняется переключение с одного вида деятельности на другой, при выполнении умственной работы все чаще допускаются ошибки, мышление замедляется, снижаются активность и инициативность. Выражены изменения в эмоционально-волевой сфере с преобладанием депрессивных и астенических расстройств. Возможно развитие слабодушия, недостаточности критики к своему состоянию. У многих пациентов когнитивные нарушения затрудняют и нередко полностью исключают продолжение трудовой деятельности. Хроническое сосудистое поражение головного мозга часто сочетается с перенесенными эпизодами острой ишемии. Постепенно появляется очаговая неврологическая симптоматика в виде пирамидной недостаточности, псевдобульбарного синдрома, синдрома паркинсонизма, координаторных нарушений. Возникают корковые нарушения - элементы афазии, агнозии, апраксии, стойкий неврологический дефицит с нарушением моторных и сенсорных функций. Диагностика. Для диагностики ХНМК необходимо определить основной патологический процесс, поражающий сердечно-сосудистую систему (атеросклероз, артериальная гипертензия и др.). В связи с этим представляют ценность исследование липидного спектра, уровня глюкозы в крови, ее свертывающих и реологических свойств. Важную информацию о состоянии миокарда, аорты и крупных сосудов дают УЗДГ, эхокардиография. Используют электроэнцефалографию, компьютерную или магнитно-резонансную томографию головного мозга, психологические исследования. В ранних стадиях заболевания при отсутствии очагового поражения головного мозга необходимо проводить дифференциальную диагностику с невротическими, депрессивными, астеническими расстройствами. Развернутые клинические проявления ХНМК требуют исключения дегенеративных заболеваний головного мозга (болезнь Паркинсона, болезнь Альцгеймера и пр.), соматических заболеваний (сахарный диабет, гипотиреоз), интоксикаций (нейролептики, транквилизаторы, алкоголь). Консервативное лечение. При ХНМК важное значение имеют устранение факторов риска: коррекция АД, рациональное питание, дозированные физические нагрузки, правильный режим труда и отдыха, ограничение психоэмоциональных нагрузок. По показаниям проводят медикаментозную коррекцию липидного обмена (в том числе с использованием статинов) и АД (диуретики, блокаторы кальциевых каналов, ингибиторы АПФ,
а также их комбинации). Многим больным требуется применение антиагрегантов (аспирин, дипиридамол, плавикс и др.), ангиопротекторов (продектин, доксиум), комплексных вазоактивных и метаболических препаратов (трентал, стугерон, кавинтон, инстенон и др.), ноотропных и нейропротективных средств (пирацетам, инстенон, семакс, глицин). При психоэмоциональных расстройствах применяют седативные препараты, транквилизаторы, антидепрессанты. Хирургическое лечение более полно изложено во II томе учебника, посвященном хирургическим методам лечения и профилактики заболеваний нервной системы. Показания - нарушения проходимости экстракраниальных отделов артерий, кровоснабжающих головной мозг (аорта, подключичная и безымянная, сонные и позвоночные артерии). Под гемодинамически значимым стенозом понимают сужение сосуда на 70% и более. Наиболее распространенным видом операции является эндартерэктомия - иссечение атеросклеротической бляшки вместе с пораженной интимой (рис. 10.1). В месте вскрытия артерии на ее стенку накладывают шов. При обширном дефекте стенки, а также при обширном поражении стенки артерии или опасности послеоперационного стеноза используют заплату из стенки поверхностной вены ноги. При полной окклюзии артерии ее пораженный участок резецируют и замещают венозным трансплантатом или специальным протезом. При петлеобразовании иссекают удлиненную часть артерии и ее концы сшивают. Помимо открытых операций, для устранения стеноза применяют эндовазальную дилатацию пораженной артерии при помощи специальных баллон-катетеров и введение в суженный участок артерии внутренних протезов - стентов. Для профилактики ишемического поражения мозга вследствие «выключения» кровотока по артерии во время операции обеспечивают контроль функциональной активности мозга (регистрируют ЭЭГ, соматосенсорные вызванные потенциалы), поддерживают оптимальный уровень АД. При признаках недостаточности мозгового кровообращения вследствие пережатия артерии во время операции используется обходное шунтирование. 10.2. Острые нарушения мозгового кровообращения В зависимости от длительности сохраняющегося неврологического дефицита различают преходящие нарушения мозгового кровообращения (ПНМК) и инсульты. Факторами риска развития ОНМК являются генетическая предрасположенность к заболеваниям сердечно-сосудистой системы, артериальная гипертензия, сахарный диабет, избыточная масса тела, дислипопротеинемия, гиподинамия, курение, возраст, частые эмоциональные стрессы. Преходящие нарушения мозгового кровообращения Важнейшим критерием ПНМК является полная обратимость очаговой или диффузной неврологической симптоматики в течение 24 ч. В качестве форм ПНМК выделяют транзиторные ишемические атаки (ТИА) и гипертонические кризы с церебральными проявлениями. Транзиторные ишемические атаки. Причины возникновения и механизмы развития ТИА идентичны таковым при развитии ишемического инсульта. Одна из наиболее частых причин - стенозирующее поражение магистральных артерий головы. Нарушения кровотока при ТИА обычно кратковременные, не сопровождаются выраженными деструктивными изменениями мозговой ткани. Однако, как показали данные диффузионной МРТ, у ряда больных с ТИА в мозге формируются инфаркты малых размеров. Необходимо учитывать, что повторные ТИА, особенно в системе сонных артерий, нередко могут оказаться предвестником тяжелого ишемического инсульта. При ТИА наблюдаются очаговые неврологические симптомы, а менингеальные и общемозговые отсутствуют или не выражены. Клинические проявления ТИА зависят от поражения того или иного сосудистого бассейна и сходны с таковыми при ишемическом инсульте, но чаще бывают ограниченными (захватывают одну конечность или ло- кальный участок кожи лица; возможны парциальные судорожные припадки). Принципиальным отличием является лишь продолжительность очаговой неврологической симптоматики, не превышающая при ТИА 24 ч с момента появления первых симптомов. В случае обратимой компрессии позвоночных артерий при патологии шейного отдела позвоночника (остеохондроз) развиваются приступы резкой мышечной гипотонии и обездвиженности без утраты сознания, провоцируемые поворотами или запрокидыванием головы (дроп-атаки). Возникновение подобных пароксизмов с утратой сознания носит название синдрома Унтерхарншейдта. Гипертонические кризы с церебральными проявлениями. Церебральные гипертонические кризы возникают при резком подъеме АД, они могут сопровождаться нарушением проницаемости сосудистой стенки, диффузным отеком мозговых оболочек и повышением внутричерепного давления. Клиническая картина включает в себя тяжелую головную боль, головокружение и выраженные вегетативные расстройства: тошноту с повторной рвотой, гипергидроз, гиперемию кожных покровов, тахикардию, одышку, ознобоподобный тремор. Нередко возникают эмоциональные нарушения в виде тревоги, беспокойства или, наоборот, заторможенности, сонливости. Возможна кратковременная утрата сознания. В тяжелых случаях выявляются менингеальные симптомы. У некоторых больных развиваются генерализованные эпилептические припадки. Диагностика. При ТИА, особенно повторных, необходимо исключить стенозирующее поражение экстраили интракраниальных артерий, для чего используют УЗДГ, МР-ангиографию, по показаниям - контрастную ангиографию. Исследуют микроциркуляцию (агрегация тромбоцитов и эритроцитов, вязкость крови), состояние свертывающей и противосвертывающей систем крови. Для исключения геморрагического процесса применяют КТ и МРТ. При гипертонических кризах необходимо исключить вторичную гипертензию (вазоренальную, обусловленную феохромоцитомой надпочечника и др.), а при менингеальном синдроме - субарахноидальное кровоизлияние. Следует также своевременно диагностировать поражение других органов-мишеней, обусловленное повышением АД (гипертоническая ретинопатия, стенокардия). Прогноз. ПНМК является важным фактором риска развития инсульта в дальнейшем. В связи с этим больные нуждаются в систематическом наблюдении неврологом, врачами смежных специальностей (ангиохирург, кардиолог, эндокринолог, офтальмолог) для выработки оптимальной лечебной тактики. Инсульт В России, как и в большинстве развитых стран мира, инсульт занимает 2-3 место среди причин общей смертности (после заболеваний сердечнососудистой системы и онкологических заболеваний). Кроме того, инсульт - основная причина стойкой инвалидизации, так как более 10% перенесших инсульт, постоянно нуждаются в посторонней помощи и уходе. В зависимости от патоморфологических особенностей инсульта выделяют ишемический инсульт (инфаркт мозга) - вследствие резкого ограничения притока крови к головному мозгу, геморрагический - в результате кровоизлияния в ткань мозга, подоболочечные пространства или в желудочки, а также смешанные инсульты, при которых имеется сочетание очагов ишемии и геморрагии. Кроме того, выделяют малый инсульт, при котором полное восстановление нарушенных функций наступает на протяжении 21 сут, и инсульт со стойким остаточным неврологическим дефицитом. Возможны следующие варианты течения инсульта: благоприятное регредиентное с полным восстановлением утраченных функций; регредиентное с четким регрессом неврологического дефицита в сочетании с остаточными явлениями; ремиттирующее с эпизодами ухудшения состояния, обусловленного как повторными расстройствами мозгового кровообращения, так и сопутствующими соматическими заболеваниями; прогрессирующее (прогредиентное) с неуклонным нарастанием симптоматики, нередко с летальным исходом. Ишемический инсульт Этиология. Среди основных этиологических факторов, приводящих к развитию ишемического инсульта (ИИ), следует отметить атеросклероз, артериальную гипертензию и их сочетание, болезни сердца. Исключительно важна также роль факторов, способствующих повышению свертывающих свойств крови и увеличению агрегации ее форменных элементов. Риск возникновения ИИ возрастает при сахарном диабете, заболеваниях миокарда, особенно сопровождающихся расстройствами сердечного ритма. Патогенез. ИИ представляет собой гетерогенный синдром. Согласно Международной классификации TOAST, выделяют макрососудистый (атеротромботический и кардиоэмболический), микрососудистый (лакунарный), редкие (произошедшие вследствие травмы воспаления, расслоения артерий и др.) и недифференцированные (включающие сочетание двух и более факторов) формы ИИ. Причиной атеротромботического варианта инсульта является изъязвленная атеросклеротическая бляшка, приводящая либо к тромбозу магистральной артерии, либо к эмболии сосуда меньшего калибра вследствие отрыва ее фрагмента (артерио-артериальная эмболия; рис. 10.2). Кардиоэмболический вариант инсульта, как правило, возникает на фоне пристеночного тромба из постинфарктной аневризмы левого желудочка миокарда, бородавчатых разрастаний при эндокардите, ревматическом или бактериальном эндокардите, мерцательной аритмии. Микрососудистый вариант встречается при сахарном диабете, артериальной гипертензии, особенно при резких перепадах АД, антифосфолипидном синдроме. Развитие инфаркта в первые минуты и часы происходит по быстрым механизмам некротической смерти клеток. Пусковым звеном является энергетический дефицит, который инициирует так называемый глутамат-кальциевый каскад с избыточным высвобождением возбуждающих аминокислот - аспартата и глутамата и чрезмерным внутриклеточным накоплением ионов Са2+ - основного триггера конечных механизмов каскада, приводящих к смерти клетки. Формирование ядерной зоны («сердцевины» инфаркта) завершается через 5-8 мин с момента острого нарушения мозгового кровообращения. Эта область мозга окружена потенциально жизнеспособной зоной «ишемической полутени» (пенумброй), в которой снижен кровоток, но в целом сохранен энергетический метаболизм и присутствуют функциональные, а не структурные изменения. Формирование половины окончательного объема инфаркта происходит в течение первых 90 мин с момента развития инсульта 80% - в течение 360 мин в связи с чем первые 3 - 6 ч получили название «терапевтического окна», внутри которого лечебные мероприятия могут быть наиболее эффективны- ми путем спасения пенумбры.
Процессы, начинающиеся в первые часы заболевания и лежащие в основе деятельности глутамат-кальциевого каскада (изменения метаболизма глутамата и кальция, свободнорадикальные реакции, перекисное окисление липидов, избыточное образование оксида азота и др.), сохраняют значимость и в более поздние сроки, особенно при обширной области ишемического поражения. Они индуцируют и поддерживают другие отдаленные последствия ишемии: реакцию генома, иммунные сдвиги, локальное воспаление в очаге ишемии, нарушения микроциркуляции и гематоэнцефалического барьера и апоптоз. Все эти процессы обусловливают «доформирование» инфаркта мозга за счет распространения повреждения зоны пенумбры от центра ишемии к периферии. Время «доформирования» инфарктных изменений в каждом случае индивидуально, составляет от 3 до 7 сут после нарушения мозгового кровообращения. Клинические проявления. В клинической картине ИИ очаговая симптоматика преобладает над общемозговыми и менингеальными синдромами. Выраженность неврологического дефицита определяется локализацией очага ишемии, обширностью зоны инфаркта и эффективностью компенсаторных механизмов. Темпы развития ИИ в значительной степени определяются особенностями патогенеза заболевания. Апоплектиформное (моментальное) развитие свойственно кардиоэмболическому инсульту. В ряде случаев при эмболии крупного артериального ствола, сопутствующей артериальной гипертензии возможны менингеальные симптомы и угнетение сознания. Острое начало заболевания возможно и при тромбозе интракраниальной артерии. Вместе с тем возникновению атеротромботического инсульта в ряде случаев могут предшествовать единичные или повторные ТИА в той же системе, в которой впоследствии развивается инсульт. В случае нарастающего тромбоза симптоматика может ундулировать на протяжении от нескольких часов до 2-3 сут. В отдельных случаях наблюдается медленное (на протяжении нескольких недель) «опухолеподобное» нарастание очаговой симптоматики при тромботическом инсульте. Инфаркт в системе внутренней сонной артерии. Ветви внутренней сонной артерии кровоснабжают значительную часть больших полушарий: кору лобной, теменной, височной долей, подкорковое белое вещество, внутреннюю капсулу. Окклюзия интракраниального отдела внутренней сонной артерии, как правило, проявляется грубой неврологической симптоматикой в виде контралатеральных гемипарезов и гемигипестезии в сочетании с расстройствами высших корковых функций. Поражение экстракраниального сегмента может быть более благоприятным, прояв- ляется ТИА и малыми инсультами, что объясняется компенсаторным кровотоком по анастомозам, образующим виллизиев круг. При функциональной неполноценности виллизиева круга возможен грубый неврологический дефицит в сочетании с угнетением сознания. Инфаркт в бассейне передней мозговой артерии. Поверхностные ветви этой артерии снабжают кровью медиальную поверхность лобной и теменной долей, парацентральную дольку, частично глазничную часть лобной доли, наружную поверхность верхней лобной извилины, передние 2/3 мозолистого тела. Глубокие ветви кровоснабжают переднее бедро внутренней капсулы, скорлупу, бледный шар, частично гипоталамическую область. Клиническая картина поражения передней мозговой артерии проявляется развитием контралатерального спастического пареза преимущественно в проксимальном отделе руки и дистальном - ноги. Вследствие поражения парацентральной дольки возможны нарушения мочеиспускания и дефекации. Возникают рефлексы орального автоматизма и хватательные рефлексы (Янишевского). Возможны поведенческие изменения: аспонтанность, дурашливость, неопрятность, элементы асоциального поведения. Инфаркт в бассейне средней мозговой артерии. Артерия кровоснабжает большую часть подкорковых узлов и внутренней капсулы, кору височной и теменной долей. В зоне ее кровоснабжения наиболее часто локализуются ИИ. При поражении ствола артерии до отхождения от него глубоких ветвей развивается тотальный инфаркт с контралатеральными грубыми гемиплегией, гемианестезией и гемианопсией. При поражении артерии после отхождения глубоких ветвей (обширный корково-подкорковый инфаркт) имеется сходная симптоматика, но выраженная несколько меньше (более глубокий парез в руке). Поражение доминантного полушария сопровождается развитием афазии, алексии, аграфии, апраксии. При локализации инсульта в субдоминантном полушарии возникают анозогнозия, расстройства схемы тела, возможны псевдореминисценции и конфабуляции. Инфаркт в вертебрально-базилярной системе. Составляющие эту систему позвоночные и основная артерии обеспечивают кровоснабжение ствола мозга, лабиринта, мозжечка, затылочных долей, медиобазальных отделов височных долей. При поражении экстракраниального отдела можно отметить мозаичность («пятнистость») нарушений различных отделов мозгового ствола и мозжечка. Как правило, наблюдаются вестибулярные расстройства (головокружение, атаксия, спонтанный нистагм), нарушения статики и координации, признаки поражения мостового центра взора, зрительные нарушения. При окклюзии интракраниального отдела позвоночной артерии развиваются альтернирующие синдромы с поражением как оральных, так и каудальных отделов мозгового ствола, мозжечковыми расстройствами, проводниковыми пирамидными и чувствительными нарушениями (наиболее часто это варианты синдрома Валленберга-Захарченко). Двусторонний тромбоз позвоночных артерий и тромбоз основной артерии приводят к грубому поражению нижних отделов ствола с нарушением жизненно важных функций. Задние мозговые артерии и их ветви кровоснабжают затылочную долю и лучистость Грациоле, медиобазальные отделы височной доли, заднюю треть таламуса и гипоталамической области, заднюю треть мозолистого тела. При ишемии в зоне кровоснабжения этой артерии развивается гомонимная гемианопсия с сохранностью макулярного зрения или верхнеквадрантная гемианопсия, в ряде случаев - метаморфопсии и зрительная агнозия. Поражение медиобазальных отделов височной доли сопровождается нарушениями памяти по типу корсаковского синдрома, эмоциональными расстройствами. При инфаркте в бассейне глубоких ветвей задней мозговой артерии развивается таламический синдром (Дежерина-Русси) - сочетание контралатеральных гемигипестезии, гиперпатии, дизестезии и таламических болей, в контралатеральных конечностях возможны атаксия и интенционный тремор, иногда в сочетании с гемибаллизмом (верхний синдром красного ядра). Прогноз определяется обширностью зоны поражения, выраженностью перифокального отека и признаками вторичного стволового синдрома, а также компенсаторными возможностями организма. Состояние наиболее тяжелое в первые 2-5 сут заболевания, что определяется выраженностью неврологического дефицита, расстройствами сознания, соматическим состоянием. Летальность при ишемическом инсульте составляет 20%. Тяжелая инвалидизация достигает 30%. При повторных инсультах (в том числе небольших по объему) нередко развивается мультиинфарктная деменция. Алгоритм обследования больного. При поступлении больного с инсультом в стационар ему проводят следующие исследования: • клиническое неврологическое исследование; • компьютерную и/или магнитно-резонансную томографию головного мозга для верификации характера очага и оценки его величины, а также при возможности, КТ- и/или МР-ангиографию для верификации окклюзии крупных артериальных стволов; • оценку гемостаза, включая основные реологические свойства крови; • экстра- и транс-краниальную допплерографию для верификации локализации окклюзии или стеноза «симптомной» артерии. Всем больным с острым инсультом в течение первых 48 часов заболевания целесообразно осуществлять мониторинг неврологического и соматического статуса, температуры тела, сердечно-сосудистых функций (АД, ЭКГ, частота сердечных сокращений), основных лабораторных параметров крови (прежде всего, глюкозы и показателей гемостаза). По показаниям - мониторирование проводится более длительно. Важно отметить, что КТ головного мозга является международным стандартом при постановке диагноза ОНМК и индикатором аккредитации лечебного учреждения для оказания помощи больным с инсультом. При доступности КТ/ МРТ, люмбальную пункцию проводят лишь больным с клинической картиной субарахноидального кровоизлияния, но при отсутствии признаков крови в субарахноидальных пространствах по КТ и/или МРТ. Если нет возможности выполнить КТ/МРТ головного мозга, люмбальная пункция помогает дифференциации форм инсульта. Цереброспинальная жидкость при ишемическом инсульте обычно прозрачная, с нормальным содержанием белка и клеточных элементов. Обнаружение крови в ликворе при люмбальной пункции может указывать на кровоизлияние в мозг с прорывом крови в желудочковую систему или субарахноидальное кровоизлияние, а также быть следствием травмирования венозных сосудов в области прокола («путевая кровь»). Для выяснения причины ишемического инсульта используют неинвазивные УЗИ-методы исследования сосудов (дуплексное и триплексное сканирование прецеребральных артерий головы и церебральных артерий). Данные исследования позволяют визуализировать сонные артерии и одновременно исследовать кровоток методом спектральной допплерографии (рис. 10.3), методы компьютерной обработки выявляют поражения в области бифуркации сонных артерий, транскраниальная допплерография позволяет провести спектральное допплерографическое
исследование некоторых внутричерепных артерий и косвенно оценить скорость кровотока в них. Важен транскраниальный допплеровский мониторинг для регистрации церебральной микроэмболии Церебральная ангиография - наиболее надежный метод диагностики поражения сосудов головного мозга, особенно в случаях поиска аневризм и мальформаций сосудов, а также при подготовке больного к плановой профилактической операции на «симптомной» артерии (каротидная эндартерэктомия, стентирование). Однако в связи с риском развития осложнений контрастная ангиография должна использоваться только в случаях, когда от ее результатов зависит тактика лечения больного. В большинстве случаев целесообразно применять МРТ и КТ в ангиографическом режиме (рис. 10.10.). При внутриартериальной или внутривенной дигитальной субтракционной ангиографии (рис. 10.4) качество изображения экстракраниальных отделов сонных артерий близкое к получаемому при контрастной внутриартериальной ангиографии. При внутривенном введении необходимо значительно большее количество контраста, чем при обычной ангиографии, поэтому субтракционная внутривенная ангиография не рекомендуется при почечной недостаточности, особенно на фоне сахарного диабета. Субтракционная внутриартериальная ангиография позволяет уменьшить количество вводимого контраста. Важное место в диагностике и определении состояния больного играет соматическое обследование. В первую очередь важно оценить функции дыхания и сердечно-сосудистой системы, затем - других внутренних органов. При обследовании сердечно-сосудистой системы в первую очередь диагностируются нарушения центральной гемодинамики с целью их экстренной коррекции, а затем - интракраниальных патологических процессов, могущих являться причиной ишемического инсульта. Наличие аритмии, выявление шумов в сердце позволяют предположить кардиоэмболический характер инсульта. Систолический шум в области бифуркации общей сонной артерии - признак ее стеноза. Ослабление/отсутствие пульса и уменьшение АД на одной стороне - признак стеноза дуги аорты и подключичных артерий. Поскольку кардиологическая патология у больных с инсультом встречается очень часто, ЭКГ является обязательным методом исследования. С ее помощью диагностируются нарушения ритма, ишемия миокарда. Холтеровское мониторирование ЭКГ используется при подозрении на эмболический генез инсульта в результате пароксизмального нарушения сердечного ритма. Эхокардиографию проводят при подоз-
а - окклюзия левой позвоночной артерии; б - окклюзия бифуркации правой общей сонной артерии рении на патологию клапанов сердца, кардиомиопатию, внутрисердечный тромб, аневризму желудочков, незаращение овального окна и др. Рентгенография органов грудной клетки необходима для диагностики легочных осложнений (застойная аспирационная пневмония, тромбоэмболия), кардиальных нарушений (изменение конфигурации сердца, расширение его границ). Необходимый минимум лабораторных исследований: • клинический анализ крови с определением числа тромбоцитов (выявление патологии крови, системных заболеваний, вторичных осложнений). Гематокрит является основным показателем эффективности проводимой гемодилюции. Исследование числа тромбоцитов в динамике позволяет своевременно распознать вторичное нарушение гемостаза, в т.ч. ДВС-синдром; • определение группы крови, резус-фактора, анализ крови на ВИЧ, реакция Вассермана; • биохимический анализ крови с определением глюкозы, мочевины, креатинина, билирубина, АСТ, АЛТ, холестерина, ТАГ, ЛПВП, ЛПНП, СРБ; • электролиты (натрий, калий), осмолярность плазмы; • газовый состав крови, кислотно-основное состояние - необходимы, прежде всего, для определения показаний к проведению ИВЛ; • коагулограмма с определением фибриногена, фибринолитической активности, АЧТВ, тромбинового времени, протромбина, МНО, времени свертываемости крови; исследование реологических свойств крови, агрегации тромбоцитов и эритроцитов, деформируемости мембран эритроцитов (рис. 10.5.) • анализ мочи. Методы вычислительной томографической диагностики занимают ведущее место при исследовании больных с сосудистыми заболеваниями мозга. Достаточно отметить, что уже первый из этих методов - КТ позволил определять характер церебрального инсульта - ишемический или геморрагический - с надежностью, приближающейся к 100 % (в зависимости от сроков исследования). Без использования данного метода ошибка указанной дифференциальной диагностики достигала 15-20% даже в специализированных отделениях. Ведущими и наиболее часто используемыми методами лучевой диагностики инсульта являются КТ и ее разновидность - КТ-ангиография и МРТ, включая МР-ангиографию. Выявление инфаркта мозга методом КТ. При ишемическом инсульте частота выявления зоны поражения методом КТ зависит от длительности промежутка времени между клиническим дебютом инсульта и КТ исследованием, а также от характера поражения (наличие геморрагической трансформации), величины и локализации инфаркта. При полушарной локализации инфаркта с вовлечением коры мозга изменения могут выявляться через 3 часа от начала заболевания, к
концу первых суток частота визуализации КТ изменений достигает 60%, в дальнейшем она нарастает и к 7-му дню инсульта достигает 100% всех выявляемых при данном исследовании ИМ. Ишемические повреждения мозга в структурах задней черепной ямки при КТ выявляются хуже по сравнению с полушарной локализацией данных изменений. В значительной степени это связано с обычно небольшим объемом зоны поражения и с наличием артефактов при КТ сканировании данной области. Наиболее ранним КТ признаком ишемического повреждения в системе средней мозговой артерии является отсутствие визуализации чечевицеобразного ядра или коры островка в связи с развитием в зоне поражения цитотоксического отека мозга (рис. 10.6). При больших полушарных инфарктах в течение первых часов инсульта еще до появления гиподенсивных изменений в веществе мозга выявляется локальный объемный эффект в виде сужения корковых борозд в зоне поражения и сдавления бокового желудочка на стороне поражения. Аналогичные изменения могут наблюдаться также при больших инфарктах мозжечка. В остром периоде ишемического инсульта доминирующим типом тканевых изменений в зоне ишемического повреждения является цитотоксический отек, к которому обычно присоединяется и вазогенный отек при поражении микроциркуляторного русла. На КТ изображениях зона инфаркта в течение первой недели заболевания выглядит как равномерно гиподенсивный участок, оказывающий объемный эффект на окружающие структуры мозга (рис. 10.7). В большинстве случаев данный участок соответствует определенному сосудистому бассейну и имеет клиновидную форму с основанием наружу.
В ряде случаев при ишемическом инсульте в качестве ранних изменений выявляется гиперденсивность участков средней, реже - задней мозговых артерий на стороне поражения, что свидетельствует о наличии тромбоза или эмболии данных сосудов. При КТ исследовании у больных с ишемическим инсультом могут также выявляться различные сосудистые изменения, потенциально способные вызывать ишемические повреждения мозга: кальцификаты в атеросклеротических бляшках в стенках артерий, извитость и расширение сосудов, церебральные сосудистые мальформации. Начиная с конца первой недели в сером веществе в зоне ишемического повреждения наблюдается повышение плотности до изоденсивного, а иногда и слабогиперденсивного состояния, что связано с развитием реактивного неовазогенеза и восстановлением иногда избыточного кровотока. Данный феномен определяется как эффект затуманивания, он затрудняет выявление истинных границ зоны ишемического повреждения. В течение второй недели ИМ обычно регрессирует положительный эффект объемного воздействия, а позже начинает проявляться эффект утраты вещества мозга. Через 1,5-2 месяца на КТ изображениях выявляются гиподенсивные изменения, соответствующие формирующейся постинфарктной кисте. При КТ хорошо выявляется геморрагическая трансформация в зоне острого ишемического повреждения, которая может быть по типу пропитывания кровью вещества мозга или в виде формирования кровоизлияния. Соответственно наблюдаются умеренно выраженные или выраженные гиперденсивные изменения в зонах геморрагической трансформации (см. рис. 10.6). Диагностика геморрагической трансформации по типу пропитывания является более сложной задачей по сравнению с диагностикой внутримозговой гематомы, в типичных случаях данный тип трансформации характеризуется отсутствием однородности показателей тканевой плотности в зоне кровоизлияния, которая располагается внутри или по краю зоны пониженной плотности, соответствующей инфаркту. В первые дни ишемического инсульта контрастное усиление обычно не повышает информативности КТ исследования и, как правило, не используется. Начиная со второй недели заболевания при развитии эффекта «затуманивания» контрастное усиление используется для уточнения распространенности зоны поражения, в частности, в коре мозга. Контрастный препарат преимущественно накапливается в сером веществе в зоне поражения - гиральный тип контрастного усиления (рис. 10.8.). Это связано с преобладанием реактивного ангиогенеза в сером веществе мозга, в котором исходно плотность капилляров более высокая по сравнению с белым веществом. Выявление инфаркта мозга методом МРТ. При использовании высокопольного МР-томографа на Т2-взвешенном изображении (Е2-ВИ) повышение интенсивности сигнала в зоне инфаркта может наблюдаться через 3 часа от начала инсульта, через 8 часов изменения на МР изображениях отмечаются у 15% больных и через 24 часа - у 90% пациентов. Но определение объема поражения при инфаркте, а также выявление мелких участков ишемического повреждения мозга вблизи ликворных пространств на обычных Т2-ВИ затруднено в связи с высоким сигналом от спинномозговой жидкости. В этих случаях имеют преимущество изображения, полученные на режиме с подавлением сигнала свободной воды (рис. 10.9. и 10.10.). На Т1-ВИ снижение сигнала в зоне инфаркта умеренное и в первые сутки инсульта для диагностики малоинформативное. Отражая динамику развития отека мозга (цитотоксического и развивающегося вслед за ним вазогенного), интенсивность сигнала на Т2-ВИ и протон-взвешенных изображениях в зоне инфаркта увеличивается к 4-7- м суткам инсульта, затем снижается к 10-14-м суткам заболевания. Имеются описания отдельных наблюдений выраженного снижения интенсивности сигнала на Т2-ВИ к концу второй недели инсульта, когда очаг инфаркта становился практически изоинтенсивным по отношению к нор-
а - окклюзия правой средней мозговой артерии вблизи бифуркации сонной артерии (указан стрелкой). МР-ангиограмма; б - обширная зона инфаркта в бассейне правой средней мозговой артерии. МР-томограмма мальному веществу мозга, на основании чего был предложен термин «МРзатуманивание», по аналогии с эффектом «затуманивания» при КТ Наряду с изменением интенсивности сигнала на МР изображениях появляется и нарастает объемный эффект, проявляющийся сглаженностью рисунка борозд и извилин мозга, сдавлением наружных и внутренних ликворных пространств. Данные изменения при МРТ исследо- вании выявляются более точно и надежно по сравнению с КТ в связи с возможностью получения изображений в различных проекциях. Для геморрагической трансформации повышение сигнала на Т1-ВИ, связанное с появлением метгемоглобина во внеклеточном пространстве, является основным диагностическим критерием. Данный признак начинает выявляться через 5-7 дней от момента развития геморрагической трансформации и сохраняется в течение нескольких недель, когда КТ признаки данного осложнения инфаркта уже регрессируют. В процессе организации инфаркта наблюдаются два основных типа тканевых изменений в зоне поражения - формирование кистозных полостей, заполненных ликвороподобной жидкостью (кистозная трансформация), и пролиферация глии (глиозная трансформация). Дифференцировка данных типов тканевых изменений затруднена как на КТ изображениях, так и на обычных Т2-ВИ и Т1-ВИ, так как в участках глиозной трансформации общее содержание воды также повышено, хотя и в меньшей степени, чем в постинфарктных кистах. На изображениях, полученных при использовании режима с подавлением свободной воды, участки глиозной трансформации имеют высокий сигнал, так как вода в клетках глии связанная, в отличие от этого постинфарктные кисты будут гипоинтенсивными, так как содержат в основном свободную воду (рис. 10.11.). Использование данного режима позволяет надежно определять соотношение двух указанных типов тканевых изменений в зоне хронического ИМ и соответственно изучать влияние на них различных факторов, в том числе терапевтических воздействий.
Применение контрастного усиления (с помощью препаратов гадолиния) может предоставить дополнительную информацию в диагностике инфаркта мозга. Гадолиний сокращает время Т1 релаксации, что приводит к появлению сигнала повышенной интенсивности на Т1-ВИ в местах его накопления. Различают два основных типа контрастного усиления - внутрисосудистое и паренхиматозное. Внутрисосудистый тип накопления контрастного препарата отражает, как правило, замедление тока крови в очаге поражения и может быть одним из самых ранних признаков ишемии мозга, предшествуя изменениям интенсивности сигнала на Т2-ВИ и Т1-ВИ. Паренхиматозный тип контрастного усиления связан с повреждением гематоэнцефалического барьера и выходом контрастного препарата из сосудистого русла в вещество мозга. В 60-78% случаев у больных с ишемическим инсультом в первые сутки заболевания наблюдается эффект внутрисосудистого контрастного усиления, причем чаще при большом объеме и корковой локализации очага поражения, паренхиматозный тип контрастного усиления в это время встречается значительно реже - в 26% случаев. Однако к 6-7-м суткам заболевания фактически у всех больных отмечается паренхиматозный тип контрастного усиления и лишь в трети случаев - внутрисосудистый. В дальнейшем эффект контрастного усиления ИМ снижается. Использование ДВИ и перфузионных МР изображений позволяет решать диагностические задачи, которые невозможно решить при использовании других методов КТ и МРТ исследования. В экспериментах на животных участки ИМ выявляются на ДВИ уже через несколько минут от момента развития церебральной ишемии. Это связано с перемещением молекул воды из внеклеточного пространства в клетки в зоне развития цитотоксического отека мозга. В клетках диффузионные движения молекул воды затруднены в связи с наличием различных мембран и крупномолекулярных структур, что на ДВИ проявляется отчетливыми гиперинтенсивными изменениями. Таким образом, данный режим позволяет диагностировать ИМ непосредственно в момент его развития, в последующем на ДВИ наблюдаются изменения, которые позволяют контролировать динамику отека мозга, в частности соотношение его цитотоксического и вазогенного компонентов, что невозможно при использовании других МРТ методов исследования. На перфузионных МР изображениях выявляются участки гипоперфузии мозга. Сопоставление распространенности данных изменений с величиной гиперинтенсивных участков на ДВИ позволяет дифференцировать зону необратимых ишемических повреждений вещества мозга от пенумбры - зоны гипоперфузии с потенциально обратимыми тканевыми изменениями. У взрослых пациентов на обратимость изменений в зоне гипоперфузии указывает отсутствие признаков цитотоксического отека, то есть гиперинтенсивных изменений на ДВИ. У детей появление последних может не сопровождаться развитием необратимых изменений в зоне гипоперфузии. МРТ является наиболее информативным методом прижизненной диагностики ишемического инсульта, визуализация острой фокальной ишемии мозга возможна уже через несколько минут от ее начала (при помощи диффузионно- и перфузионно-взвешенных последовательностей). Ограничения МРТ заключаются в более длительном времени и более высокой стоимости исследования, невозможности исследования пациентов с металлическими телами в полости черепа и кардиостимуляторами. В настоящее время общепринятым стандартом при исследовании больных с острой сосудистой неврологической патологией считается предпочтительное использование КТ в первые сутки заболевания с целью дифференциальной диагностики между ишемическим поражением и геморрагическим инсультом, поскольку в первые сутки выявляемость кровоизлияний при КТ выше, чем при МРТ. Геморрагический инсульт Классификация. Геморрагические инсульты подразделяются на паренхиматозные кровоизлияния (кровоизлияния в вещество головного мозга), подоболочечные (нетравматические субарахноидальные, эпи- и субдуральные гематомы) и внутрижелудочковые кровоизлияния. Встречаются и смешанные формы (субарахноидально-паренхиматозное, паренхиматозно-субарахноидальное, паренхиматозно-внутрижелудочковое). Этиология. Наиболее частые причины геморрагического инсульта: гипертоническая болезнь, симптоматическая артериальная гипертензия и врожденные сосудистые аномалии, в первую очередь аневризмы сосудов мозга. Возможно развитие геморрагического инсульта на фоне нарушения свертываемости крови (гемофилия, передозировка антикоагулянтов, тромболитиков). Патогенез. Геморрагический инсульт развивается чаще в результате разрыва сосуда, который обычно происходит при повышении АД и приводит к образованию гематомы. К этому предрасполагают резкое истончение, расслоение стенки измененного сосуда, образование милиарных аневризм, врожденные аневризмы и другие сосудистые аномалии, деструкция стенки сосуда при васкулитах. Значительно реже воз- никают кровоизлияния при повышении проницаемости сосудистой стенки. Диапедезное кровотечение - следствие вазомоторных нарушений, длительного спазма сосуда, приводящего к замедлению в нем кровотока, и последующей его дилатации. При этом повышается проницаемость стенки сосуда, из него выпотевают плазма и форменные элементы крови. Мелкие периваскулярные кровоизлияния, сливаясь, образуют небольшие или обширные геморрагические очаги. Паренхиматозное кровоизлияние. При паренхиматозных кровоизлияниях возможны кровоизлияния по типу гематомы и геморрагического пропитывания. Чаще кровь выходит из артериальных сосудов, хотя иногда возникают и венозные кровоизлияния. Паренхиматозные кровоизлияния чаще бывают при заболеваниях с повышенным АД, что ведет к изменениям стенок мозговых сосудов и нарушению их проницаемости - плазматическому пропитыванию, некрозам, образованию микроаневризм и к их разрыву (рис. 10.12). При гипертонической болезни наиболее тяжелым изменениям подвергаются сосуды подкорковых узлов и таламуса, что обусловлено отхождением глубоких ветвей от основного ствола средней мозговой артерии почти под прямым углом. В связи с этим гематомы чаще возникают в подкорковых узлах и распространяются в прилежащее белое вещество мозга. В большом полушарии дифференцируют латеральные и медиальные гематомы в зависимости от их расположения латерально или медиально относительно внутренней капсулы (рис. 10.13). Возможны и так называемые смешанные обширные гематомы, разрушающие внутреннюю капсулу и структуры мозга по обе стороны от нее. По объему гематомы в полушариях большого мозга подразделяются на малые (менее 40 см3) и большие (более 40 см3). Редко гематомы встречаются в стволе мозга, обычная их локализация - мост и мозжечок. Кровоизлияния по типу геморрагического пропитывания возникают путем диапедеза из мелких сосудов. В большинстве случаев при обширных медиальных кровоизлияниях кровь прорывается в желудочки мозга (паренхиматозно-внутрижелудочковые кровоизлияния), значительно реже - в су-
барахноидальное пространство (паренхиматозно-субарахноидальные кровоизлияния). Кровоизлияние приводит к гибели нервной ткани в месте гематомы. Поражение вещества мозга также происходит вследствие его сдавления гематомой и повышения внутричерепного давления. Вследствие механического и рефлекторного сдавления сосудов при кровоизлиянии развивается ишемия прилежащих областей вещества головного мозга, что способствует развитию цитотоксического и вазогенного отека и еще больше повышает внутричерепное давление. Исходом кровоизлияний в мозг может быть формирование глиомезодермального рубца или кисты. Поскольку гематома возникает главным образом вследствие отодвигания или раздвигания тканей мозга, то после ее организации остается узкая щелевидная киста. Она намного меньше исходной гематомы. Клинические проявления. Геморрагический инсульт возникает, как правило, внезапно, его могут провоцировать психоэмоциональное перенапряжение, физические нагрузки. Иногда инсульту предшествуют вегетативные симптомы: «приливы» крови к лицу, интенсивная головная боль, видение предме- тов в красном свете. Развитие инсульта обычно острое (апоплексия). Возникают резкая головная боль, рвота, учащение дыхания, брадиили тахикардия, гемиплегия или гемипарез, нарушение сознания (оглушение, со- пор или кома). В 10% случаев развиваются генерализованные эпилептические припадки. При латеральных кровоизлияниях малого объема или диапедезных кровоизлияниях клиническая картина напоминает ишемический инсульт с преобладанием очаговой неврологической симптоматики над общемозговой и менингеальной. Такую гематому можно достоверно диагностировать только по данным КТ/МРТ. При медиальных кровоизлияниях или гематомах большого объема общемозговые симптомы во многих случаях преобладают над очаговыми. Сознание угнетено до уровня сопора или комы. При смешанных гематомах или паренхиматозно-вентрикулярном кровоизлиянии коматозное состояние может развиться в начальной фазе инсульта, и больной сразу же оказывается в крайне тяжелом состоянии. Обширные кровоизлияния в большое полушарие мозга нередко осложняются вторичным стволовым синдромом. Он проявляется прогрессирующими расстройствами дыхания, сердечной деятельности, сознания, изменениями мышечного тонуса по типу горметонии (периодические тонические спазмы с резким повышением тонуса в конечностях) и децеребрационной ригидности, вегетативными расстройствами. Кровоизлияние в базальные ядра и внутреннюю капсулу обычно проявляются контралатеральной гемиплегией, гемианестезией, гемианопсией, парезом лицевой мускулатуры и языка по центральному типу, афазией (при поражении доминантного полушария) или нарушениями схемы тела, аутопатогнозией, анозогнозией (при поражении субдоминантного полушария). Кровоизлияния в таламус проявляются контралатеральной гемианестезией и гемиатаксией, гемианопсией, иногда преходящим гемипарезом. Возможны амнезия, сонливость, апатия. Кровоизлияния в ствол мозга обусловливают нарушения витальных функций, симптомы поражения ядер черепных нервов и парезы конечностей, иногда в виде альтернирующих синдромов. Часто наблюдаются страбизм (косоглазие), анизокория, мидриаз, «плавающие» движения глазных яблок, нистагм, нарушения глотания, мозжечковые симптомы, двусторонние пирамидные рефлексы. При кровоизлиянии в мост отмечаются миоз, парез взора в сторону очага (взор обращен в сторону парализованных конечностей). Раннее повышение мышечного тонуса (горметония, децеребрационная ригидность), парез взора вверх и отсутствие зрачковых реакций (симптом Парино) возникают при кровоизлияниях в оральные отделы ствола мозга. Очаги в нижних отделах ствола сопровождаются ранней мышечной гипотонией или атонией, признаками бульбарного синдрома. Кровоизлияния в мозжечок вызывают выраженное головокружение, миоз, нистагм, повторную рвоту, резкую боль в области затылка и шеи, гипотонию или атонию мышц, атаксию, быстрое нарастание внутричерепной гипертензии. Течение. Наиболее тяжелыми осложнениями геморрагического инсульта являются отек мозга, сдавление и смещение мозгового ствола, окклюзия ликворных путей. При обширных полушарных геморрагиях, осложненных рано присоединившимся прорывом крови в желудочки, сразу развивается коматозное состояние, маскирующее очаговые симптомы. Через несколько часов, а иногда и сразу наступает летальный исход. Также быстро смерть наступает при кровоизлиянии в мозжечок и мозговой ствол, осложненном прорывом крови в IV желудочек, отеком и дислокацией мозга. Летальность при кровоизлияниях в мозг высокая и колеблется в пределах от 60 до 90%. При ограниченных латеральных полушарных гематомах сознание обычно нарушено умеренно. Состояние больных сначала стабилизируется, а затем улучшается: восстанавливается сознание, уменьшаются вегетативные расстройства, постепенно уменьшается выраженность очагового неврологического дефицита. Вслед за периодом ранней мышечной гипертонии и гипотонии начинает формироваться поздняя гемиплегическая гипертония спастического типа с характерной позой Верни- ке-Манна (сгибание предплечья, пронация и сгибание кисти, сгибание пальцев, разгибание бедра и голени). Субарахноидальное кровоизлияние чаще возникает вследствие разрыва аневризмы сосудов основания мозга при гипертонической болезни. Субарахноидальное кровоизлияние обычно возникает остро, без предвестников. Изредка предвестниками субарахноидального кровоизлияния становятся головокружение, «мелькание» перед глазами, шум в голове. Появляется резкая головная боль по типу «удара в затылок», «распространения в голове горячей жидкости». Сначала боль может быть локальной (в области лба, затылка), затем становится разлитой. Нередко боль отмечается в шее, межлопаточной области. Быстро развиваются менингеальные симптомы (ригидность шейных мышц, симптомы Кернига, Брудзинского и др.), светобоязнь. Одновременно с головной болью и менингеальными симптомами возникают тошнота, рвота, кратковременное или длительное расстройство сознания, психомоторное возбуждение. Возможны эпилептические припадки. Очаговая мозговая симптоматика выявляется не всегда, но при разрыве базальных артериальных аневризм возможны признаки поражения черепных нервов, особенно глазодвигательных, иногда зрительного нерва или зрительного перекреста. Температура тела повышается. Могут быть дыхательные и сердечно-сосудистые расстройства. Спонтанные субдуральная и эпидуральная гематомы. Формирование субдуральных гематом обычно обусловлено черепно-мозговой травмой, но как редкий случай встречаются и спонтанные кровоизлияния. В 50% случаев развитие этих гематом связано с осложнениями антикоагулянтной терапии. В качестве других причин известны разрыв пиальной артерии, артериовенозная мальформация, мешотчатая аневризма, заболевания крови (гемофилия, тромбоцитопения, лейкемия). По клиническому течению спонтанные суб- и эпидуральные гематомы не отличаются от травматических. Диагностика. Диагноз кровоизлияния в мозг основывается на остром развитии общемозговых, очаговых неврологических нарушений, менингеальных симптомов и влиянии факторов риска (артериальная гипертензия, злоупотребление алкоголем и др.). Необходимо помнить о том, что кровоизлияния в мозг могут быть осложнениями антикоагулянтной терапии, заболеваний крови (гемофилия, лейкемия, тромбоцитопения), употребления кокаина. Методы вычислительной томографической диагностики. До настоящего времени КТ является методом выбора для диагностики геморрагических нарушений мозгового кровообращения. Жидкая кровь имеет рентгеновскую плотность близкую к плотности серого вещества мозга, но при кровоизлияниях в результате ретракции свертка крови в нем происходит существенное повышение плотности (гиперденсивные изменения), обусловленное повышением содержания гемоглобина. В первые часы кровоизлияния наблюдаются также гиподенсивные изменения в пограничной зоне, обусловленные накоплением плазмы крови вокруг свертка при ретракции последнего. К концу первых суток развивается перифокальный вазогенный отек, который при кровоизлиянии может сохраняться до нескольких недель (рис. 10.14.). Метод КТ позволяет надежно выявлять осложнения при внутримозговом кровоизлиянии. Прорыв крови в желудочки мозга сопровождается эффектом седиментации и наличием горизонтального уровня жидкости между ЦСЖ, находящейся вверху, и более тяжелыми эритроцитами, которые под влиянием силы тяжести оседают в наиболее низко расположенных отделах желудочковой системы мозга - в зад-
них рогах при стандартном расположении пациента при КТ исследовании лицом вверх (см. рис. 10.14.). При внутримозговых кровоизлияниях ликвородинамические нарушения с развитием окклюзионной гидроцефалии могут быть связаны как с объемным воздействием гематомы на пути оттока ЦСЖ, так и с гемотампонадой желудочков мозга. С конца первой недели после развития геморрагического инсульта, при рассасывании гематомы, наблюдается феномен «тающего кусочка сахара» - прогрессирующее снижение рентгеновской плотности гематомы от ее периферии к центру (рис.10.15.). В этот период времени наблюдается кольцевидное накопление контрастного препарата, обусловленное «незрелостью» гематоэнцефалического барьера в зоне реактивного неовазогенеза вокруг гематомы. Неовазогенез обеспечивает повышенный приток макро-
фагов, участвующих в рассасывании гематомы, так как он относительно равномерно выражен вокруг всей зоны кровоизлияния, накопление контрастного вещества также равномерное и обычно без разрывов и одинаковой ширины, что отличает его от кольцевидных форм контрастного усиления при опухолях мозга. Но в целом в подостром периоде кровоизлияния диагностические возможности КТ по сравнению с МРТ снижаются. Постгеморрагические кисты в белом веществе обычно имеют вытянутую или щелевидную форму в отличие от кист после инфаркта мозга, так как гематома помимо разрушения вещества мозга вызывает смещение проводящих путей вследствие объемного воздействия излившейся крови, а после рассасывания последней восстанавливается их обычное расположение. Но в большинстве случаев, особенно при небольших по размеру зонах поражения, КТ признаки недостаточно надежны для определения характера ранее перенесенного нарушения мозгового кровообращения. При кровоизлияниях изменения интенсивности магнитно-резонансного сигнала и обусловленные этим изменения тканевого контраста определяются многими биологическими и техническими факторами. Из первых основное значение имеет состояние молекулы гемоглобина, связанное с переходом оксигемоглобина в деоксигемоглобина, а затем - в метгемоглобин и гемосидерин, что изменяет магнитные свойства данного соединения. Из технических факторов важное значение имеют сила магнитного поля томографа и особенности используемых режимов исследования. В первые часы заболевания на обычных Т2-взвешенных изображениях кровоизлияние имеет более высокий сигнал по сравнению с веществом мозга, что более выражено в периферических отделах всей зоны поражения и связано с накоплением в пограничной зоне жидкости (плазмы крови при ретракции свертка). На Т1-взвешенных изображениях гематома обычно остается изоинтенсивной, но в пограничной зоне, особенно при крупных кровоизлияниях, могут наблюдаться гипоинтенсивные изменения, обусловленные описанным выше накоплением здесь жидкости. В последующие 2-4 дня интенсивность сигнала гематомы на Т2-взвешенных изображениях снижается, так как образующийся в это время деоксигемоглобин является парамагнетиком, который ускоряет Т2-релаксацию по механизму так называемого эффекта магнитной восприимчивости (рис. 10.16.). Дата добавления: 2015-12-16 | Просмотры: 1953 | Нарушение авторских прав |
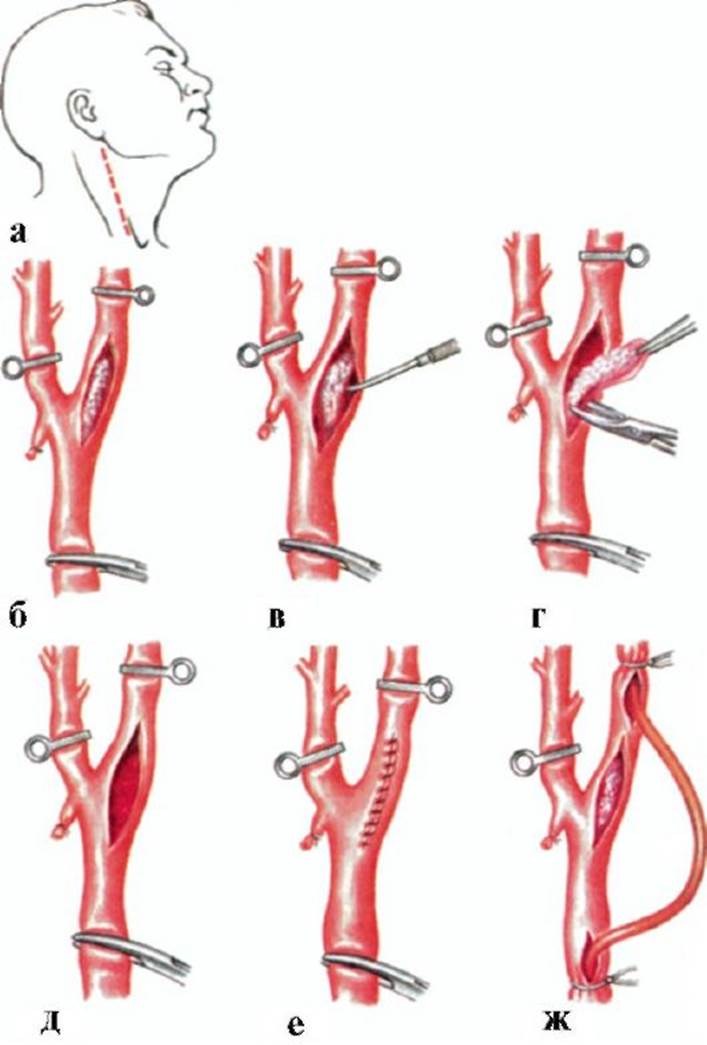 Рис. 10.1. Тромбинтимэктомия из сонной артерии. а - линия разреза мягких тканей; б-е - этапы атеросклеротической бляшки вместе с ее интимой; ж - создание обходного аностамоза
Рис. 10.1. Тромбинтимэктомия из сонной артерии. а - линия разреза мягких тканей; б-е - этапы атеросклеротической бляшки вместе с ее интимой; ж - создание обходного аностамоза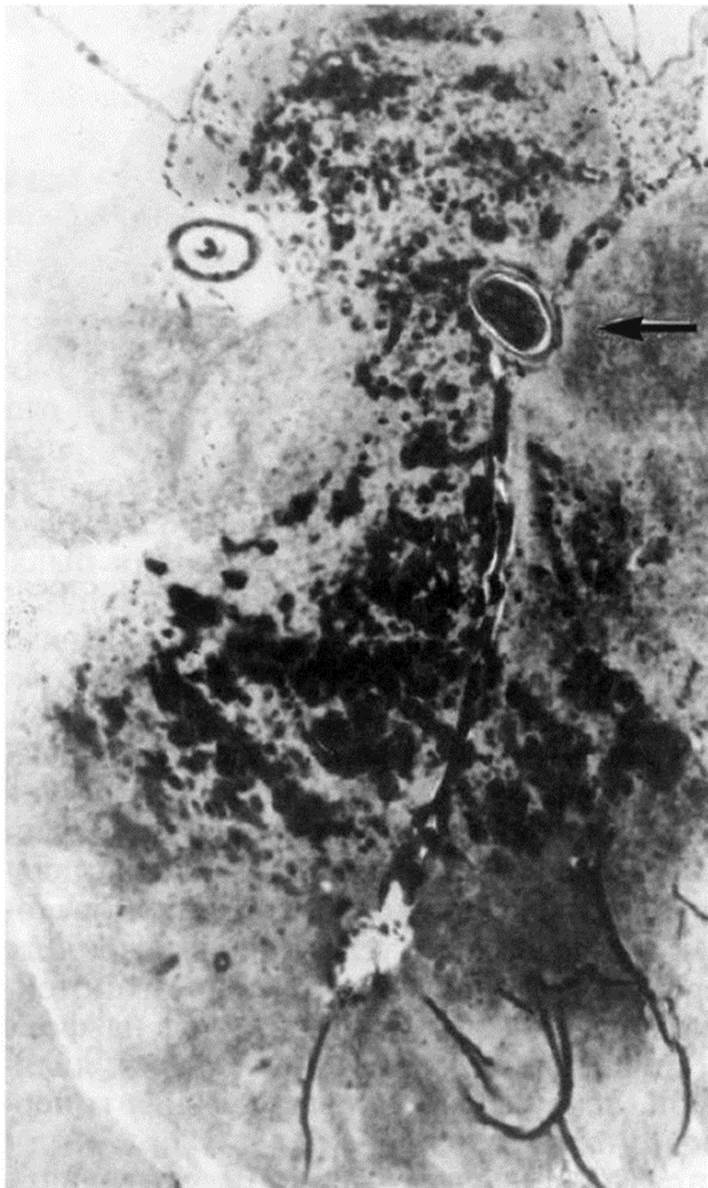 Рис. 10.2. Красный инфаркт в коре большого мозга (микропрепарат). Тромбоэмбол в поверхностной артерии мозга (указан стрелкой)
Рис. 10.2. Красный инфаркт в коре большого мозга (микропрепарат). Тромбоэмбол в поверхностной артерии мозга (указан стрелкой)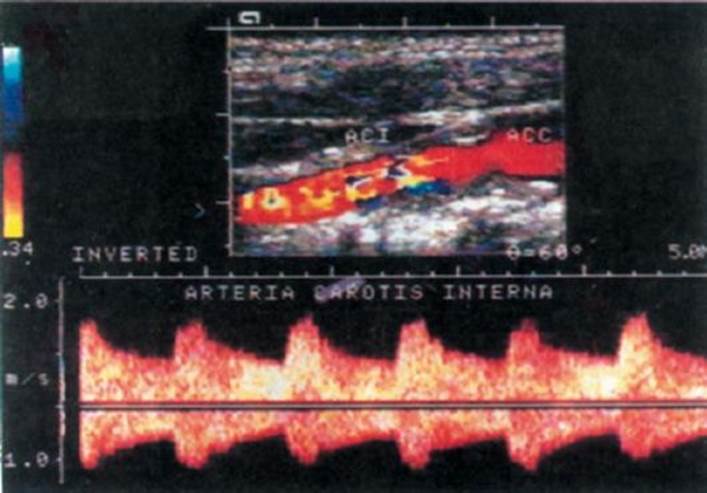 Рис. 10.3. Ультразвуковое изображение в режиме цветового дуплексного сканирования и спектр допплеровского сдвига частот внутренней сонной артерии. Атеросклеротический стеноз (75-90%)
Рис. 10.3. Ультразвуковое изображение в режиме цветового дуплексного сканирования и спектр допплеровского сдвига частот внутренней сонной артерии. Атеросклеротический стеноз (75-90%)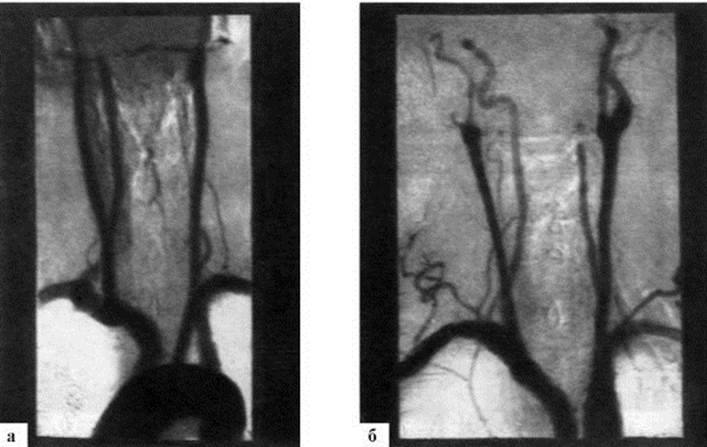 Рис. 10.4. Дигитальные субтракционные антиограммы магистральных сосудов головы.
Рис. 10.4. Дигитальные субтракционные антиограммы магистральных сосудов головы. Рис. 10.5. Агрегатограммы тромбоцитов в норме и при патологии. 1 - агрегатограмма здорового человека; 2 - повышение агрегации тромбоцитов при ишемическом инсульте; 3 - снижение агрегационной способности тромбоцитов; α - угол, характеризующий скорость тромботических агрегатов; β - угол, характеризующий скорость дезагрегации; t1 - время агрегации; t2 - время дезагрегации; короткой стрелкой показан момент введения агрегирующего агента (АДФ)
Рис. 10.5. Агрегатограммы тромбоцитов в норме и при патологии. 1 - агрегатограмма здорового человека; 2 - повышение агрегации тромбоцитов при ишемическом инсульте; 3 - снижение агрегационной способности тромбоцитов; α - угол, характеризующий скорость тромботических агрегатов; β - угол, характеризующий скорость дезагрегации; t1 - время агрегации; t2 - время дезагрегации; короткой стрелкой показан момент введения агрегирующего агента (АДФ)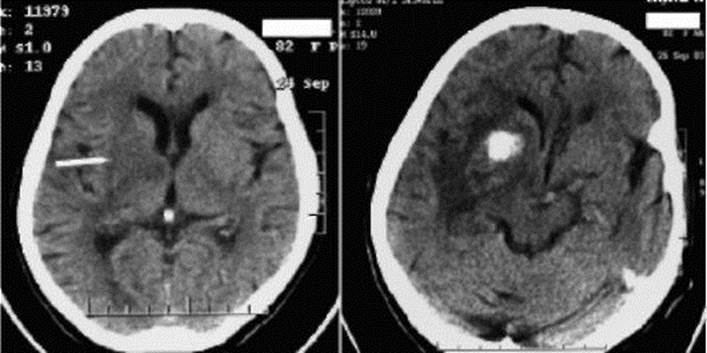 Рис. 10.6. Компьютерная томограмма головного мозга. Отсутствие обычного тканевого контраста между правым чечевицеобразным ядром и окружающим белым веществом мозга в первые часы ишемического инсульта (изображение слева, стрелка). Геморрагическая трансформация в участке инфаркта через 2 суток (изображение справа)
Рис. 10.6. Компьютерная томограмма головного мозга. Отсутствие обычного тканевого контраста между правым чечевицеобразным ядром и окружающим белым веществом мозга в первые часы ишемического инсульта (изображение слева, стрелка). Геморрагическая трансформация в участке инфаркта через 2 суток (изображение справа) Рис. 10.7. Компьютерные томограммы головного мозга. Острый инфаркт в правом полушарии большого мозга (в бассейне правой средней мозговой артерии). Цитотоксический отек, объемный эффект
Рис. 10.7. Компьютерные томограммы головного мозга. Острый инфаркт в правом полушарии большого мозга (в бассейне правой средней мозговой артерии). Цитотоксический отек, объемный эффект Рис. 10.8. Компьютерные томограммы головного мозга. Подострый инфаркт мозга до (слева) и после (справа) введения контрастного препарата (гиральный тип контрастного усиления)
Рис. 10.8. Компьютерные томограммы головного мозга. Подострый инфаркт мозга до (слева) и после (справа) введения контрастного препарата (гиральный тип контрастного усиления) Рис. 10.9. Магнитно-резонансные томограммы головного мозга. Острый инфаркт в правой лобной доле. Т2-взвешенные изображения с подавлением сигнала свободной воды (FLAIR). МРТ-исследования выполнены через 10 часов (А), 28 часов (В) и 72 часа (С) от начала инсульта
Рис. 10.9. Магнитно-резонансные томограммы головного мозга. Острый инфаркт в правой лобной доле. Т2-взвешенные изображения с подавлением сигнала свободной воды (FLAIR). МРТ-исследования выполнены через 10 часов (А), 28 часов (В) и 72 часа (С) от начала инсульта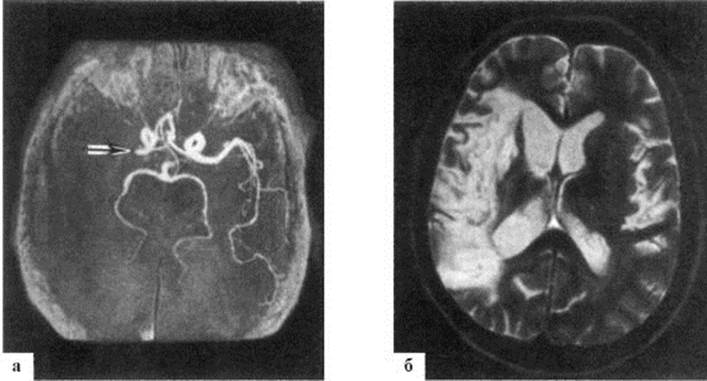 Рис. 10.10. Тромбоз правой средней мозговой артерии.
Рис. 10.10. Тромбоз правой средней мозговой артерии.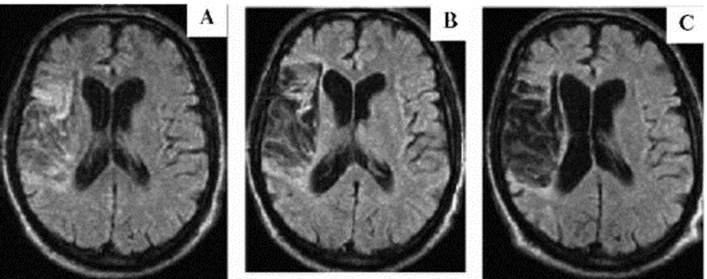 Рис. 10.11. Магнитно-резонансные томограммы головного мозга. Инфаркт в правом полушарии большого мозга (в бассейне правой средней мозговой артерии). Т2-взвешенные изображения с подавлением сигнала свободной воды (FLAIR). МРТ-исследования выполнены через 2 месяца (А), 6 месяцев (В) и 1 год (С) от развития инсульта
Рис. 10.11. Магнитно-резонансные томограммы головного мозга. Инфаркт в правом полушарии большого мозга (в бассейне правой средней мозговой артерии). Т2-взвешенные изображения с подавлением сигнала свободной воды (FLAIR). МРТ-исследования выполнены через 2 месяца (А), 6 месяцев (В) и 1 год (С) от развития инсульта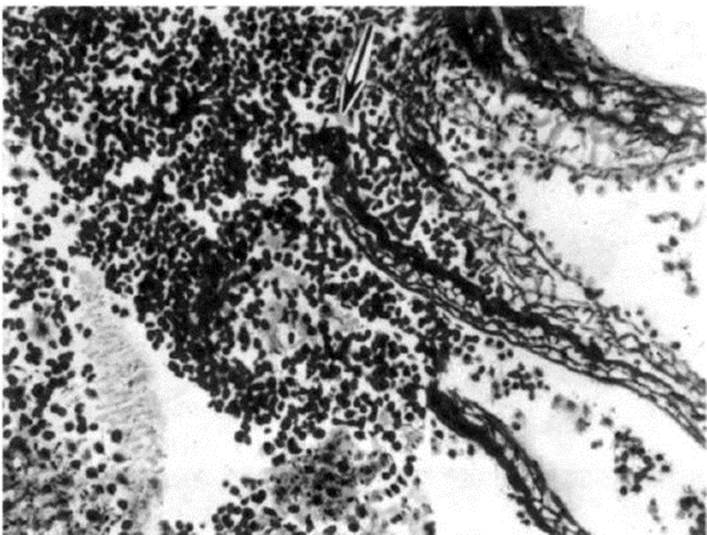 Рис. 10.12. Разрыв сосуда (указан стрелкой). Микропрепарат
Рис. 10.12. Разрыв сосуда (указан стрелкой). Микропрепарат Рис. 10.13. Фронтальный срез головного мозга на уровне таламуса. а - латеральное кровоизлияние в левое полушарие большого мозга; б - медиальное кровоизлияние в таламус; в - смешанное кровоизлияние в левое полушарие с прорывом крови в желудочки (стрелками указаны области кровоизлияния)
Рис. 10.13. Фронтальный срез головного мозга на уровне таламуса. а - латеральное кровоизлияние в левое полушарие большого мозга; б - медиальное кровоизлияние в таламус; в - смешанное кровоизлияние в левое полушарие с прорывом крови в желудочки (стрелками указаны области кровоизлияния) Рис. 10.14. Компьютерные томограммы головного мозга. Внутримозговое кровоизлияние в правое полушарие большого мозга с прорывом крови в желудочковую систему. Гемотампонада на уровне межжелудочковых отверстий - 3-го желудочка (наличие сгустка крови в переднем отделе 3-го желудочка), острая окклюзионная гидроцефалия боковых желудочков, феномены седиментации и горизонтального уровня жидкости в задних рогах боковых желудочков, выраженное поперечное смещение мозга влево
Рис. 10.14. Компьютерные томограммы головного мозга. Внутримозговое кровоизлияние в правое полушарие большого мозга с прорывом крови в желудочковую систему. Гемотампонада на уровне межжелудочковых отверстий - 3-го желудочка (наличие сгустка крови в переднем отделе 3-го желудочка), острая окклюзионная гидроцефалия боковых желудочков, феномены седиментации и горизонтального уровня жидкости в задних рогах боковых желудочков, выраженное поперечное смещение мозга влево Рис. 10.15. Компьютерные томограммы головного мозга. Внутримозговое кровоизлияние в правое полушарие большого мозга на 5-е (слева) и 13-е (справа) сутки инсульта. Феномен «тающего кусочка сахара», нарастание перифокального отека, поперечное смещение срединных структур влево
Рис. 10.15. Компьютерные томограммы головного мозга. Внутримозговое кровоизлияние в правое полушарие большого мозга на 5-е (слева) и 13-е (справа) сутки инсульта. Феномен «тающего кусочка сахара», нарастание перифокального отека, поперечное смещение срединных структур влево