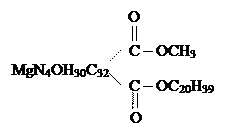|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Фотосинтетические пигменты
Выделяют три класса фотосинтетических пигментов: 1) хлорофиллы; 2) каротиноиды; 3) фикобилины. Пигменты входят в состав пигментых систем в виде хромопротеинов. Хлорофиллы и каротиноиды с белками связываются легкими гидрофобными связями, а фикобилины – ковалентными. Хлорофиллы и каротиноиды входят в пигментную систему высших растений, а хлорофиллы и фикобилины – в пигментную систему низших растений (в том числе и водорослей). Роль пигментов состоит в поглощении электромагнитного излучения, которое представляет собой поток фотонов с различной энергией. Энергия фотонов рассчитывается по формуле:
где Е – энергия фотона, эВ; h – постоянная Планка, 6,62 · 10-27; с – скорость света, 3 · 1010 см/сек; λ – длина волны, нм. Видимая часть спектра имеет длину волны 400 – 700 нм (380 – 720 нм). Энергии квантов этой части спектра достаточно для обратимого электронного возбуждения молекул. Разные пигменты поглощают разные части спектра. Это определили путем пропускания белого света через раствор пигментов с последующим его разложением. По тому, какая часть спектра выпадает после пропускания, делают вывод о том, что она поглотилась. Цвет пигмента зависит от того, какая часть спектра максимально отражается. Явление хроматической адаптации растений – это способность синтезировать различные пигменты в зависимости от условий дыхания. Это явление хорошо иллюстрируется на водорослях. Вода изменяет спектральный состав света, поглощая, в основном, длинные волны, в результате этого на разные глубины поступает свет разного спектрального состава. На поверхности обитают зеленые водоросли, которые синтезируют аллофикоцианины; глубже обитают сине-зеленые водоросли, которые синтезируют фикоцианины; еще глубже – красные водоросли, синтезирующие фикоэритрины. Пигменты – это органические молекулы, поэтому на них распространяется следующее правило: каждая стабильная органическая молекула содержит четное число электронов, которые попарно (с разными спинами) располагаются на низших энергетических уровнях – это основное синглетное состояние (S0). После пространственной встречи электрона с порцией света (hν), электрон поглощают энергию кванта света, становятся горячим и уже не может оставаться на низшей молекулярной орбитали, поэтому переходит на вакантную орбиталь. Такое состояние молекулы пигмента называется возбужденным синглетным состоянием (S*). Низшая орбиталь является связывающей орбиталью, а вакантная – разрыхляющей. Энергия кванта, способного вызывать такой переход, должна равняться разнице этих электронных уровней (молекулярных орбиталей). Время жизни молекулы в состоянии S* очень мало и измеряется пико- и наносекундами. Молекула старается вернуться в состояние S0 , для этого нужно высвободить запасенную энергию. Хлорофиллы Эмпирическая формула хлорофилла: MgN4O5H75C55. С химической точки зрения хлорофилл является сложным эфиром двух спиртов (метилового спирта и фитола) и дикарбоновой кислоты хлорофиллина:
Структурная формула хлорофилла была расшифрована в период с 1930 по 1940 гг. немецким ученым Фишером. Порфириновое ядро молекулы сформировано 4 пиррольными кольцами, которые соединены метиловыми мостиками. Каждое пиррольное кольцо имеет атом азота, который соединен с ионом магния. В составе молекулы есть пятое циклопентановое кольцо, считается, что оно повышает реакционную способность молекулы хлорофилла. Комплекс порфириного ядра и циклопентанового кольца называется форбином. Сопряженная система связей этой структуры образована чередованием одинарных и двойных связей и включает 18 π-электронов. Положение двойных связей не фиксировано, ввиду резонанса порфириновое ядро можно изобразить несколькими способами. Заряд иона магния +2 компенсируется двумя избыточными электронами атомов азота и распределяется по 4 атомам азота. На самых ранних этапах возникновения фотосинтеза хлорофилл был рассчитан на синюю часть спектра, но эта часть спектра преобладает только в определенные часы дня. Красная же часть спектра в составе белого света присутствует весь освещенный период и ее энергии хватает для запуска фотосинтеза. Хлорофилл способен поглощать энергию квантов света и при этом возбуждаться. Возбужденное состояние является короткоживущим. Для возвращения электронов на более низшую орбиталь используется энергия возбужденного хлорофилла.
Под миграцией энергии понимают то, что одна молекула пигмента может возбудить другие. Этот путь используется в работе светособирающего комплекса. В результате отрыва электрона от молекулы хлорофилла образуется фотоокисленный продукт (окисленный хлорофилл) и фотовосстановленный продукт, который принял электрон от хлорофилла. В таких преобразованиях суть фотохимической работы. Исходя из продолжительного времени нахождения хлорофилла в триплетном состоянии (Т*), его считают запускающим фотосинтез. Однако это достаточно редкое состояние и хлорофилл, испустивший электрон в триплетном состоянии, не восстанавливается. Триплетное состояние хлорофилла гасится, его могут брать на себя каротиноиды. Работающим является первое возбужденное синглетное состояние (S1*). Благодаря своим свойствам молекула хлорофилла способна выполнять следующие функции: 1) избирательно поглощать часть света; 2) запасать поглощенный свет в виде энергии возбужденных электронов; 3) фотохимически преобразовывать энергию возбужденного состояния электронов в химическую энергию первичных фотоокисленных и фотовосстановленных соединений. Роль фитольного хвоста хлорофилла состоит в заякоривании молекулы в тилакоидной мембране через образование связей с мембранными белками. Порфириновое ядро при таком фиксировании молекулы может менять свое положение с целью поглощения максимального количества квантов света. Для процесса биосинтеза хлорофилла необходимы: 1) свет; 2) аминокислоты: глютаминовая кислота и аланин; 3) ацетилкофермент-А (источник фитола); 4) возможно также нужны α-кетоглутаровая кислота и глицин. Известно 5 разных типов хлорофиллов: a, b, c1, c2, d. Структура порфиринового ядра у всех хлорофиллов одинакова, у хлорофиллов с отсутствует фитольный хвост. Хлорофилл а имеется у всех фотосинтезирующих организмов, у высших растений его концентрация наибольшая. Только хлорофилл а способен запускать фотохимическую работу, что было доказано в 40-х гг. ХХ в. ученым Красновским. Хлорофилл b есть у наземных растений, а также у хлорококковых и эвгленовых водорослей. Хлорофиллы c1 и c2 – у бурых, золотистых, диатомовых водорослей; у криптофитовых водорослей обнаружен только хлорофилл c2. Хлорофилл d есть у красных водорослей. Каротиноиды С химической точки зрения каротиноиды представляют собой полиеновые углеводороды. Они содержат 40 атомов углерода и обладают сопряженной системой связей. Каротиноиды делят на две группы: 1) каротины (чистые ненасыщенные углеводороды с общей формулой С40Н56); 2) ксантофиллы (содержат атомы кислорода в количестве 2 или 4). Каротиноиды входят в пигментную систему и поглощают ту часть спектра, которая не поглощается хлорофиллами. Основная же функция каротиноидов – протекторная (защитная). Хлорофилл, находящийся в триплетном состоянии, подвергается необратимому окислению синглетным кислородом, каротиноиды способны принять на себя энергию триплетного состояния хлорофилла по следующей схеме: Хлорофилл* + КаротиноидS0 → ХлорофиллS0 + КаротиноидТ*;
КаротиноидТ* → КаротиноидS0 + теплота Дата добавления: 2015-12-15 | Просмотры: 1448 | Нарушение авторских прав |
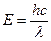 ,
,