 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Фотофосфорилирование (механизм образования АТФ)Перенос электронов по ЭТЦ сопровождается изменением энергии. Выделяемая электроном энергия не пропадает, часть ее используется для работы специального энергопреобразующего комплекса – АТФ-синтазы. Энергодонорные процессы, происходящие с участием ЭТЦ, сопряжены с энергорецепторными процессами синтеза АТФ. Посредником между энергией, выделяемой электронами, и реакцией, в ходе которой часть этой энергии запасается в макроэргической связи молекулы АТФ, является протонный градиент. То есть работа ЭТЦ создает протонный градиент по разные стороны тилакоидной мембраны. Этот градиент является источником энергии для реакции фосфорилирования. Причины создания протонного градиента: 1) Локализация переносчиков в тилакоидной мембране. 2) Состыковка атомных и электронных переносчиков. а)Пластохиноны, являясь атомными переносчиками, получив электроны от первичного акцептора (Фф), становятся соединениями с высоким сродством к протонам. Пластохиноны присоединяют протоны, взятые из стромы, этому способствует локализация пластохинонов. Цитохромы снимают с восстановленных пластохинонов только электроны, протоны при этом высвобождаются в тилакоидное пространство. б) Водорасщепляющий комплекс продуцирует протоны, которые также остаются в тилакоидном пространстве. в) Оксидоредуктаза, которая восстанавливает НАДФ+, получает электроны от ферредоксина, а протоны – из стромы. При этом не происходит перенос электронов в тилакоидное пространство. В 1967 году Ягендорф в ходе ряда экспериментов показал, что хлоропласты способны синтезировать АТФ при создании искусственного протонного градиента. Он инкубировал изолированные хлоропласты в кислой среде (рН = 4) в течение нескольких часов. За это время раствор медленно проникал во все компартменты. Затем он переносил хлоропласты в щелочную среду (рН = 8), содержащую АДФ и Фн. В результате такого переноса рН стромы хлоропластов увеличивался до 8, а внутри тилакоидов в течение некоторого времени рН оставался равным 4, при этом в инкубационной среде регистрировалось увеличение концентрации АТФ. Данный эксперимент является сильным аргументом в пользу хемиосмотической теории Митчелла, в соответствии с которой синтез АТФ сопряжен с протонным градиентом, за счет которого работает АТФ-синтазный комплекс. Таким образом, был сделан вывод, что механизм синтеза АТФ в хлоропластах сходен с таковым в митохондриях. Структура ферментативных комплексов, обеспечивающих синтез АТФ в хлоропластах и митохондриях также очень похожа. Части АТФ-синтазы хлоропластов называются CF1 и CF0 (в митохондриях – F1 и F0 соответственно). Тилакоидная мембрана, как и внутренняя мембрана митохондрий, непроницаема для протонов, доказательством этого является то, что реактивы, которые способны стимулировать проницаемость Н+ через мембрану, снижают активность АТФ-синтазного комплекса. При фотофосфорилировании тилакоидное пространство протонируется, а строма – депротонируется; в митохондриях протонируется межмембранное пространство, а матрикс – депротонируется. АТФ-синтаза хлоропластов расположена так, что ее часть CF1 обращена в строму, а в митохондриях часть F1 обращена в межмембранное пространство. По каналам АТФ-синтазного комплекса текут протоны. Этот ток является движущей силой для работы катализирующей части (CF1) АТФ-синтазы. В результате протонирования некоторых белков происходят их конформационные изменения, в результате которых сближаются АДФ и Фн (в протонированной среде снимается электростатическое отталкивание между одноименными группировками ОН-). 3.4. Темновая фаза фотосинтеза Темновая фаза фотосинтеза представлена серией ферментативных реакций, в ходе которых благодаря продуктам световой фазы происходит восстановление углерода из углекислого газа. Существуют разные пути восстановления углерода в темновой фазе: 1) С3-путь; 2) фотодыхание (С2-путь); 3) С4-путь; 4) САМ-метаболизм. 3.4.1. С3-путь фотосинтеза (цикл Кальвина) Это основной путь ассимиляции углекислого газа растениями. Работы по изучению этого пути проводились в период с 1946 по 1953 гг. в лаборатории под руководством М. Кальвина при помощи метода меченых атомов. При этом метили углеродный атом углекислого газа (*СО2), а затем следили, в состав каких соединений он включается, эксперименты проводили на хлорелле. Через каждые 5 секунд из экспериментальной среды, содержащей *СО2, брали пробу. Полученные из каждой пробы соединения разделяли с помощью метода хроматографии и идентифицировали соединения, в которые была включена метка. Оказалось, что первым стойким соединением, в составе которого была обнаружена метка, является трехуглеродным (С3). Тогда предположили, что углекислый газ присоединяется к какому-то двухуглеродному соединению (С2), в результате чего и получается обнаруженное соединение с тремя углеродными атомами. В инкубационную среду стали вводить различные соединения с двумя атомами углерода, однако это не приводило к увеличению концентрации С3-соединения. На основании этого был сделан вывод, что акцептором СО2 является не двухуглеродное, а какое-то другое соединение. Поиски акцептора СО2 увенчались успехом после изменения схемы эксперимента. Хлореллу стали инкубировать в атмосфере с высокой концентрацией СО2 ≈ 1%, а затем перенесли в атмосферу с концентрацией СО2 ≈ 0,01%. Предположили, что при таких условиях, должен накопиться искомый акцептор. Действительно, в условиях дефицита СО2 в экспериментальной среде накопился рибулозодифосфат (РДФ). В связи с этим была предложена следующая схема первичной фиксации углекислого газа:
Для проверки этой схемы в инкубационную среду ввели РДФ с меченным атомом фосфора, эта метка была обнаружена в составе С3-соединения, следовательно, акцептором углекислого газа является С5-соединение. Промежуточное шестиуглероднное соединение до сих пор не обнаружено, поэтому его считают неустойчивым. Схема первичной фиксации СО2:
С3-путь фотосинтеза протекает в циклическом режиме и называется циклом Кальвина. Цикл Кальвина состоит из четырех этапов: 1) карбоксилирование; 2) восстановление; 3) синтез конечных продуктов; 4) регенерация первичного акцептора. Карбоксилирование:
Восстановление:
Часть альдотриоз (1 молекула ФГА) идет на синтез конечных продуктов (гексоз, ди- и полисахаридов), а другая часть (5 молекул ФГА) – на восстановление первичного акцептора. Синтез конечных продуктов:
Образовавшийся фруктозо-1,6-дифосфат далее подвергается превращениям по следующей схеме:
Три последних гексозы служат мономерами для образования различных сахаров. В цитоплазме с помощью сахарозосинтазы из глюкозы и фруктозы образуется сахароза. По сосудам флоэмы синтезированная сахароза направляется в гетеротрофные органы растения, где под воздействием фермента инвертазы происходит гидролиз сахарозы. Глюкоза и фруктоза, образовавшиеся в результате гидролиза сахарозы, могут использоваться в качестве субстратов дыхания или в качестве мономеров для синтеза полисахаридов. Для этого моносахариды предварительно фосфорилируются, взаимодействуя с разными нуклеотидтрифосфатами. Так например для синтеза целлюлозы используются моносахариды, активированные с помощью УТФ, а для синтеза крахмала источником фосфорных группировок является АТФ. Регенерация первичного акцептора (схематично):
Общее уравнение темновой фазы фотосинтеза (цикл Кальвина):
6СО2 + 6Н2О + 18АТФ + 12 НАДФН2 → С6Н12О6 + 18АДФ + 12 НАДФ+ + 18Фн 3.4.2. Фотодыхание (С2-путь фотосинтеза) Фотодыхание – это активизированный светом процесс поглощения растениями О2 и выделения растениями СО2. Причина этого процесса связана с двойственной природой фермента, который катализирует присоединение СО2 к РДФ. Этот фермент сначала всегда присоединяет РДФ, к которому затем присоединяет углекислый газ или же кислород. Сродство фермента к СО2 выше, чем к О2, поэтому обычно фермент ведет себя как карбоксилаза. Но когда концентрация СО2 ниже, чем концентрация О2, фермент проявляет свою оксигеназную природу, присоединяя кислород. Это приводит к тому, что РДФ распадается на ФГК (С3) и двухуглерохный продукт (С2). Фотодыхание связано с функционированием нескольких органелл, начинается этот процесс в хлоропластах, а продолжается в пероксисомах и митохондриях. С2-путь фотосинтеза может быть линейным (в результате образуются глицин и серин) или циклическим (происходит образование еще одной молекулы ФГК). В экстремальных условиях (повышенная температура, водный дефицит) происходит закрытие устьиц, при этом световая фаза фотосинтеза происходит, а темновая не возможна, при этом фотодыхание идет циклическим путем. При этом, по сути, происходит цикла Кальвина, но без этапа карбоксилирования и без регенерации конечного акцептора. При таком пути происходит потеря органического вещества. Необходимость этого процесса связана с утилизацией продуктов световой фазы фотосинтеза, накопление которых может привести к деструкции фотосинтетического аппарата.
Химизм фотодыхания
Пероксисомы:
Митохондрии
Серин, образующийся в митохондриях, диффундирует в пероксисомы, где подвергается окислительному дезаминированию с образованием гидроксипирувата. Гидроксипируват восстанавливается с помощью НАД-зависимой дегидрогеназы до глицериновой кислоты, которая диффундирует в хлоропласты. В хлоропластах из глицерата образуется ФГК, участвующая в цикле Кальвина.
Интенсивность фотосинтеза за счет фотодыхания снижается на 30%. Пути снижения интенсивности фотодыхания: 1) Получение мутантов, лишенных фотодыхания. Но они не жизнеспособны при обычных концентрациях кислорода в атмосфере. 2) Использование веществ, тормозящих фотодыхание (глицидовая кислота). Но растения, подверженные воздействию таких веществ, имеют низкую продуктивность и не переходят к генеративной фазе развития. 3) Поиск растений, имеющих пониженное фотодыхание (С4-растения). 4) Был получен материал, у которого роль фотодыхания усиливается тогда, когда образовывается большое количество углеводных продуктов и транспортные системы растения не справляются с их потоком. В таких условиях фотодыхание, идущее линейным путем, приводит к окислению избытка сахаров с образованием аминокислот, идущих на белковый синтез. При этом концентрация углеводов падает, транспортные системы освобождаются, и в результате этого возрастает скорость фотосинтеза. Фотодыхание активируется тогда, когда растение обеспечено азотом. Фотодыхание является неотъемлемой частью регенерационных процессов и нельзя говорить о негативности этого процесса. 3.4.3. С4-путь фотосинтеза (цикл Хэтча-Слэка) Интенсивность фотосинтеза у С4-растений в 2 – 3 раза больше, чем у С3-растений; потеря на фотодыхание составляет 5 – 7%. Открытие С4-пути фотосинтеза связано с именем русской ученой Незговоровой (1955 г.), исследовали этот путь австрийские биохимики Хэтч и Слэк. С4-растения обнаружены среди 16 семейств покрытосеменных растений: злаки – из однодольных, а остальные 15 семейств относятся к классу двудольных. К наиболее важным сельскохозяйственным С4-растениям относятся кукуруза, сахарный тростник, сорго. С4-растения отличаются анатомическим строением листа. Вокруг проводящего пучка у таких растений имеются крупные плотно упакованные клетки – клетки обкладки, вокруг которых расположены более мелкие и рыхло упакованные клетки мезофилла листа. Эти два типа клеток осуществляют С4-путь фотосинтеза. Клетки обкладки и клетки мезофилла отличаются структурой хлоропластов. В клетках мезофилла хлоропласты обычного гранального типа, в клетках обкладки хлоропласты агранального типа (тилакоиды расположены отдельно друг от друга и не образуют граны). В связи с различиями строения хлоропластов возникают и различия в локализации компонентов ФСI и ФСII в мембранах тилакоидов. Компоненты ФСII располагаются в мембранах, контактирующих друг с другом; а компоненты ФСI располагаются как в состыкованных, так и не в состыкованных мембранах. Поэтому в мембранах тилакоидов хлоропластов агранального типа в большинстве случаев локализована ФСI, а в мембранах тилакоидов обычных хлоропластов – обе фотосистемы. В клетках обкладки возникает циклический транспорт электронов, который вызывает образование в световой фазе только АТФ; НАДФ+ при этом не восстанавливается. В хлоропластах клеток обкладки высока активность РДФ-карбоксилазы, а в клетках мезофилла обнаружен другой акцептор углекислого газа – ФЕП-карбоксилаза. С4-путь начинается в цитоплазме клеток мезофилла, в которых ФЕП-карбоксилаза акцептирует ион НСО3-, в результате этого образуется ЩУК, которая поступает в хлоропласты. В хлоропластах ЩУК с помощью НАДФН2 восстанавливается до яблочной кислоты, которая диффундирует в клетки обкладки и подвергается в них окислительному декарбоксилированию. Образовавшаяся при этом углекислота включается в цикл Кальвина посредством РДФ-карбоксилазы. Цитоплазма клеток мезофилла:
Хлоропласты клеток мезофилла:
В цикле Хэтча-Слэка расходуется 18 НАДФН2 и 30 АТФ. У С4-растений РУБИСКО проявляет только карбоксилазную природу, фотодыхание подавлено. Клетки обкладки плотно упакованы, между ними почти нет межклетников, они не контактируют с внешней средой. Пространственная организация листа способствует оттоку ассимилятов в сосуды проводящей системы. Дата добавления: 2015-12-15 | Просмотры: 1540 | Нарушение авторских прав |

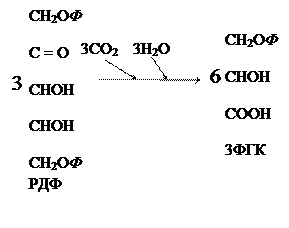

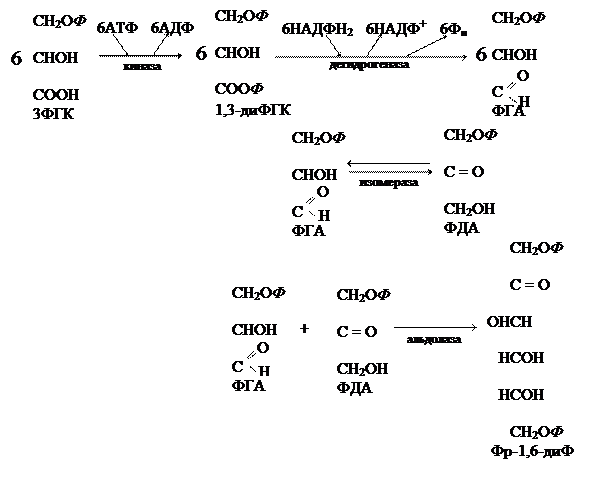




 Хлоропласты:
Хлоропласты: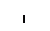

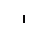
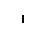
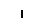

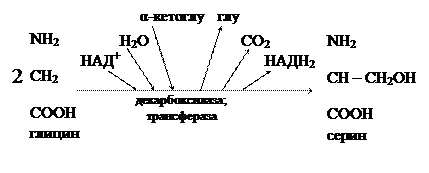 В митохондриях из двух молекул глицина образуется одна молекула серина, при этом выделяется углекислый газ. Аминогруппа первой молекулы глицина перебрасывается на какую-то кетокислоту, а α-углеродный атом молекулы глицина временно присоединяется к тетрагидрофолиевой кислоте, затем с участием молекулы Н2О эта связь разрывается:
В митохондриях из двух молекул глицина образуется одна молекула серина, при этом выделяется углекислый газ. Аминогруппа первой молекулы глицина перебрасывается на какую-то кетокислоту, а α-углеродный атом молекулы глицина временно присоединяется к тетрагидрофолиевой кислоте, затем с участием молекулы Н2О эта связь разрывается:
 Пероксисомы:
Пероксисомы:
 Хлоропласты:
Хлоропласты:


 Клетки обкладки:
Клетки обкладки: