|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Залізодефіцитні анемії у дітей: причини і механізми розвитку, типові зміни периферичної крові, патогенез основних клінічних проявів. Залізорефрактерні анемії. 3 страница6. Лейкозний пневмоніт. Лейкозні проліферати порушують дихальну функцію легень - розвивається недостатність зовнішнього дихання. 7. Серцева недостатність. Може бути наслідком розмноження лейкозних клітин у м'язі серця. 105. Порушення клітинного складу кісткового мозку і периферичної крові при гострих і хронічних лейкозах. Патогенез лейкозів: прогресія, метастазування, системні порушення. Принципи діагностики і терапії лейкозів. див вище Лейкоз - це системне захворювання крові пухлинної природи, з обовязковим первинним враженнями кісткового мозку, що характерезується гуперплазією, метаплазією, та анаплазією кровотворно тканини. Геперплазія - це розростання мієлоідного чи лімфоїдногоростка у кістковому мозку Метаплазія - це заміщення одного ростка іншим у кістковому мозку Анаплазія - це порушення дозрівання клітин. Етіологія - фізичні канцерогени (іонізуюче випромінювання) - хімічні канцерогени (бензол, цитостатики, бутадіон) - дія біологічних канцерогенів (онкогенні віруси, вірус Епштейна Бара) - спадкова схильність (хромосомні аномалії) Патогенез:є 2 стадії 1) Моноклонова - проліферація 2) Поліклонова - злоякісна, термінальна - феномен пухлинної прогресії. Ознаки пухлинної прогресії: 1) пригнічення норм ростків кровотворення 2) заміщення диференційованих клітин бластними (незрілими) 3) втрата ферментної специфічності клітинами крові 4) утворення екстрамедулярнрх вогних кровоутворення (метастазування) 5) вислизання пухлинного процесу з під контролю цитостатиків: перехід від мононклонованості до поліклонованості 6) поява і прогресування клітинного атипізму 7) перехід від алейкемічної форми до лейкемічної Класифікація лейкозів за морф картиною крові: Гострі.хронічні Класифікація лейкозів за морф субстратом мієлоїдний лімфоїдний моноцитарний еритроцитарний Класифікація лейкозів за кількістю лейкоцитів у переферичній крові: лейкемічні форма - більше 50 сублейкемічні форма - 15-50 алейкемічна форма - 4-15 лейкопенічна - менше 4
Гострий лейкоз Основні оЗнаки: -виникає у дітей і молодих людей -характерезується ураженням клтіин 2,3,4 класів які втратили здатність до диференціації Гемограма: -кількість бластів більше 30% -лейкемічний провал - відсутність у крові дозріваючих клітин 5го класу -анемія -тромбоцитопенія Хронічний мієлолейкоз Ознаки: -у дорослих осіб старше 30 років -характерезується ураженням клітин 4,5,6 класів які зберегли здатність до диференцціації -маркером хронічмієлолекозу є Філадельфійська хромоосма - це делеція половини довгого плеча 22 хромосоми і транслокація його на 9 ту хромосому Гемограма: -в лейкоцитарнній формулі клітини 4 класу мієлобластів не більше 5% -велика кількість клітин 5 класу -невелика кількість клітин 6го класу -еозинофільно-базофільна асоціація -анемія -тромбоцитопенія -відсутність моноцитів і лімфоцитів Хронічний лімфолейкоз Ознаки -старше 30 років - -характерезується ураженням клітин 4,5,6 класів які зберегли здатність до диференцціації Гемограма: лімфобластів до 5% дозріваючих клітин 5 класу (пролімфоцитів) - небагато багато зрілих клітин 6 класу (малих лімфоцитів) - 80-90% тіні Боткіна-Гумпрехта
Основні клінічні прояви лейкозів: 1) геморагічний синдром - виникає при чищенні зубів Виникає внаслідок: тромбоцитопеніі (пригнічення мегакаріоцитарногоросткалейкозними клітинами) ураження судин лейкозними інфільтратами зниження згортання крові 2) тяжкі інфекційно-токсичні процеси, некротичні ураження органів ітканин внаслідок імунної недостатності 3) Порушення функцій органів і систем внаслідок метастазування 106. Порушення судинно-тромбоцитарного гемостазу. Етіологія і патогенез вазопатій, тромбоцитопеній, тромбоцитопатій.
Система гемостазу — це система, що забезпечує, з одного боку, збереження рідкого стану крові, з другого - зупинку кровотечі при ушкодженні кровоносних судин. Існує два механізми гемостазу: судинно-тромбоцитарний і коагуляційний. Судинно-тромбоцитарний (первинний, мікроциркуляторний) гемостаз забезпечує зупинку кровотечі з судин мікроциркуляторного русла, що мають діаметр до 100 мкм. Він обумовлений взаємодією судинної стінки з тромбоцитами. Унаслідок активації судинно-тромбоцитарного гемостазу утворюється білий тромбоцитарний тромб. Порушення цього механізму гемостазу є причиною майже 80 % кровотеч і 95 % випадків тромбоутворення.
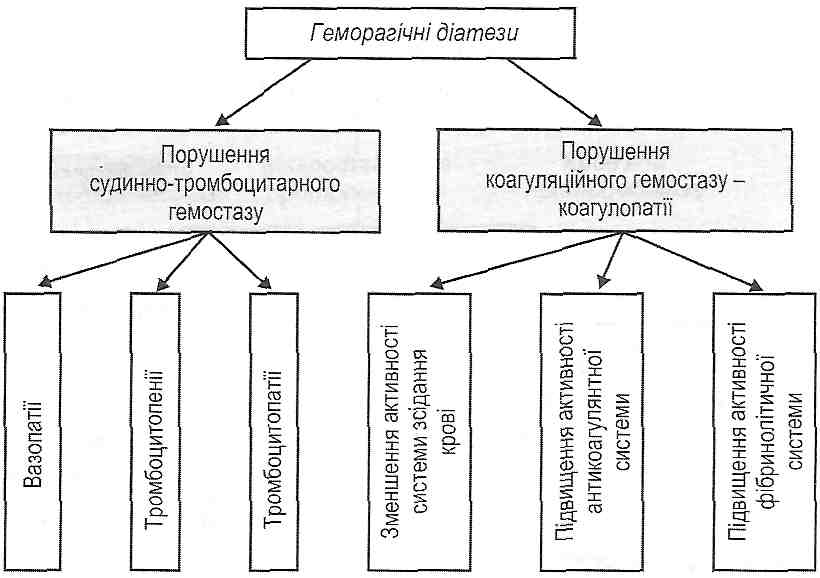
26.3.11. Що таке геморагічні діатези? Як їх класифікують? Геморагічний діатез — це схильність організму до повторних кровотеч і крововиливів, що виникають спонтанно або після незначних травм. Геморагічні діатези поділяють на дві великі групи (рис. 118).
Рис. 118. Класифікація геморагічних діатезів I. Порушення судинно-тромбоцитарного гемостазу: а) вазопатії) б) тромбоцитопенії; в) тромбоцитопатії. II. Порушення коагуляційного гемостазу - коагулопатії. 26.3.12. Що таке вазопатії? Як їх класифікують? Вазопатії—ц& спадково обумовлені або набуті геморагічні діатези, що виникають як наслідок первинних порушень судинної стінки. Залежно від механізму розвитку вазопатії поділяють на дві групи: 1) запальні вазопатії— васкуліти; 2) диспластичні вазопатії— ураження судин, пов'язані з порушеннями їхньої сполучної тканини (неповноцінність судинної стінки). 26.3.13. Які етіологія і патогенез запальних вазопатій? Залежно від причин виникнення запальні вазопатії поділяють на: 1) інфекційні васкуліти. Є проявом цілого ряду інфекційних захворювань (вірусних геморагічних гарячок, висипного тифу, сепсису); 2) імунні васкуліти. Розвиваються як наслідок імунокомплексних захворювань (алергічних реакцій III типу за класифікацією Кумбса і Джелла), наприклад, при системному червоному вовчаку, вузликовому періартеріїті, геморагічному васкуліті (хвороба Шенляйн-Геноха); 3) інфекційно-імунні васкуліти. Поєднують обидва попередніх механізми. У патогенезі запальних вазопатій провідна роль належить ушкодженню ендотелію, що може бути обумовлено: а) цитопатичною дією ендотеліотропних вірусів; б) токсинами мікробів, наприклад веротоксином, що його виділяють бактерії кишкової групи; * в) комплексами антиген-антитіло і комплементом. Наслідком ушкодження ендотелію судин є: 1) діапедез еритроцитів, що клінічно виявляється точковими крововиливами (пете-хіями); 2) інтенсивне мікротромбоутворення, що викликає порушення мікроциркуляції і живлення тканин; 3) тромбоцитопенія споживання (результат утворення мікротромбів). 26.3.14. Які етіологія і патогенез диспластичних вазопатій? В основі диспластичних вазопатій лежать набуті або спадково обумовлені порушення сполучної тканини стінки кровоносних судин. Прикладами таких порушень є: 1. Гіповітаміноз С. Аскорбінова кислота— необхідний компонент реакції гідро-ксилювання проліну, унаслідок якої він перетворюється в оксипролін. Ця реакція вважається однією з ключових в утворенні колагену. При гіповітамінозі С з урахуванням сказаного порушується утворення повноцінного колагену (ламкість судин, випадання зубів і т. д.). 2. Телеангіектазії. Це спадково обумовлені локальні дефекти сполучної тканини судин, що обумовлюють стоншення їх стінок і розширення просвіту. Телеангіектазії є джерелом небезпечних для життя кровотеч, особливо при локалізації у внутрішніх органах. 3. Гемангіоми. Це судинні пухлини, які часто кровоточать. 4. Синдром Елерса-Данло. Його основу складають генетично обумовлені дефекти ] колагену. У патогенезі диспластичних вазопатій мають значення: 1) стоншення стінок мікросудин і розширення їхнього просвіту; 2) неповноцінний локальний гемостаз. Через недостатню кількість або неповноцінність колагену в субендотелії судин порушується адгезія тромбоцитів; 3) легка ранимість судин. 26.3.15. Що таке тромбоцитопенія? Які механізми можуть лежати в основі розвитку тромбоцитопенії? Тромбоцитопенія — це зменшення вмісту тромбоцитів в одиниці об'єму периферичної крові нижче 150 109/л. На думку багатьох авторів, геморагічні прояви тромбоцитопенії з'являються при зменшенні кількості тромбоцитів нижче 50 109/л. За походженням тромбоцитопенії можуть бути спадково обумовленими і набутими. За механізмом розвитку виділяють такі види тромбоцитопенії. І. Тромбоцитопенії, пов'язані з порушеннями утворення тромбоцитів: а) мієлотоксичні тромбоцитопенії— виникають унаслідок ушкодження кровотворних клітин. Дуже часто поєднуються з анемією й лейкопенією. Причинами їх розвитку є ті самі фактори, які викликають розвиток гіпопластич-ної анемії; б) дефіцитні тромбоцитопенії— обумовлені недостатністю вітаміну В12 або фолієвої кислоти; в) дисрегуляторні тромбоцитопенії— пов'язані з порушенням утворення тромбоцитопоетинів — речовин, що стимулюють утворення тромбоцитів; г) тромбоцитопенії, пов'язані зі зменшенням плацдарму кровотворення, — розвиваються при лейкозах і метастазах злоякісних пухлин. її. Тромбоцитопенії, пов'язані з посиленим руйнуванням тромбоцитів. Причиною такого руйнування можуть бути: а) імунне ушкодження, обумовлене антитромбоцитарними антитілами на власні компоненти кров'яних пластинок або на лікарські препарати, адсорбовані на тромбоцитах. Аутоімунне ушкодження вважають найбільш імовірним механізмом розвитку так званої ідіопатичноїтромбоцитопенічноїпурпури (хвороби Верльгофа); б) ггперспленізм — гіперфункція селезінки, що супроводжується часто спле-номегалією. У результаті підвищення фагоцитарної активності макрофагів відбувається інтенсивне руйнування всіх формених елементів крові, у тому числі й тромбоцитів; в) механічне ушкодження тромбоцитів. Часто виникає при гемангіомах і накладенні штучних клапанів серця; г) набутімембранопатії (гемолітична анемія Маркіафави—Мікеллі). Соматичні мутації кровотворних клітин спричиняються до утворення пулів клітин (еритроцитів, гранулоцитів, тромбоцитів) з дефектами мембрани. У результаті збільшується чутливість таких клітин до дії комплементу й відбувається їх руйнування. III. Тромбоцитопенії споживання. Виникають у результаті посиленого використання тромбоцитів на утворення тромбів (хвороба Шенляйн—Геноха, хвороба Мошковича, ДВЗ-синдром). 26.3.16. Який патогенез порушень гемостазу в умовах тромбоцитопенії? У патогенезі геморагічного синдрому при тромбоцитопеніях мають значення: 1) порушення ангіотрофічної функції тромбоцитів, у результаті чого виникають дистрофічні зміни в ендотелії і збільшується ламкість мікросудин. Це веде до збільшення ранимості судин, діапедезу еритроцитів, крововиливів. Останні виявляють себе петехіями на шкірі, кровотечами з ясен і носа, крововиливами в головний мозок і сітківку ока; 2) порушення адгезії й агрегації тромбоцитів. Це викликає порушення формування тромбоцитарного тромбу й призводить до збільшення часу кровотечі (проба Дюка); 3) порушення вторинного спазму ушкоджених артеріол. При тромбоцитопеніях вивільняється мало біогенних амінів (катехоламінів, серотоніну), з дією яких пов'язане скорочення гладких м'язів судин; 4) порушення зсідання крові. Обумовлено недостатнім вивільненням фактора 3 пластинок і тромбостеніну. У результаті порушується І фаза зсідання крові і ретракція згустку. 26.3.17. Що таке тромбоцитопатії? Як їх класифікують? Тромбоцитопатії— це порушення функціональних властивостей тромбоцитів, йґ якісна неповноцінність. При цьому кількість тромбоцитів може залишатися в нормі За походженням тромбоцитопатії бувають спадково обумовленими і набутими. За характером якісних дефектів кров'яних пластинок тромбоцитопатії поділяють на ендо- і екзотромбоцитарні. Ендотромбоцитарні тромбоцитопатії обумовлені порушеннями складових частин тромбоцитів. їх, у свою чергу, поділяють на мембранопатії, гранулопатії і фер-ментопатії. Мембранопатії виникають при спадкових аномаліях мембранних пгіко-протеїнів, що виконують функції клітинних рецепторів; при блокаді цих рецепторів аномальними білками плазми крові (парапротеїнами), при ушкодженні мембрани кров'яних пластинок патогенними факторами. Гранулопатії виявляються дефіцитом гранул І і II типів. В основі ферментопатії може лежати зменшення активності ферментів циклу Кребса, гліколізу, порушення функцій АТФ-аз, циклоксигенази і тром-боксансинтетази. При екзотромбоцитарних тромбоцитопатіях причини порушення функцій тромбоцитів лежать поза кров'яними пластинками. У зв'язку з цим екзотромбоцитарні тромбоцитопатії можуть бути: а) пов'язаними зі змінами плазми крові (дефіцит плазмових білків, що є плазмовими кофакторами агрегації тромбоцитів); б) пов'язаними зі змінами в судинній стінці (порушення утворення фактора Вілле-бранда ендотелієм судин, розлади зовнішнього механізму зсідання крові). Залежно від сутності порушень гемостазу виділяють: 1) тромбоцитопатії з первинним порушенням адгезії тромбоцитів^ 2) тромбоцитопатії з первинними порушеннями агрегації тромбоцитів; 3) тромбоцитопатії з первинним порушенням реакцій вивільнення вмісту тромбоцитів', 4) тромбоцитопатії, пов'язані з дефіцитом або зменшенням доступності фактора З тромбоцитів. 26.3.18. Наведіть приклади тромбоцитопатій з різними механізмами порушень гемостазу. 1. Тромбоцитопатії з первинним порушенням адгезії тромбоцитів: а) хвороба Віллебранда — ангіогемофілія. Обумовлена генетичними порушеннями синтезу фактора Віллебранда ендотеліальними клітинами (тип спадкування аутосомно-домінантний); б) хвороба Бернара—Сульє — макротромбоцитодистрофія. Причиною є спадково обумовлений дефект глікопротеїнів тромбоцитарної мембрани (ГШЬ), що взаємодіють з фактором Віллебранда. При цьому тромбоцити набувають гігантських розмірів. Тип спадкування аутосомно-рецесивний. 2. Тромбоцитопатії з первинними порушеннями агрегації тромбоцитів - диза-грегаційні. Найчастіше буває тромбастенія Гланцмана, що виникає як наслідок дефектів мембранних глікопротеїнів І і II типів, що беруть участь в агрегації. При цьому адгезія тромбоцитів і вивільнення їхніх гранул відбуваються, а агрегація -ні, незважаючи на дію таких потужних агрегантів, як АДФ, адреналін, тромбін. Тип спадкування аутосомно-рецесивний. 3. Тромбоцитопатії з первинним порушенням реакцій вивільнення вмісту тромбоцитів: а) порушення дегрануляції тромбоцитів — "парез реакції вивільнення ". Виникає, зокрема, при порушенні утворення тромбоксану А2 при дії ацетилсаліцилової кислоти. Показано, одо одноразове приймання аспірину необоротно збільшує час вивільнення гранул від 3,5 до 6 діб, поки не з'являться нові тромбоцити; б) недостатність накопичення й збереження вмісту гранул тромбоцитів. Виникає, як правило, при генетично обумовлених порушеннях. Розлади реакцій вивільнення гранул викликають порушення другої хвилі агрегації тромбоцитів. Початкова агрегація кров'яних пластинок закінчується їх дезагрегацією. 4. Тромбоцитопатії, пов'язані з дефіцитом або зменшенням доступності фактора 3 пластинок. У їхній основі можуть лежати або генетично обумовлені дефекти структури цього фактора, або порушення його вивільнення з ушкоджених тромбоцитів. При цьому порушується зсідання крові (коагуляційний гемостаз). Адгезив-но-агрегаційні властивості тромбоцитів не міняються. 107. Недостатність коагуляційного гемостазу. Причини та механізми порушень окремих стадій згортання крові. Система гемостазу — це система, що забезпечує, з одного боку, збереження рідкого стану крові, з другого - зупинку кровотечі при ушкодженні кровоносних судин. Коагуляційний (вторинний, макроциркуляторний) гемостаз є продовженням судинно-тромбоцитарного і здійснюється на його основі. Коагуляційний гемостаз забезпечує зупинку кровотеч із судин, діаметр яких перевищує 100 мкм. У результаті його активації утворюється червоний тромб, що складається з фібрину і формених елементів крові
26.3.19. Чим можуть бути обумовлені порушення коагуляційного гемостазу - коагулопатії? В основі розвитку коагулопатій можуть бути: 1) зменшення активності системи зсідання крові; 2) підвищенням активності антикоагулянтної системи; 3) збільшенням активності фібринолітичної системи. 26.3.20. Що може бути причиною безпосереднього порушення І фази зсідання крові? Залежно від характеру порушень І фази зсідання крові виділяють три групи розладів. I. Ізольовані порушення зовнішнього механізму активації зсідання. Виникають при дефіциті ф. VII - гіпопроконвертинемії. Цей дефіцит може бути спадково обумовленим (тип спадкування аутосомно-рецесивний) або набутим (гіповітаміноз К, ураження печінки). II. Ізольовані порушення внутрішнього механізму активації зсідання: а) дефіцит ф.УШ- гемофілія А. Найчастіше виникає як генетичний дефект коагулянтної частини ф.УШ (тип спадкування зчеплений з Х-хромосомою). Можливе утворення аутоантитіл проти білкових компонентів цього фактора зсідання; б) дефіцит ф. IX- гемофілія В. Причиною розвитку є спадкова патологія (тип спадкування зчеплений з Х-хромосомою), дефіцит вітаміну К або ураження печінки, антитіла проти ф. IX; в) дефіцит ф. XI— гемофілія С. Виникає при генетичних порушеннях (тип спадкування аутосомно-рецесивний) або ураженнях печінки; г) дефіцит ф. ХП. Спадкова патологія, що буває дуже рідко. Завдяки калікре-їн-кініновій системі цей дефект добре компенсується, оскільки запуск внутрішнього механізму зсідання відбувається через зовнішній; ґ) дефіцит ф. З тромбоцитів. Є наслідком тромбоцитопенії або певних видів тромбоцитопатій. III. Поєднані порушення зовнішнього і внутрішнього механізмів зсідання. Розвиваються при дефіциті ф. X, що може бути спадково обумовленим (тип спадкування аутосомно-рецесивний) або набутим (гіповітаміноз К, ураження печінки). 26.3.21. Що може бути причиною безпосереднього порушення II фази зсідання крові? 1. Дефіцит ф.ІІ— гіпопротромбінемія. Найчастіше має набутий характер і розвивається внаслідок гіповітамінозу К або уражень печінки. 2. Дефіцит ф. V— парагемофілія. Порушення утворення проакцелерину може бути обумовлено ураженнями печінки або аутоантитілами проти ф.У 26.3.22. Що може бути причиною безпосереднього порушення III фази зсідання крові? 1. Дефіцит фібриногену: а) афібриногенемія - повна відсутність фібриногену (спадкове захворювання з аутосомно-рецесивним типом спадкування); б) гіпофібрииогенемія - зменшення синтезу фібриногену в печінці при її ураженнях. 2. Дисфібршшгенемії - якісні порушення фібриногену. Розвиваються як наслідок генетичних дефектів (тип спадкування аутосомно-домінантний). Виявляються утворенням аномального фібрину. 3. Порушення полімеризації фібрину. Розвиваються б результаті утворення комплексів фібриногену з фібрином-мономером і проміжними продуктами, від яких ще повністю не відщепились пептиди А і В. При цьому утворюється так званий "заблокований фібриноген" ("тромбінрезистентний фібриноген"), що не піддається дії тромбіну. 4. Дефіцит ф. ХШ. Виникає як наслідок спадкових порушень (тип спадкування ау-тосомно-рецесивний). виявляється порушеннями перетворення розчинного фібрину (фібрину S) у нерозчинний (фібрин І). 26.3.23. Які речовини складають антикоатулянтну систему крові? І. Первинні антикоагулянти. Постійно синтезуються в організмі й тому завжди містяться в плазмі крові. До них відносять: 1) антитромбін ПІ- основний універсальний антикоагулянт, що є інгібітором протеаз. Синтезується ендотелієм судин. Пригнічує активність усіх протеолітичних ферментів крові, у тому числі тромбіну, калікреїну, плазміну, ф. ХІІа, ф. ХІа, ф. Ха, ф. ІХа, ф.УІІа; 2) гепарин (антитромбін II) — глікозаміноглікан, що вивільняється тканинними базофілами і базофілами крові при їх дегрануляції. Антикоагулянтні властивості має не сам гепарин, а комплекс гепарину з антитромбіном III. Завдяки гепарину антитромбін III фіксується на поверхні ендотелію судин, де його антикоагулянтні властивості в багато разів зростають; 3) а -антитрипсин, а2-макроглобулін, інгібітор СІ-компонента комплементу - усі вони є неспецифічними інгібіторами протеаз, у тому числі й факторів зсідання крові. її. Вторинні антикоагулянти. У плазмі крові в нормі не містяться. Утворюються в процесі зсідання крові й фібринолізу. До них відносять: 1) антитромбін І— фібрин, що адсорбує і в такий спосіб інактивує велику кількість тромбіну; 2) продукти фібринолізу. Перешкоджають процесам полімеризації фібрину і утворенню фібринових структур. 26.3.24. Чим може бути обумовлене підвищення активності антикоагулянтної системи крові? Підвищення активності антикоагулянтної системи крові закономірно виникає при: 1) збільшенні вмісту гепарину в крові — гіпергепаринеміг. Це може бути обумовлено посиленою дегрануляцією тканинних базофілів і базофілів крові, зокрема, при алергічних реакціях І типу за класифікацією Кумбса і Джелла, руйнуванням базо-фільних лейкоцитів при лейкозах, введенням гепарину ззовні; 2) появою "патологічних " антикоагулянтів, до яких відносять антитромбін V, що порушує полімеризацію фібрину-мономеру; "вовчаковий" антикоагулянт, що порушує утворення протромбіназного комплексу; парапротеїни, що унеможливлюють полімеризацію фібрину. 26.3.25. Що входить у поняття "фібринолітична система"? Фібриноліпшчна система — це система, яка забезпечує лізис (протеоліз) фібрину в кровоносному руслі. У такий спосіб вона бере участь у підтримці рідкого стану крові й у відновленні кровообігу в тромбованих судинах.
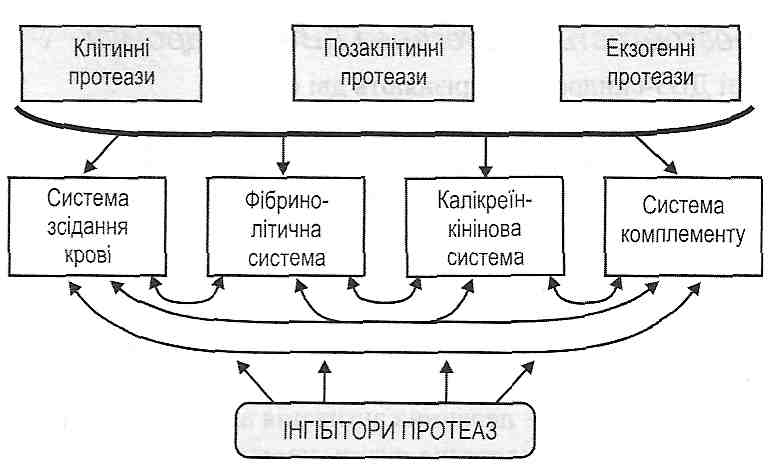
Рис. 119. Схема фібринолізу 1) плазміноген (профібринолізин) — неактивний протеолітичний фермент, що завжди міститься в плазмі крові; 2) плазмін (фібринолізин) — активна форма плазміногену. Утворюється в результаті дії активних протеаз на плазміноген і відщеплення від його молекули пептиду, який "закриває" активний центр; 3) активатори фібринолізу — велика група речовин, які або самі є протеазами і здатні перетворювати плазміноген у плазмін, або викликають появу таких протеаз; 4) інгібітори фібринолізу. До них відносять інгібітори протеаз, серед яких найбільше значення має а2-антиплазмін. Розрізняють внутрішній і зовнішній механізми активації фібринолізу. Внутрішній механізм обумовлений активацією фактора XII зсідання крові й утворенням калікреїну, унаслідок чого в крові з'являється велика кількість активаторів фібринолізу. Зовнішній механізм пов'язаний з надходженням у кров готових активаторів фібринолізу: ендотеліального, клітинного, тканинного (урокіназа), бактеріального (стрептокіназа). 26.3.26. Які фактори викликають підвищення активності фібриполітичної системи крові? 1. Посилене утворення й надходження в кров активаторів фібринолізу. Відбувається при великих ушкодженнях тканин: великі травми, ушкодження клітин токсинами, операційні втручання, лейкози та ін. 2. Зменшення вмісту в крові інгібіторів протеолізу. Має місце при недостатньому їх утворенні або посиленому використанні. 26.3.27. Якими клінічними ознаками виявляють себе порушення коагуляційного гемостазу? На відміну від порушень судинно-тромбоцитарного гемостазу для коагулопатій характерні не капілярні (точкові) кровотечі, а кровотечі з великих судин — артерій і вен. Такі кровотечі клінічно виявляють себе: а) гематомами — великими крововиливами в м'язи, під шкіру, у порожнину суглобів (гемартрози); б) тривалими кровотечами після операційних втручань (видалення зуба та ін.). 108. Синдром дисемінованого внутрішньосудинного згортання крові, принципи класифікації, етіологія, патогенез, клінічні прояви. Роль в патології. 26.3.28. Що таке ДВЗ-синдром? Синдром дисемінованого внутрішньосудинного зсідання крові (ДВЗ-син-дром) — це генералізоване зсідання крові всередині судин, що викликає утворення великої кількості мікрозгустків і агрегатів клітин, які порушують мікроциркуляцію в органах і тканинах. Цей синдром часто характеризують як катастрофу для організму. 26.3.29. Що може бути причиною ДВЗ-синдрому? Залежно від причин розвитку виділяють такі різновиди ДВЗ-синдрому: 1) інфекційно-септичний (розвивається при сепсисі); 2) посттравматичний (при краш-синдромі, опіковій хворобі, множинних переломах кісток); 3) шокогенний (при всіх видах шоку); 4) хірургічний (після операцій з великою травматизацією тканин); 5) акушерський (при передчасному відшаруванні плаценти, надходженні в кров навколоплідних вод); 6) токсигенний (після укусу змії); 7) пухлинний (при злоякісному пухлинному рості); 8) алергічний (при імунному ушкодженні тканин) та ін. 26.3.30. Що є патогенетичною основою розвитку ДВЗ-синдрому? В основі патогенезу ДВЗ-синдрому лежить так званий "гуморальний протеазний вибух ", тобто одночасна активація всіх протеолітичних ферментів плазми крові, що входять до складу чотирьох позаклітинних біохімічних систем (рис. 120): а) системи зсідання крові; б) фібринолітичної системи; в) калікреїн-кінінової системи; г) системи комплементу.
Рис. 120. "Гуморальний протеазний вибух" Основний принцип активації позаклітинних протеаз — відщеплення пептидів, що закривають їхні активні центри. Утворення активних протеолітичних ферментів крові має свої особливості: а) можлива самоактивація ферментів — активний фермент, впливаючи на неактивну форму, переводить її в активну; б) одні активні протеази здатні активувати інші (перехресна активація)', в) ланцюговий характер активації. Теоретично поява навіть однієї молекули активної протеази може викликати активацію всіх наявних протеаз крові. Однак у нормі реакції активації протеолітичних ферментів мають обмежений характер, що пояснюється існуванням великої групи інгібіторів протеаз. При патології, коли у кров надходять великі кількості активних протеаз, потужність існуючих інгібіторів може виявитися недостатньою. Отоді й виявить себе ланцюговий характер активації протеолітичних систем плазми крові. Така активація набуває генералізованого характеру, втягує всі протеази крові - відбувається "гуморальний протеазний вибух". 26.3.31. Назвіть основні джерела надходження в кров активних протеаз при ДВЗ- синдромі. Існує три основних джерела надходження протеаз у кров. I. Ушкоджені клітини. Має значення гостре ушкодження великої кількості клітин, з яких у позаклітинний простір і кров надходять лізосомні протеази, тканинний тромбопластин. Запалення як місцевий процес, що виникає при ушкодженні клітин, обмежує надходження продуктів розпаду в кров, локалізуючи ушкодження і в такий спосіб попереджаючи розвиток ДВЗ-синдрому. II. Надходження в кров великої кількості позаклітинних протеаз; наприклад трипсину при гострому панкреатиті, ферментів, що містяться в навколоплідних водах. III. Екзогенні протеази. їхніми джерелами можуть бути бактеріальні клітини при сепсисі, зміїна отрута та ін. 26.3.32. Як розгортається патогенез ДВЗ-синдрому? У патогенезі ДВЗ-синдрому розрізняють дві фази. I фаза - фаза гіперкоагуляції і агрегації тромбоцитів. Основу цієї фази становить генералізована активація системи зсідання крові, тобто утворення тромбіну (тромбінемія), що призводить до утворення фібрину і агрегатів тромбоцитів. Існує три механізми запуску цієї фази: 1) ферментативний механізм - надходження в кров великої кількості активних протеаз і тканинного тромбопластину; Дата добавления: 2016-03-26 | Просмотры: 720 | Нарушение авторских прав |
 До складу системи фібринолізу входять (рис. 119):
До складу системи фібринолізу входять (рис. 119):