|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Система дыхания5.2.1. Анатомо-физиологические особенности. Полость носа у ребенка относительно уже, а ее дно наклонено таким образом, что язык соприкасается с задней стенкой глотки на большем протяжении, чем у взрослых. Поэтому при ингаляции кислорода или проведении анестезии масочным способом могут возникнуть трудности, связанные с поддержанием свободной проходимости верхних дыхательных путей. Носовые ходы у маленького ребенка уже, чем у взрослого и поэтому при отеке слизистой оболочки или повышенной секреции чаще развивается их полная непроходимость. А поскольку новорожденный не может быстро перейти от носового дыхания к дыханию через рот, то возникают приступы апноэ. Гортань у новорожденного ребенка расположена относительно высоко, на три позвонка выше, чем у взрослого; голосовая щель находится на уровне III шейного позвонка. Анатомические взаимоотношения языка надгортанника и гортани усложняют проведение прямой ларингоскопии и интубации трахеи и могут затруднять использование изогнутого клинка Макинтоша. Надгортанник относительно длиннее и шире, чем у взрослых и располагается под углом в 45О к продольной оси. Поэтому, не приподняв клинком ларингоскопа надгортанник, невозможно увидеть голосовую щель. Наиболее узким местом дыхательных путей является трахея в области перстневидного хряща. Утолщение слизистой оболочки в этом месте на 1 мм (например, при катаральном воспалении) уменьшает просвет дыхательных путей на 75% у новорожденных и только на 20% у детей старшего возраста. Именно по этому отек слизистых оболочек у маленьких детей очень опасен и может быстро привести практически полной обструкции дыхательных путей. Трахея у новорожденного ребенка длиной около 5 см, поэтому требуется особая аккуратность при введении и фиксации интубационной трубку. Стенки трахеи довольно мягкие и могут быть сдавлены пальцами анестезиолога даже при наложении лицевой маски. Грудная клетка маленького ребенка более эластична, чем у взрослого, поэтому при обструкции дыхательных путей у ребенка раньше возникают выраженные втяжения уступчивых мест. Ребенок не может создать необходимое для расправления легких отрицательное внутриплевральное давление, в связи с чем ограничивается возможность увеличения дыхательного объема, раньше возникает экспираторное закрытие дыхательных путей. Неспособность ребенка к значительному увеличению объема вентиляции также связана с более горизонтальным, чем у взрослого расположением ребер и меньшей кривизной купола диафрагмы, являющейся основной дыхательной мышцей. Состав мышечных волокон новорожденного и взрослого также значительно различаются. Волокна I типа (медленно сокращающиеся, устойчивые к усталости) составляют у недоношенного ребенка всего 10%, у доношенного - 30% и только после года их количество приближается к уровню взрослого (55%). Архитектоника нижних дыхательных путей у взрослого и ребенка практически не различается. У младенца, родившегося в срок, имеется примерно 24 млн. альвеол, к 3-м месяцам их количество утраивается, к году возрастает в 5-6 раз (300-600 млн. у взрослого). Общая газообменная поверхность легких у новорожденного в 20 раз меньше, чем у взрослого, что примерно соответствует соотношению масс тела.
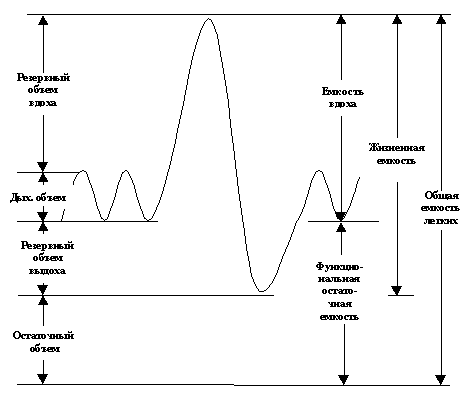
5.2.2. Вентиляция. Весь объем газа, находящийся в легких в состоянии максимального вдоха, т.е. общую емкость легких, принято разделять на ряд статических объемов и емкостей. Общепринятая терминология деления легочных объемов представлена на рис. 5.1. Первые дыхательные движения плода обнаруживаются уже на 11 неделе гестационного периода. Периоды дыхания редко длятся более 10 минут и чередуются с апноэ продолжительностью до 1-2 часов. В третьем триместре беременности продолжительность дыхательных движений у плода достигает нескольких часов в сутки. При переходе от внутри - к внеутробной жизни из легких адсорбируется около 30 мл/кг жидкости. Первые несколько вдохов характеризуются развитием высокого транспульмонального давления (около 50 см H2O), после чего легкие новорожденного ребенка почти полностью расправляются. У доношенного новорожденного общая емкость легких составляет около 160 мл и примерно половина от этой величины приходится на функциональную остаточную емкость. Дыхательный объем новорожденного равен примерно 6 мл/кг, а минутная вентиляция – 200-300 мл/кг/мин.
Рис. 5.1.
Как известно, не весь воздух поступающий в легкие, достигает перфузируемых альвеол и принимает участие в газообмене. Часть дыхательного объема (VT), не вступившего в газообмен с кровью, принято называть дыхательным мертвым пространством (VD). Фракция мертвого пространства в дыхательном объеме (VD/VT) примерно одинакова во всех возрастных группах (0,3). Однако малые абсолютные величины мертвого пространства у новорожденных (2 мл/кг), определяют необходимость уделять особое внимание выбору элементов дыхательного контура наркозной и дыхательной аппаратуры. В отличие от статистических легочных объемов, альвеолярная вентиляция (VA) у новорожденного (100-150 мл/кг/мин) значительно выше, чем у взрослого (60 мл/кг/мин). 5.2.3. Механика дыхания. Газообмен между альвеолярным воздухом и внешней средой осуществляется вследствие ритмических сокращений дыхательных мышц. Величина мышечного усилия определяет объем и скорость движения газа, поэтому взаимодействие этих показателей, с известной долей приближения, может быть описано на основе законов механики. Перемещению воздуха по дыхательным путям противодействует сопротивление двух типов: эластическое и неэластическое (аэродинамическое). В клинической физиологии для характеристики эластических свойств легких и грудной клетки чаще используют термин “податливость” - величина, обратная эластичности. Податливость (С) определяется как способность к изменению объема на единицу изменения давления: С = DV/ DP и выражается в литрах на 1 см вод. ст. Податливость легких сильно изменяется с возрастом (CL новорожденного составляет 0,004 л/см H2O, а взрослого - 0,15 л/см H2O). Величина податливости зависит от морфологических особенностей легкого, объема крови в легочных сосудах, количества жидкости в интерстициальном пространстве, объема легочной ткани, участвующей в газообмене, бронхиального тонуса. Снижение податливости наблюдается при респираторном дистресс-синдроме, отеке легких, ателектазах, интерстициальной эмфиземе, после продолжительных оперативных вмешательств. Аэродинамическое сопротивление дыхательных путей определяется величиной перепада давлений, которая необходима для получения данной объемной скорости движения воздуха: RAW = DP /V, см H2O/ (л . с). На величину аэродинамического сопротивления наибольшее влияние оказывает радиус воздухоносных путей, а также их длина и вязкость газа. Однако, периферические дыхательные пути создают не более 20% от общей величины аэродинамического сопротивления. Это связано с тем, что в результате деления бронхов, начиная с четвертой генерации, их суммарный просвет прогрессивно возрастает. Поэтому в клинической практике заметное увеличение аэродинамического сопротивления отмечается при нарушениях свободной проходимости верхних и первых трех генераций нижних дыхательных путей. Резко повышается аэродинамическое сопротивление при крупе, подсвязочном отеке, стенозирующем трахеобронхите. Необходимо помнить, что проведение назогастрального зонда у новорожденного ребенка может увеличить аэродинамическое сопротивление дыхательных путей более, чем на 50%. 5.2.4. Диффузия газов. Переход газов через альвеолярно-капиллярную мембрану протекает по физическим законам. Количество газа, переходящее через легочную мембрану в единицу времени, т.е. скорость диффузии, прямо пропорциональна давлению газа по обе стороны мембраны и обратно пропорциональна сопротивлению диффузии. Для характеристики сопротивления диффузии газов в легких принято использовать обратную величину, проводимость, называемую диффузионной способностью легких. Это количество газа, переходящее через альвеолярно-капиллярную мембрану в 1 мин, при разнице парциального давления газа по обе стороны мембраны в 1 мм рт. ст. Диффузионная способность пропорциональна поверхности легких, поэтому в педиатрической практике обычно ориентируются не на абсолютные цифры диффузионной способности, а на отношение их к функциональной емкости. Эта характеристика примерно одинакова у детей всех возрастных групп. Нарушения диффузии газов обычно сказывается лишь на газообмене кислорода, поскольку его растворимость, а соответственно и диффузионная способность в 20 раз меньше, чем у углекислого газа. Альвеолярно-артериальный градиент СО2 начинает увеличиваться тогда, когда диффузия падает более, чем в 10 раз. Нарушения диффузионной способности наблюдаются при отеке легких, респираторном дистресс-синдроме, интерстициальной пневмонии, бронхолегочной дисплазии и некоторых других заболеваниях. Однако, более значимые нарушения диффузионной способности происходят при уменьшении поверхности эффективного газообмена, например после обширных резекций легочной ткани, а чаще при выраженных нарушениях вентиляционно-перфузионных отношений. 5.2.5. Вентиляционно-перфузионные отношения. Эффективность легочного газообмена зависит не столько от абсолютных значений альвеолярной вентиляции или легочного кровотока, сколько от соотношения этих величин. В первые сутки поле рождения перфузия легких преобладает над вентиляцией. В дальнейшем уровень общего вентиляционно-перфузионного отношения устанавливается такой же, как у взрослых, и составляет 0,8. Схематически могут быть представлены три варианта распределения вентиляции и кровотока. 1. Вентиляция соответствует кровотоку (VA/Q=0,8). В этом случае кровь, оттекающая от альвеол, будет иметь нормальный газовый состав. 2. Вентиляция преобладает над кровотоком (VA/Q>0,8). Этот вариант возникает при гипервентиляции нормально перфузируемых альвеол или при нормальной вентиляции и сниженном легочном кровотоке. При этом, парциальное давление кислорода в крови останется нормальным, а PaCO2 - будет уменьшаться. 3. Вентиляция меньше кровотока (VA/Q<0,8). Такая ситуация возможна при сниженной вентиляции на фоне сохранившегося кровотока или в случае увеличения кровотока выше нормальных величин. В этих условиях развивается артериальная гипоксемия, а парциальное напряжение углекислого газа длительное время остается нормальным в связи с его высокой диффузионной способностью. Во время операции и наркоза происходят заметные изменения как общих, так и регионарных вентиляционно-перфузионных отношений. Одной из главных причин, вызывающих эти изменения, является длительное неподвижное положение больного во время операции. Примерно через 1-2 часа происходит смещение регионарной вентиляции снизу вверх, в то время как перфузируются преимущественно нижележащие отделы легких. Кроме того, у пациента находящегося в горизонтальном положении, ЖЕЛ уменьшается в среднем на 8-10% из-за более высокого стояния купола диафрагмы.Влияние на вентиляционно-перфузионные отношения оказывают также ИВЛ, ингаляции гипероксических дыхательных смесей, действие анестетиков, миорелаксантов и некоторых других лекарственных препаратов. Следует отметить, что ИВЛ и полодение больного влияют преимущественно на регионарное распределение вентиляции, в то время как анестетики изменяют главным образом регионарную перфузию. Нарушения легочной перфузии могут наблюдаться после массивных гемотрансфузий. Патогенез этих нарушений связан с обструкцией легочных капилляров агрегатами из клеточных элементов крови (эритроцитов, лейкоцитов, тромбоцитов). Агрегаты всегда содержаться в старой крови, но они могут образовываться и внутри сосудов, особенно при гипотензии и шоке. Подобные нарушения наблюдаются при газовой и жировой эмболии. Значительные изменения в распределении легочного кровотока происходят при снижении давления в легочной артерии. Прекращается перфузия верхних отделов легких, возрастает величина дыхательного мертвого пространства. Снижение давления в легочной артерии может наступить в результате применения вазодилататоров и ганглиоблокирующих препаратов, вследствие уменьшения ОЦК при кровотечении или потере жидкости. Крайней степенью нарушения вентиляционно-перфузионных отношений является развитие внутрилегочного вено-артериального шунтирования. Это явление наблюдается при полном прекращении вентиляции альвеол, но сохраняющемся кровотоке. Прекращение вентиляции и развитие ателектазов чаще всего происходит при обструкции бронхов, раннем экспираторном закрытии воздухоносных путей или первичном коллапсе альвеол, связанном со снижением уровня сурфактанта. Независимо от того, что происходит вначале - коллапс альвеол или экспираторное закрытие дыхательных путей, в конечном итоге всегда развивается ателектаз, так как закрытый в альвеоле газ диффундирует в кровь. Скорость спадения альвеол зависит от характера заполняющего ее газа. При дыхании кислородом или гелий-кислородными смесями она в несколько раз выше, чем при дыхании воздухом. 5.2.5. Легочный сурфактант. Сурфактант - это мономолекулярный слой поверхностно-активных веществ, находящийся на границе раздела между альвеолярным эпителием и воздухом. Уменьшая поверхностное натяжение, сурфактант препятствует спадению альвеол во время экспираторной фазы. Он также эмульгирует комочки мокроты, препятствуя агломерации и уменьшая адгезию. Кроме того, липидные компоненты сурфактанта повышают макрофагальную фагоцитарную активность и уменьшают воспаление, ингибируя секрецию интерлейкинов (IL-1 и IL-6). Сурфактант на 90% состоит из липидов и на 10% - из белков апопротеинов. Основная доля первых приходится на фосфолипиды, а из всех фосфолипидов более 70% составляют фосфатидилхолины, в основном дипальмитоилфосфатидилхолин, обладающий поверхностно-активными свойствами (Рис. 5.2.). Сурфактант синтезируется альвеолярными эпителиальными клетками 2-го типа, начиная с 22-26 недели внутриутробного развития. До 32 недели синтез сурфактанта осуществляется с помощью метилтрансфераз, а в более поздние сроки гестации и после рождения преобладает более эффективный фосфохолинтрансферазный путь. Скорость обновления поверхностно-активных фосфолипидов в легких у взрослых составляет 14 часов, а в период новорожденности она в 10-12 раз выше. Такие патологические состояния периода ранней адаптации как гипоксия, гипервентиляция, гипероксия, переохлаждение, перегревание, увеличивают скорость разрушения сурфактанта. Недостаточный синтез и (или) быстрая инактивация сурфактанта, маленький диаметр альвеол, высокая податливость грудной клетки и низкая растяжимость легочной ткани у недоношенных детей приводит к прогрессирующему ателектазированию легких и развитию респираторного дистресс-синдрома (РДС). Определение концентрации фосфолипидов (лецитин/сфингомиелин) в околоплодных водах используют для оценки зрелости легких плода. Отношение Л/С меньше 1 наблюдается до 32 недели гестационного развития, равное 2-м – примерно на 35 неделе и 4 – 6 у доношенного ребенка. Рис.5.2. Состав сурфактанта
5.2.6. Негазообменные функции легких. Частицы и некоторые микроорганизмы, оседающие в дыхательных путях, фагоцитируются альвеолярными макрофагами и затем удаляются мерцательным эпителием или перевариваются под действием гидролаз. Продуцируемый плазматическими клетками иммуноглобулин А (IgA) нейтрализует определенные вирусы и способствует лизису бактерий. Защитную функцию выполняют также интерферон, лизоцим, лактоферрин. Нормальное функционирование альвеолярного эпителия может нарушаться в связи с недостаточным увлажнением и согреванием дыхательной смеси при использовании искусственных воздухоносных путей (интубационная трубка, трахеостомическая канюля), токсическим воздействием ингаляционных анестетиков и лекарственных препаратов (фторотан, закись и окись азота, кортикостероиды, салицилаты и др.), а также при ацидозе, гипоксемии, гипокапнии, гипотермии и многих других патологических состояниях. Легкое является важным регулятором уровня многих биологически активных веществ в крови. Клетками легкого секретируются или высвобождаются гистамин, простагландины E и F, брадикинин, серотонин, ангиотензин II и многие другие субстанции. В тоже время, такие вазоактивные вещества как ангиотензин I, серотонин, АТФ, простагландины, норадреналин почти полностью или в значительной степени удаляются или инактивируются при однократном прохождении крови через легкие. Легкие как эластичный резервуар могут депонировать большое количество жидкости, поддерживая непрерывность кровотока и участвуя в регуляции ОЦК. Наконец, капиллярная сеть легких является биологическим фильтром, очищающим кровь от патологических примесей: клеточных агрегатов, сгустков фибрина и др. 5.2.7. Регуляция дыхания. У новорожденного ребенка регуляция вентиляции так же, как у взрослого, осуществляется с помощью рефлекторных и биохимических механизмов, однако эффективность функционирования этой системы значительно ниже. Так в ответ на гиперкапнию происходит очень непродолжительное по времени и незначительное увеличение объема вентиляции. При сопутствующей гипоксемии реакция на гиперкапнию может отсутствовать вовсе. В тоже время, новорожденные весьма чувствительны к изменениям РаО2. Назначение гипероксических дыхательных смесей приводит к заметному уменьшению объема вентиляции. Реакция на гипоксемию зависит от гестационного и постнатального возраста и температуры тела. Недоношенные дети и доношенные моложе 1-й недели жизни в состоянии нормотермии обычно отвечают на гипоксемию двухфазной реакцией: непродолжительный период усиления дыхания с последующей депрессией. У охлажденных новорожденных в ответ на гипоксемию развивается депрессия дыхания без предшествующего увеличения вентиляции. Рефлексы с барорецепторов легких, регулирующие глубину и частоту дыхания, у новорожденных детей выражены сильнее, чем у взрослых. При повышении давления в дыхательных путях происходит заметное увеличение дыхательного объема и уменьшение частоты дыхания. Поэтому методика ППД чаще и успешнее используется при лечении дыхательных расстройств у новорожденных детей, но следует помнить, что эти рефлексы угнетаются под действием анестетиков и седативных препаратов. У большинства недоношенных и части доношенных детей нередко отмечается периодическое дыхание (тахипноэ чередующееся с периодами апноэ продолжительностью 5-10 сек.). В эти периоды возникает небольшое изменение уровня РаСО2 и частоты сердечных сокращений, что впрочем не имеет значимых функциональных последствий. Периодическое дыхание обычно исчезает в возрасте 1-2 месяцев.
Дата добавления: 2015-02-06 | Просмотры: 1767 | Нарушение авторских прав |