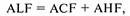Капилляроскопия
Для исследования микроциркуля-
ции традиционно применяют био-
микроскопические методы исследо-
вания капиллярного кровотока.
Главное преимущество этих мето-
дов состоит в возможности оценки
таких показателей, как диаметр
микрососуда, пассаж крови по ним,
агрегатное состояние крови, плот-
ность расположения капилляров,
что невозможно при любой другой
неинвазивной методике. Начало
этим исследованиям положено ра-
ботами Krogh (1922).
Для клиники наиболее важен
метод контактной капилляроско-
пии. С целью изучения диаметра
микрососуда — наиболее изменчи-
вого во времени показателя —
предложено несколько методов.
Телевизионная биомикроскопия
позволяет определить диаметр со-
суда с точностью до ±3 % и наблю-
дать за сравнительно быстрыми из-
менениями. Ellis и соавт. (1981)
предложили определять флюктуа-
цию потока эритроцитов по свето-
вому потоку на экране ТВ-микро-
скопа. В нашей стране использует-
ся метод микрокапиллярофотомет-
рии, предложенный В.И.Козловым
и соавт. (1982) для определения
диаметра и плотности функциони-
рующих капилляров (биомикро-
скопия с последующей фоторегист-
рацией наблюдаемого микрососуда
и морфометрическим анализом на
дешифраторе). Для изучения ско-
рости движения эритроцитов при-
меняют микрокиносъемку; авторы
методики — Блох и соавт. Левко-
вичем и соавт. в 1975 г. был моди-
фицирован этот опыт и предложен
кинотелевизионный комплекс для
прижизненного исследования мик-
роциркуляции.
Зарубежные авторы описывают
похожую методику с записью изме-
рений на носитель информации с
последующим компьютерным ана-
лизом и расчетом плотности распо-
ложения капилляров, т.е. количест-
ва эритроцитов, находящихся в ка-
пиллярах на 1 мм2 кожи, диаметра
капилляра (высота столбика эрит-
роцитов в микрометрах) и скорости
эритроцитов (мкм/с).
Исследование при хронической
артериальной недостаточности ко-
нечности проводят в положении
лежа на спине. Для микроскопии
капилляров конечностей чаще ис-
пользуют область ногтевого валика,
где капилляры расположены парал-
лельно поверхности кожи, что по-
зволяет определить не только сте-
пень кровенаполнения капилляра,
но и особенности пассажа формен-
ных элементов крови, динамиче-
ские изменения кровотока, обу-
словленные вазомоциями. После
регистрации кровотока в покое
проводят функциональные пробы,
в частности окклюзионную пробу,
заключающуюся в компрессии с
помощью наложенной на голень
манжеты магистральных сосудов на
1 мин и последующей ее декомп-
рессии. Измерения проводят как
минимум в четырех капиллярах.
Скорость движения эритроцитов
оценивается как в покое, так и во
время окклюзионной пробы. Оце-
нивают также время, необходимое
для достижения пика скорости дви-
жения эритроцитов в период реак-
тивной гиперемии.
У здоровых субъектов обычно
видно 4—5 рядов капилляров. Они
имеют форму плоской, вытянутой в
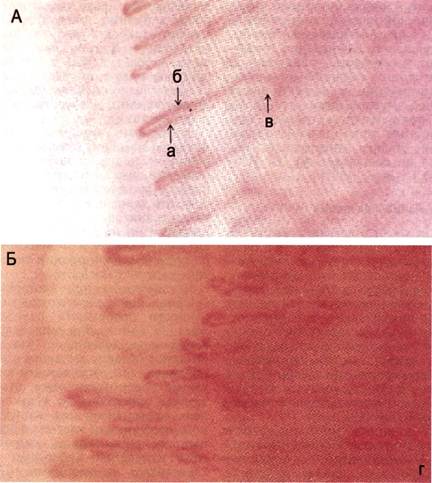
Рис. 2.58. Капилляроскопия ногтевого ложа I пальца стопы у здорового человека
(А) и при критической ишемии (Б).
а — артериальный; б — венозный отделы капилляра; в — субпапиллярное сплетение; г — то
же при критической ишемии.
длину петли с восходящей относи-
тельно направления тока крови
ветвью (артериальный отдел), пере-
ходным отделом и нисходящей
ветвью (венозный отдел). Артериа-
льный отдел обычно прямее и ко-
роче венозного. Переходный отдел,
как правило, обычно равномерно
закруглен. Венозный отдел имеет
менее четкие, слегка волнистые
контуры, обычно шире и длиннее
артериального (рис. 2.58). Диаметр
артериального отдела в норме
12+0,702 мкм, переходного —
21,2±0,799 мкм и венозного —
19,3+0,715 мкм [Козлов и др., 1991].
Кровоток периодически меняется
от быстрого гомогенного до замед-
ленного, при котором однород-
ность потока пропадает и он при-
обретает характер зернистого. Ско-
рость кровотока в артериальном от-
деле обычно больше, чем в пере-
ходном и венозном.
В начальных стадиях артериаль-
ной недостаточности наблюдаются
сужение просвета микрососудов и
уменьшение количества функцио-
нирующих капилляров, снижение
скорости кровотока. При критиче-
ской ишемии изменяется форма
капиллярных петель, усиливается
их извитость, появляется неравно-
мерность просвета микрососудов,
которая местами переходит в вари-
козное расширение, особенно в ве-
нулярном отделе. В целом все от-
делы капиллярной петли расшире-
ны, что свидетельствует о сниже-
нии тонуса и выраженности проли-
феративных процессов со стороны
эндотелия. Увеличение диаметра
капилляра более 19—22 мкм обу-
словлено не вазомоциями, а поте-
рей тонуса сосудов и деструктив-
ным процессом. Статистически до-
стоверно снижается плотность рас-
положения капилляров: она со-
ставляет 40 мм2 при ишемии I сте-
пени и 34 мм2 при критической
ишемии [Jacobs M. et al., 1992].
Капиллярный фон мутный, конту-
ры нечеткие, что может свидетель-
ствовать о нарушении барьерной
функции капилляров. Кровоток
резко замедлен вплоть до его пол-
ной остановки. Имеются точечные
геморрагии.
При окклюзионной пробе возни-
кает так называемая реактивная
гиперемия, заключающаяся во вре-
менном усилении кровотока, что
проявляется в увеличении скоро-
сти движения эритроцитов. С на-
растанием ишемии конечности до-
стоверно уменьшается пиковая
скорость и удлиняется время ее до-
стижения после пробы. M.Jacobs
и соавт. (1992) приводят следую-
щие цифры для пиковой скоро-
сти: 261 мкм/с при ишемии I,
149 мкм/с — при II и 96 мкм/с —
при ишемии III—IV (по Fontaine).
Время достижения пика кровотока
замедляется с 8,5 с при ишемии
I степени до 22 с при критической
ишемии. В заключение отметим
еще раз преимущества биомикро-
скопии: возможности идентифика-
ции различных звеньев микроцир-
куляторного русла, качественной
оценки их распределения и интен-
сивности микроциркуляции, расче-
та структурных параметров микро-
сосудов, точной топической харак-
теристики кровотока. Методика
является идеальным инструментом
для качественной и количествен-
ной оценки нутритивного кровото-
ка у больных с критической ише-
мией. Есть указания на возмож-
ность предсказания постишемиче-
ского отека после реконструктив-
ного вмешательства. Тем не менее
в связи с высокой трудоемкостью и
стоимостью современного оборудо-
вания для микроскопии методика в
клинической практике применяет-
ся редко.
2.5.3. Лазерная допплеровская
флоуметрия
Впервые возможность исследова-
ния кожного кровотока с помощью
лазерной флоуметрии продемонст-
рировал М.Stern в 1975 г., а уже че-
рез 2 года G.Holloway и P.Watkins
создали первый аппарат для клини-
ческого применения. Принцип ла-
зерной флоуметрии основан на эф-
фекте Допплера — отражении луча
от движущихся частиц. Показатель
перфузии пропорционален количе-
ству эритроцитов, содержащихся в
единице объема тканей в единицу
времени. Сигнал регистрирует
1 — 1,5 мм3 ткани, преимущественно
от нутритивного и субпапиллярного
капиллярных сплетений; величина
сигнала отражает суммарные про-
цессы, происходящие в этом объ-
еме ткани. 90 % сигнала отражается
от субпапиллярного сплетения, вы-
полняющего, в частности, терморе-
гуляторную функцию за счет боль-
шого количества артериоловенуляр-
ных шунтов.
За последние 10 лет использова-
ние этого метода для оценки мик-
роциркуляции значительно расши-
рилось как в лабораторных, так и в
клинических условиях. Современ-
ные аппараты являются достаточно
удобными и простыми в работе. В
настоящее время насчитывается
уже 8 зарубежных фирм и одна рос-
сийская, выпускающие флоуметры
(НПП «ЛАЗМА»). Все приборы
имеют свои особенности калибров-
ки, вследствие чего их показания
различны. Мы приводим показате-
ли микроциркуляции (перфузии)
для наиболее распространенного
прибора в России — флоуметра
фирмы «Transonic Systems, Inc.»
(США). Фирма выпускает несколь-
ко типов датчиков:
• тип S (Straight/прямой) для ис-
следования кожи или ткани с лег-
ким доступом;
• тип Р (Prism/призматический),
тип R (Right Angle/правый угол)
для измерения поверхностного кро-
вотока (кожа, швы на кожных лос-
кутах, внутренние органы);
• тип М (Mono Fiber/одноволок-
нистые) — вживляемые датчики для
длительных исследований, когда
нет доступов для других типов дат-
чиков;
• тип G (Gauge Needle/иглооб-
разные) для интраоперационного
использования; позволяет прово-
дить измерение мозгового, почеч-
ного, печеночного, подкожного и
внутримышечного кровотока;
• тип Е (Endoscopy/эндоскопиче-
ские) для измерения кровотока в
бронхах, желудке, мочевом пузыре;
• тип D (Dental/стоматологиче-
ский) — для измерения кровотока в
слизистой оболочке полости рта.
ЛДФ-исследование проводят в
помещении с температурой воздуха
20—22 °С после предварительной
адаптации пациента в течение не
менее 10 мин. За 1—3 ч до выпол-
нения исследования исключают
прием вазоактивных препаратов и
курение.
Для сосудистой хирургии наибо-
лее актуальным остается вопрос
оценки микроциркуляции ишеми-
зированной конечности.
Чаще всего точкой проведения
флоуметрии при артериальной не-
достаточности на нижней конечно-
сти является тыльная поверхность
I пальца стопы (зона, богатая арте-
риоловенулярными анастомозами),
первый межпальцевый промежу-
ток (бедная артериоловенулярными
анастомозами зона). Реже исследо-
вание проводят по всей длине ко-
нечности (помимо вышеуказанных
точек, используют точки в нижней,
верхней трети голени, нижней и
верхней трети бедра; датчик накла-
дывают по внутренней поверхно-
сти конечности). На верхней ко-
нечности датчик накладывают на
первый межпальцевый промежу-
ток, хотя возможны и другие вари-
анты.
Как правило, измеряют базаль-
ный кровоток в течение 2—3 мин,
что позволяет в дальнейшем, после
усреднения всех данных, избежать
зависимости от силы крепления
датчика, тургора кожи, влияния
дыхания на конечный результат.
Иногда вычисляют среднее значе-
ние показателя микроциркуляции
в нескольких рядом лежащих точ-
ках или проводят несколько изме-
рений в одной и той же точке. Та-
кое количество различных спосо-
бов вычисления одного и того же
показателя базальной перфузии
связано с плохой воспроизводимо-
стью этой величины, что и являет-
ся основной причиной недоверия
к изолированному измерению ба-
зального кровотока в клинической
практике. Множество факторов в
различной степени влияет на пока-
затели базального кожного крово-
тока. Наиболее существенное вли-
яние оказывают положение датчи-
ка и тела, физическая активность,
психоэмоциональное напряжение,
температура тела, пищевой и пить-
евой режимы. Другой существен-
ной проблемой является неопреде-
ленность измеряемого объема тка-
|
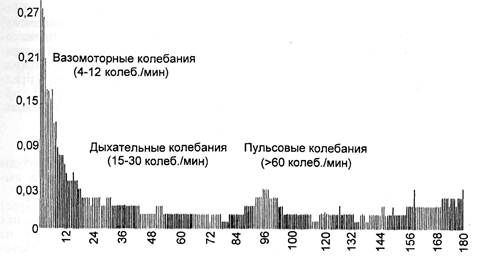
Рис. 2.59. Амплитудно-частотный спектр флоуграммы у здорового человека.
ней, что обусловлено структурной
гетерогенностью тканей и их инди-
видуальными различиями. Так, ис-
следования Bravermann показали,
что плотность расположения ка-
пилляров в коже в разных точках
различна: существуют зоны с высо-
кой, низкой плотностью и аваску-
лярные зоны (до 0,3—0,6 мм в по-
перечнике).
П.Г.Швальбом и соавт. (1996)
была предложена методика сораз-
мерного количественного сравне-
ния базального кровотока на раз-
личных участках конечности (бед-
ро, голень, стопа). Однако Ю.А.Бу-
ров и соавт. (1997) отмечают, что у
38,2 % больных не наблюдается по-
степенного снижения кровотока по
направлению к дистальным сегмен-
там конечности.
Флоуграмма характеризует пе-
риодические изменения перфузии
тканей кровью, которые происхо-
дят с различной амплитудой. Эти
колебания называются флаксмоция-
ми и отражают изменчивость и при-
способляемость кровотока к меня-
ющимся условиям гемодинамики и
потребностям тканей в кислороде.
Постоянная изменчивость кровото-
ка в микрососудах считается основ-
ным признаком жизнедеятельности
тканей. Поэтому использование
уровня базального кровотока для
оценки нарушений микрогемодина-
мики представляется неоправдан-
ным.
В настоящее время изменились
приоритеты в исследованиях: на
первое место выдвигается изучение
механизмов изменчивости капил-
лярного кровотока, их нарушений
при различной патологии.
Ритмические колебания перфу-
зии позволяют судить о соотноше-
нии различных механизмов в
жизнедеятельности капиллярного
русла. С помощью аппарата мате-
матического преобразования Фурье
при анализе графика колебаний
перфузионного показателя — флоу-
граммы — можно выделить различ-
ные по частоте колебания, наибо-
лее значимыми из которых являют-
ся низкочастотные — от 4 до 12 ко-
леб./мин, высокочастотные — от 15
до 30 колеб./мин и пульсовые (рис.
2.59).
Низкочастотные колебания (Low
Frequency) обусловлены активно-
стью мйоцитов в стенке микрососу-
дов [Zweifach, 1961] и прекапилляр-
ных сфинктеров. Согласно Folkow
(1964), спонтанные ритмические
сокращения связаны с повышением
трансмурального давления. Распо-
ложение миоцитов в артериолах по-
зволяет создать «бегущую» мышеч-
ную волну вдоль всего артериоляр-
ного отдела микроциркуляторного
русла.
Высокочастотные колебания кро-
вотока (High Frequency) впервые
были обнаружены Bollinger и соавт.
в 1989 г. у больных с окклюзией
периферического артериального
сосудистого русла, хотя они могут
наблюдаться и у здоровых людей.
Дыхательные экскурсии вызывают
ритмические изменения кровена-
полнения венозного русла, что от-
ражают высокочастотные колеба-
ния. По мнению Hoffman и соавт.
(1990, 1994), этот компенсаторный
механизм обычно наблюдается при
ишемических расстройствах кож-
ного кровотока. Пульсовые колеба-
ния (CF) отличаются малыми амп-
литудами и синхронизированы с
кардиоритмом. Они отражают
основной, хоть и пассивный, гемо-
динамический механизм микро-
циркуляции, ритм которого задает-
ся вне его пределов. Малая толщи-
на стенок прекапиллярных артери-
ол и их высокая подвижность дол-
жны обеспечивать интенсивное за-
тухание пульсовых волн в системе
микроциркуляции. Тем не менее
при лазерной флоуметрии обнару-
живаются значительные колебания
кровотока в микрососудах, что по-
зволяет заключить, что сама систе-
ма совершает дружные синхрони-
зированные колебания. Вместе с
тем утолщение стенок мелких со-
судов уменьшает их подвижность,
что на допплерограмме отражает-
ся снижением амплитуды вазомо-
ций и повышением пульсовых ко-
лебаний. Для оценки соотношения
участия различных механизмов в
регуляции кровотока в микроцир-
куляторном русле можно исполь-
зовать понятия активного (собст-
венно сокращения миоцитов)
и пассивного (процессов, происхо-
дящих вне микрососудов) меха-
низмов регуляции кровотока.
В.И.Козлов и соавт. (1998) пред-
лагают использовать индекс эф-
фективности микроциркуляции,
равный
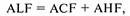
где ALF, ACF и AHF — амплитуды
низкочастотных, пульсовых и вы-
сокочастотных колебаний.
Возможно, этот показатель будет
более информативным при оценке
ишемии конечности. Однако на
данный момент достаточно обосно-
ванных работ на эту тему не имеет-
ся. Поэтому в клинической практи-
ке по-прежнему используются из-
мерение базального кровотока и
функциональные пробы.
При необратимой хронической
ишемии тканей нижних конечно-
стей, как правило, базальный кро-
воток в дистальных сегментах ише-
мизированной конечности ана-
логичен флоуграмме, полученной
при записи с ампутированной ко-
нечности. Для всех кривых харак-
терны монофазность, низкая амп-
литуда, равная 0,7—0,9 у.е. (услов-
ных, или перфузионных, единиц).
Схожие показатели бывают и при
острой ишемии, однако это вовсе
не означает, что ишемия необра-
тима. Причин этому несколько:
1) выраженная депрессия перфузи-
онного артериального кровотока,
2) неадаптированные коллатераль-
ные пути и 3) блокировка нутри-
тивной части микроциркуляторно-
го русла.
Достоверного различия в величи-
не показателя микроциркуляции у
больных с III и IV степенью ише-
мии нет. Поэтому некоторые авто-
ры предполагают, что величина
тканевого кровотока на I пальце и
тыле стопы менее 1,2 у.е. является
одним из признаков критической
ишемии конечности.
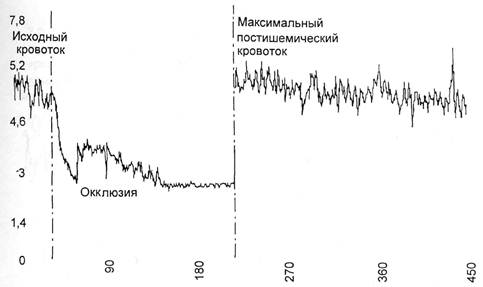
Рис. 2.60. Окклюзионная проба у здорового человека.
Наибольшее значение при про-
ведении лазерной флоуметрии
придается функциональным про-
бам.
Оккюзионная проба (проба реак-
тивной гиперемии). На голень (или
бедро в зависимости от точки из-
мерения) накладывают манжету
и нагнетают давление 250—
300 мм рт.ст., которое сохраняется
в течение 2—3 мин. Определяют
следующие показатели: базовый
кровоток, «биологический нуль»,
время до начала постишемического
ответа, время восстановления до
уровня базового кровотока, вре-
мя до появления максимального
постишемического кровотока, мак-
симальный постишемический кро-
воток. Вычисляют резерв капил-
лярного кровотока (РКК), который
равен отношению максимального
показателя перфузии после деком-
прессии манжетки к исходному,
выраженному в процентах. Наибо-
лее информативны два последних
показателя. При окклюзионной
пробе часто определяется «биоло-
гический нуль», когда магистраль-
ный кровоток в тканях отсутству-
ет. Показатель «нуля» отличает-
ся от инструментального (пока-
затель перфузии при расположе-
нии датчика на белой ровной
поверхности). Его происхожде-
ние часто связывают с аномально
высокой подвижностью эритроци-
тов.
Проба с реактивной постокклю-
зионной гиперемией у здоровых
лиц характеризуется коротким ин-
тервалом от момента прекращения
окклюзии до максимального пост-
ишемического прироста кровотока
с его увеличением на 340+50 % [Ка-
закова Ю.И. и др., 1997], время
достижения пика кровотока (рис.
2.60) не превышает 20—30 с
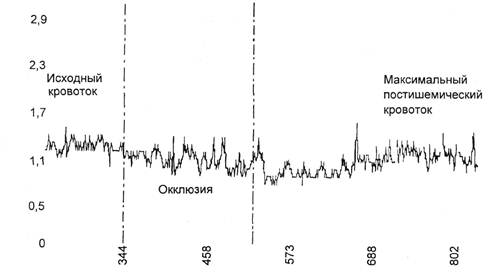
[Ray S.A. et al., 1997]. При необра-
тимой критической ишемии отсут-
ствует реакция на функциональные
пробы. Как правило, максималь-
ный постишемический кровоток не
превышает 1,2 у.е., а постишемиче-
ский прирост кровотока — не более
30 %; по данным Ю.И.Казакова и
соавт. (1997), — менее 50 % (рис.
2.61).
Рис. 2.61. Окклюзионная проба при критической ишемии.
Г.С.Кротовский и соавт. (1999)
указывают на малую вероятность
спасения конечности при приросте
кровотока после окклюзионной
пробы менее чем на 15 %. Окклю-
зионная проба имеет определенное
прогностическое значение при про-
ведении инфраингвинальных арте-
риальных реконструкций: если
время максимального постишеми-
ческого кровотока составляет более
100 с, то чувствительность пробы к
клиническому улучшению после
операции равна 82 % [Ray S.A. et
al, 1997].
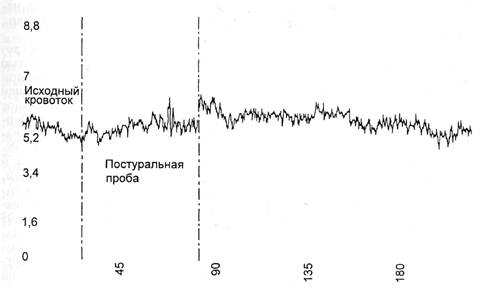
Постуральная проба (ортоста-
тическая) — перевод конечности в
вертикальное положение (ниже
уровня сердца) на 1 мин. Вычисля-
ют следующие показатели: базовый
кровоток, кровоток во время верти-
кального положения конечности
(он может как возрастать, так и
убывать по сравнению с базовым),
время восстановления до уровня
базового кровотока. При проведе-
нии постуральной пробы у здоро-
вых лиц наблюдается снижение
кровотока в 1,5—2 раза за счет ве-
нулоартериолярного рефлекса (рис.
2.62). У больных с выраженной пе-
ремежающейся хромотой или впер-
вые возникшими болями в покое,
наоборот, происходит его увеличе-
ние. У пациентов с тяжелой ише-
мией постуральной реакции не на-
блюдается (рис. 2.63).
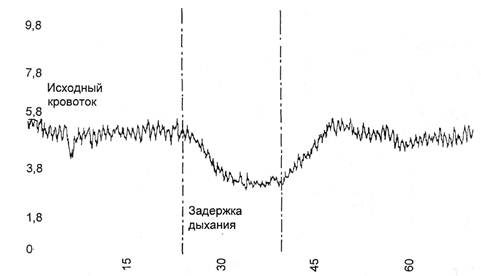
Проба дыхательная — проба с за-
держкой дыхания на 15 с отражает
симпатические влияния на кожный
кровоток, при ее проведении кро-
воток в норме снижается на 30 % за
счет спазма микрососудов (рис.
2.64). При падении показателя пер-
фузии более чем на 50 % можно го-
ворить о наличии спастического
компонента в патогенезе заболева-
ния [Казаков Ю.И., 1997]. Г.С.Кро-
товский и соавт. (1999) считают це-
лесообразным выполнение пояс-
ничной симпатэктомии при уста-
новленной положительной реакции
на эту пробу.
Тепловая проба — нагревание об-
ласти исследования до 40—42 °С в
течение 3 мин — позволяет оценить
резервные возможности микроцир-
куляторного русла по увеличению
кровотока во время реактивной ги-
перемии.
Рис. 2.62. Постуральная проба у здорового человека.
Холодовая проба — опускание
контралатеральной конечности в
холодную воду (температура 10—
13 °С) — оценивает снижение кро-
вотока в ответ на действие темпера-
турного фактора. Этот тест наибо-
лее информативен при болезни
Рейно.
В современной литературе, по-
священной сосудистой хирургии,
последние две пробы пока не осве-
щены.
Рис. 2.63. Постуральная проба при критической ишемии.
Рис. 2.64. Дыхательная проба у здорового человека.
Медикаментозные пробы — про-
бы с применением различных ле-
карственных препаратов, в частно-
сти препаратов ПГЕ1. Для вазапро-
стана проба считается положитель-
ной при увеличении постокклюзи-
онного кровотока более чем на
30 % и времени сохраняющегося
прироста кровотока более чем на
25 % после однократного введения
вазапростана [Кротовский Г.С. и
др., 1999]. Пробу используют для
определения показаний к назначе-
нию препаратов ПГЕ1.
Определение внутримышечного
кровотока. После пункции мышеч-
ного массива голени (медиальная
головка икроножной мышцы) в
просвет иглы вводят интраопераци-
онный датчик типа N. Измеряют
как базовый кровоток, так и крово-
ток при пробе Вальсальвы. Отмеча-
ют некоторое увеличение кровотока
при I степени ишемии конечности
(7,96 у.е.) в сравнении с контроль-
ной группой (6,34 у.е.), хотя раз-
ница статистически недостоверна.
При терминальных стадиях артери-
альной недостаточности происхо-
дит резкое снижение кровотока — в
10 раз и более (0,65 у.е.). Пробу ис-
пользуют для определения жизне-
способности мышечного лоскута
при ампутации конечности и уров-
ня ампутации конечности: при по-
лучении базального кровотока
ниже 2,5 у.е., а в особенности ме-
нее 1,0 у.е. данный мышечный мас-
сив для миопластики считается не-
пригодным [Буров Ю.А. и др.,
1999].
Определение внутрикостного кро-
вотока. В связи с инвазивностью
методики ее применяют только при
операции реваскуляризирующей
трепанации. Через перфорационное
отверстие в костной пластине бер-
цовой кости в костномозговой ка-
нал устанавливают датчик типа N.
Регистрируют тканевый кровоток и
кровоток при пробах (дыхательной,
медикаментозных и др.). Статисти-
чески достоверной разницы в пока-
зателях при II (2,38 у.е.) и III (3,05
у.е.) степенях ишемии не наблюда-
ется. При проведении проб с сим-
патической стимуляцией отмечает-
ся достоверное снижение реакции
пациента на пробу. Широкого при-
кладного применения не имеет.
Отдельное место занимает лазер-
ная флоуметрия при флебологиче-
ских исследованиях. Здесь флоу-
метрию применяют пока в исследо-
вательских целях. Для измерения
используют следующие точки:
• по внутренней поверхности
нижней трети голени (зона наибо-
лее выраженных расстройств тро-
фики при ХВН);
• по наружной поверхности ниж-
ней трети голени (контрольная точ-
ка, здоровый участок);
• тыльная поверхность стопы в
области первого межплюсневого
промежутка (зона вне выраженных
флебогемодинамических измене-
ний, бедная естественными АВ-
анастомозами);
• подошвенная поверхность
I пальца стопы (зона вне выражен-
ных флебогемодинамических изме-
нений, богатая естественными АВ-
анастомозами).
В состоянии покоя отмечается
достоверное снижение кожного
кровотока у больных в начальных
стадиях венозной недостаточности
(ХВН) в коже медиальной поверх-
ности голени (1,32 у.е. у больных и
2,62+0,4 у.е. у здоровых) и тыла
стопы (1,7 и 4,67 у.е. соответствен-
но). Наоборот, в клинически выра-
женных стадиях ХВН отмечается
усиление кожного кровотока в зо-
нах, богатых естественными АВ-
анастомозами за счет феномена ар-
териоловенулярного шунтирова-
ния. Показатель микроциркуляции
при ортостатической пробе повы-
шается по мере прогрессирования
заболевания в областях, наиболее
анатомически связанных с точками
трофических нарушений, снижаясь
на 20—30 % в I стадии и на 10—
20 % и менее — во II и III стадиях.
При дыхательной пробе достовер-
ное уменьшение местной реактив-
ности на активацию симпатиче-
ской системы зафиксировано толь-
ко при выраженных стадиях ХВН,
причем данное изменение затро-
нуло тоже только зону трофиче-
ских нарушений (медиальная по-
верхность голени). Вышеуказан-
ные изменения, возможно, отра-
жают процесс десимпатизации ве-
нозной стенки в процессе разви-
тия ХВН [Кайдорин А.Г. и др.,
1998].
Таким образом, область клиниче-
ского применения лазерной флоу-
метрии еще четко не установлена,
наибольшее значение на данный
момент имеют функциональные
пробы, в частности, при определе-
нии необратимости критической
ишемии конечности, выработке по-
казаний к поясничной симпатэкто-
мии или назначению вазапростана,
оценке эффективности лечения,
прогнозировании отдаленных ре-
зультатов реконструктивной опера-
ции.
Литература
Буров Ю.Л. и др. Возможность неинвазив-
ного и интраоперационного использова-
ния лазерной допплеровской флоуметрии
у больных с критической ишемией ниж-
них конечностей//Методология флоумет-
рии. - М., 1997. - С. 81-91.
Буров Ю.А. и др. Применение лазерной
допплеровской флоуметрии для выяв-
ления необратимости ишемии нижних
конечностей. Лазерная допплеровская
флоуметрия как метод оценки состояния
кровотока в микрососудах//Методология
флоуметрии: Сб. статей. — М., 1999. —
С. 29-40.
Дроздов С.А. и др. Методы изучения мик-
роциркуляции у больных с облитерирую-
щими заболеваниями сосудов нижних ко-
нечностей//Хирургия. — 1991. — № 6. —
С. 156-159.
Казаков Ю.И. и др. Изучение микроцир-
куляции у больных с облитерирующими
заболеваниями артерий нижних конечно-
стей//Методология флоуметрии. — М.,
1997. - С. 55-63.
Кайдорин А.Г. и др. Некоторые возможно-
сти метода лазерной допплеровской фло-
уметрии во флебологических исследова-
ниях. — Там же. — С. 89—103.
Козлов В. И. и др. Состояние микроцирку-
ляции у больных с артериальной недоста-
точностью нижних конечностей//Физиол.
журн. СССР. - 1991. - Т. 77, № 6. -
С. 55- 67.
Козлов В. И. и др. Гистофизиология капил-
ляров. — СПб.: Наука, 1994. — 223 с.
Козлов В. И. и др. Исследование колебаний
кровотока в системе микроциркуляции//
Применение лазерной допплеровской
флоуметрии в медицинской практике:
Матер, симпозиума.— М., 1998.— С. 8—
13.
Козлов В.И. и др. Лазерный анализа-
тор кровотока ЛАКК-01. — Там же. —
С. 5-8.
Кохан Е.П. и др. Тканевый кровоток и
симпатическая реактивность при облите-
рирующем атеросклерозе артерий ниж-
них конечностей/УМетодология флоумет-
рии. - М., 1997. - С. 63-79.
Кротовский Г. С. и др. Изучение парамет-
ров микроциркуляции методом ЛДФ у
больных с хронической критической и
субкритической ишемией на фоне нере-
конструируемого заболевания артерий
нижних конечностей.— Там же.— С. 47—
58.
Покровский А. В., Чупин А. В. Определение
степени нарушения региональной мик-
роциркуляции нижних конечностей//
Врач. - 1994. - № 1. - С. 28.
Соркисов К. Г., Дужак Г. В. Лазерная доп-
плеровская флоуметрия как метод оценки
состояния кровотока в микрососудах//
Методология флоуметрии: Сб. статей. —
М., 1999. - С. 9-14.
Шор Н.А. и др. Состояние микроциркуля-
ции в нижних конечностях до и после по-
ясничной симптаэктомии у больных с об-
литерирующим атеросклерозом при нали-
чии хронической критической ишемии.—
Там же. — С. 52-58.
Шор Н.А. и др. Состояние микроциркуля-
ции в нижних конечностях у больных об-
литерирующим атеросклерозом при нали-
чии хронической критической ишемии//
Методология флоуметрии. — М., 1998. —
С. 53-61.
Шор Н.А. и др. Состояние микроциркуля-
ции в нижних конечностях у больных са-
харным диабетом. Лазерная допплеров-
ская флоуметрия как метод оценки состо-
яния кровотока в микрососудах//Методо-
логия флоуметрии: Сб. статей. — М.,
1999. - С. 41-45.
Jacobs M. et al. Assessment of the Microcir-
culation provides Additional Information in
Critical Limb Ischaemia//Europ. J. Vase.
Surg. - 1992. - Vol. 6. - P. 135-141.
Ray S.A. et al. The predictive Value of Laser
Doppler Fluxmetry and Transcutaneous
Oxygen Tension Measurements for Clinical
Outcome in Patients Undergoing Revascula-
risation for Severe Leg Ischaemia//Europ. J.
Vase. Endovasc. Surg. — 1997. — Vol. 13. —
P. 54-59.
Ray S.A. et al. The Association Between La-
ser Doppler Reactive Hyperaemia Curves
and the Distribution of Peripheral Arterial
Disease//Europ. J. Vase. Surg. — 1999. —
Vol. 17. - P. 245-248.
Seifalian A.M. et al. Comparison of Laser
Doppler Perfusion Imaging, Laser Doppler
Flowmetry, and Thermografic Imaging for
Assessment of Blood Flow in Human Skin//
Europ. J. Vase. Surg. - 1994. - Vol. 8. -
P. 65-69.
Ubbink D. Th. et al. The Value of Non-Inva-
sive Techniques for the Assessment of Criti-
cal Limb Ischaemia//Europ. J. Vase. Surg. —
1997. - Vol. 13. - P. 296-300.
Wahlberg E. et al. Changes in Postocclusive
Reactive Hyperaemic Values as Measured
with Laser Doppler Fluxmetry after Infrain-
guinal Reconstructions//Europ. J. Vase. En-
dovasc. Surg. - 1995. - Vol. 9. - P. 197—
203.
2.6. Компьютерно-томографическая диагностика
заболеваний сосудов
Дата добавления: 2015-02-06 | Просмотры: 1064 | Нарушение авторских прав
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|