Коарктация аорты. Коарктация аорты (лат. coarctatio — сжатие) — врожденное сужение или полная атрезия аорты в области ар- териальной связки
Коарктация аорты (лат. coarctatio —
сжатие) — врожденное сужение или
полная атрезия аорты в области ар-
териальной связки, проявляющаяся
нарушением гемодинамики. Сте-
пень сужения аорты колеблется в
широких пределах — от полной ат-
резии до небольшой степени суже-
ния. Принято выделять тубулярный
и мембранозный типы сужения. Од-
нако часто при наличии умеренного
тубулярного сужения в просвете до-
полнительно определяются мембра-
на или утолщенный валик внутрен-
ней оболочки аорты. Среди наших
пациентов чисто тубулярный тип
сужения встретился только в 30 %
случаев, а в 70 % тип сужения был
мембранозный или сочетанный.
Коарктация аорты может сочета-
ться как с открытым артериальным
протоком, так и с другими врож-
денными пороками сердца. В зави-
симости от отношения места суже-
ния к месту впадения артериально-
го протока выделяют предуктальный
и постдуктальный варианты коарк-
тации аорты. Проток может быть
функционирующий и закрытый.
Первые работы по КТ-диагности-
ке коарктации аорты опубликованы
J.D.Gubwin и др. (1981), J.V.Cholan-
keril и др. (1981). Однако компью-
терные томографы I— III поколений
обладали недостаточной скоростью
сканирования, чтобы следовать по
ходу аорты за движением контраст-
ного вещества, введенного болюсом.
С появлением спиральных компью-
терных томографов, позволяющих
получить односекундные и субсе-
кундные срезы, появилась возмож-
ность выполнять исследование аор-
ты на всем протяжении следования
болюса. Это значительно расшири-
ло возможности КТ-диагностики
коарктации аорты [Черняк Б.Б. и
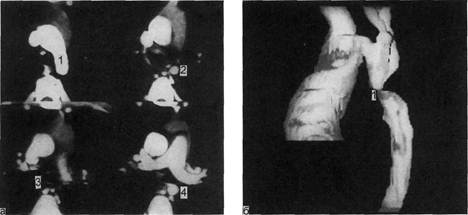
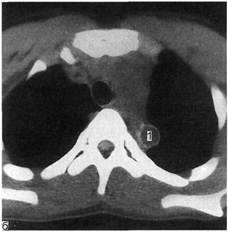
Рис. 2.93. Коарктация аорты (полный перерыв).
а — томограммы на различных уровнях: 1 — контрастированная дуга аорты; 2 — суживаю-
щийся участок аорты дистальнее начала левой подключичной артерии; 3 — неконтрастирую-
щийся тяж на месте аорты; 4 — постстенотическое расширение аорты; б — трехмерная ре-
конструкция аорты того же больного. Место полного перерыва аорты (1).
др., 2000; Никитаев Н.С. и др., 2001;
Lupetin A.R. et al., 1985; Vaid Y. et
al., 1987; Graeter T. et al, 1993; Bec-
ker С et al., 1997; Rankin S.C., 1999].
Исследование мы проводили на
спиральном компьютерном томо-
графе «Tomoscan SR7000» фирмы
«Philips». После выполнения пря-
мой топограммы (сканограммы)
грудной клетки исследование про-
водили в режиме нормального ска-
нирования с шагом стола 5—10 мм.
Необходимо отметить, что нативная
КТ не позволяла выявить коаркта-
цию аорты. Она давала возможность
только ориентировочно оценить со-
стояние органов грудной клетки и
выбрать поле исследования для СКТ
с контрастированием. Начальная
граница исследования для СКТ с
контрастным усилением обязатель-
но включала плечеголовные сосуды,
конечная — зависела от ситуации,
но чаще всего исследование оканчи-
валось на уровне диафрагмального
контура сердца. Пациенту в кубита-
льную вену вводили от 30 до 80 мл
(в зависимости от массы тела боль-
ного) контрастного вещества (визи-
пак, ультравист) со скоростью 2—
3 мл/с. Задержка сканирования от
начала внутривенного введения
контрастного вещества составляла
20 с, ширина пучка — 5 мм, индекс
реконструкции — 4. КТ-признаками
коарктации аорты являются: 1) пря-
мыми — сужение аорты в типичном
месте; 2) косвенными — расшире-
ние восходящего отдела и дуги аор-
ты, изгиб аорты в начальной части
нисходящего отдела, постстенотиче-
ское расширение аорты, увеличение
диаметра межреберных и внутрен-
них грудных, а также плечеголовных
артерий, градиент контрастирова-
ния до и после коарктации.
Исследование показало, что СКТ
с болюсным усилением дает воз-
можность обнаружить коарктацию
любой степени: от полного переры-
ва (рис. 2.93) до умеренного суже-
ния. Коарктация аорты тубулярного
типа (рис. 2.94, а), выявляемая за
счет изменений наружного контура
аорты, достаточно легко определя-
ется при СКТ. Однако коарктацию
в виде мембраны по прямым при-
знакам обнаружить сложнее. Мемб-
рана редко выявляется на КТ ска-
нах. На этот тип коарктации указы-
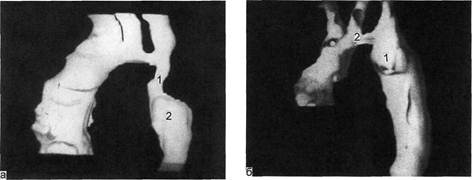
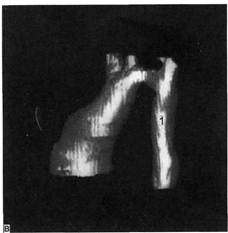
Рис. 2.94. Трехмерное изображение тубулярного типа коарктации.
а — до операции: 1 — место сужения; 2 — постстенотическое расширение; б — после опера-
ции — резекции аорты с анастомозом конец в конец: 1 — зона анастомоза; 2 — сохранивша-
яся гипоплазия дистальной части дуги аорты.
вают только косвенные признаки:
сужение по наружному контуру на
небольшом протяжении (0,5 см);
большое постстенотическое расши-
рение при небольшом сужении;
градиент контрастирования при не-
большой степени сужения; несоот-
ветствие большой величины гради-
ента давления между верхними и
нижними конечностями и малой
степенью сужения. Для лучшей ви-
зуализации мембранозного типа су-
жения необходимо уменьшать шаг
сканирования до 2—3 мм, а следо-
вательно, одновременно сокращать
протяженность зоны исследования.
Трудной для диагностики оказа-
лась гипоплазия аорты между левой
общей сонной и левой подключич-
ной артериями, так как сканирова-
ние дуги аорты ведется в продоль-
ном направлении. В этом случае
бывает трудно решить, имеется ли
истинная гипоплазия или в срез по-
пала только часть сечения дуги аор-
ты. Толщина выделяемого слоя при
реконструкции изображения в этом
случае должна быть не более 3—
4 мм. Обязательно построение
изображения 3D, которое является
основным в диагностике этой пато-
логии (см. рис. 2.94, б).
Спиральная КТ с болюсным вве-
дением контрастного вещества по-
зволяет построить трехмерное изоб-
ражение аорты, которое при коарк-
тации улучшает визуализацию зоны
поражения, дает возможность оце-
нить ее со всех сторон и наглядно
выявить дополнительные измене-
ния.
Неоднозначен взгляд на сужение
дистальной части нисходящего и
супраренального отделов аорты.
Во-первых, сужение возможно
вследствие аортита, при котором
стенка аорты значительно утолще-
на, а ее просвет резко сужен (см.
рис. 2.83). Во-вторых, сужение воз-
можно за счет врожденной гипо-
плазии, когда сужение аорты отме-
чается по наружному контуру (рис.
2.95) при нормальной толщине
стенки.
СКТ позволяет оценить результа-
ты оперативного вмешательства при
коарктации аорты. Если до опера-
ции как на продольных сканах, так
и при построении трехмерного
изображения определялось сужение
аорты, то после резекции суженного
участка и наложения анастомоза ко-
нец в конец восстанавливается про-
ходимость аорты, что определяется
на поперечных срезах и на трехмер-
ном изображении (см. рис. 2.94).
При этом исчезает престенотиче-
ский изгиб после отхождения левой
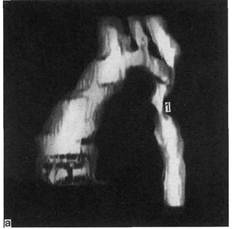
Рис. 2.95. Врожденная гипоплазия аор-
ты на уровне чревного ствола.
1 — диаметр аорты 5 мм; 2 — ножка диа-
фрагмы.
подключичной артерии. В случае
развития в отдаленные сроки после
операции рекоарктации участок су-
жения определяется в области ана-
стомоза. При выполнении истмо-
пластики заплатой, что было приня-
то в 60—80-е годы, на нативных
КТ-сканах выявляется уплотненный
пластический материал по задне-
латеральной поверхности аорты.
В случае его растяжения видно
аневризматическое выпячивание в
этой зоне, а при прорезывании
швов — свищ в средостение и в
бронх. При аллопротезировании по-
сле операции на месте коарктации
визуализируется кольцевидной фор-
мы протез с плотными стенками,
диаметром около 2 см, на протя-
жении 2—4 см, а на изображении
3D — исчезновение коарктации
(рис. 2.96). В случае прорезывания
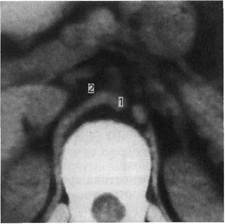
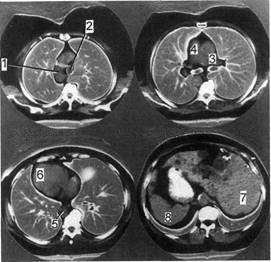
Рис. 2.96. Коарктация аорты.
а — до операции: трехмерная реконструк-
ция — зона сужения (1); б — после опера-
ции: томограмма — сосудистый протез в
виде кольцевидной структуры (1); в — после
операции: трехмерная реконструкция — от-
сутствие сужения (1).
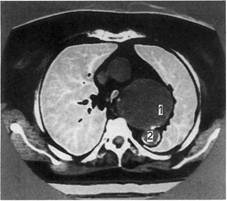
Рис. 2.97. Ложная аневризма (1) в об-
ласти анастомоза после аллопротезиро-
вания по поводу коарктации аорты.
Сосудистый протез (2).
швов, как правило, в области про-
ксимального анастомоза образуется
ложная аневризма (рис. 2.97). При
болюсном усилении контрастирует -
ся как аневризма, так и протез,
что указывает на его проходимость.
В последнее время возрос интерес к
оценке послеоперационных резуль-
татов в связи с появлением нового
вида оперативного вмешательства
при коарктации аорты — эндоваску-
лярной ангиопластики с помощью
вводимых в аорту баллонов [Илю-
хин В.В., Хаджибеков М.Х., 1990;
Allen H.D. et al., 1986; Erbel R. et al.,
1990]. С помощью спиральной КТ
можно оценить результаты баллон-
ной дилатации коарктации аорты.
Поперечные срезы и трехмерное
изображение свидетельствуют об
исчезновении суженного участка.
В некоторых случаях на поперечных
срезах определяется надрыв интимы
в зоне манипуляций. Однако возмо-
жен неполный разрыв мембраны
(или складки интимы) с сохранени-
ем градиента давления. В некото-
рых случаях после дилатации обра-
зуется аневризматическое расшире-
ние в зоне манипуляций, которое
четко выявляется при КТ-исследо-
вании.
Таким образом, спиральная КТ
позволяет обнаружить коарктацию,
оценить ее степень и выявить
послеоперационные осложнения.
СКТ не уступает по результативно-
сти ангиографии, является более
безопасным методом исследования,
особенно у маленьких детей, и дает
возможность оценить состояние
окружающих аорту органов грудной
клетки.
2.6.8. КТ-диагностика врожденных
заболеваний аорты
Врожденные аневризмы аорты
встречаются при синдроме Марфа-
на, когда вследствие мукоидной де-
генерации эластических структур
стенки развивается аневризма вос-
ходящего и(или) нисходящего отде-
ла аорты (рис. 2.98). При этом воз-
можно расслоение ее стенки.
Вследствие нарушения развития
шести пар артериальных жаберных
дуг, дорсальной и вентральной аорт
происходит неправильное форми-
рование дуги и отходящих от нее
плечеголовных артерий, при этом
возникает множество (более 20)
разнообразных вариантов аномаль-
ного строения артериального русла
в этой зоне, о чем может свидетель-
ствовать КТ-исследование. Наибо-
лее часто встречаются:
• правая дуга аорты;
• аномальное расположение ни-
сходящего отдела аорты;
• двойная дуга аорты;
• аномальное отхождение плече-
головных сосудов.
Правая дуга аорты на КТ-сканах
определяется справа от трахеи. По-
следовательный просмотр сканов
позволяет легко определить эту па-
тологию. В затруднительных случа-
ях быстрое (на 15-й секунде) и вы-
раженное контрастирование про-
долговатого и соответствующих
размеров образования справа от
трахеи дает основание установить
правую дугу аорты. Левая подклю-
чичная артерия при этом будет
определяться между трахеей и по-
звоночником. Нельзя забывать, что
справа от восходящего отдела аорты
должна находиться верхняя полая
вена, а слева — ствол легочной ар-
терии. Если эти сосуды расположе-
ны наоборот, то скорее всего речь
идет не о правой дуге, а о полной
инверсии органов (рис. 2.99).
Иногда справа от трахеи возмож-
но обнаружение продолговатого об-
разования, очень похожего на пра-
вую дугу аорты. Его наблюдение на
протяжении нескольких сканов по-
зволяет определить резко расши-
ренную (до 15—20 мм) непарную
вену. Обычно это встречается при
аномальном формировании нижней
полой вены, когда кровоток в серд-
це из нижней половины тела на-
правляется по непарной и полуне-
парной венам.
Праворасположенный (при ле-
вой дуге аорты) или леворасполо-
женный (при правой дуге аорты)
нисходящий отдел аорты достаточ-
но легко определяется на последо-
вательных сканах справа (или сле-
ва) и несколько кпереди от тел по-
звонков. Как правило, при этом не
требуется контрастного усиления.
Аномальное развитие восьмого сег-
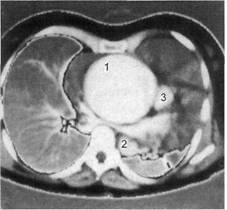
Рис. 2.98. Аневризма восходящего от-
дела аорты при болезни Марфана.
1 — аневризма; 2 — нисходящий отдел аор-
ты; 3 — ствол легочной артерии.
мента дорсальной аорты слева или
справа в сочетании с аномалией
четвертой артериальной дуги слева
или справа приводит к формирова-
нию двойной дуги аорты с необыч-
ным отхождением плечеголовных
артерий. Трахею и пищевод охва-
тывают спереди широкая левая, а
сзади — узкая правая дуги аорты
или, наоборот, широкая правая и
Рис. 2.99. Серия томограмм при
полной инверсии внутренних ор-
ганов.
1 — дуга аорты справа от трахеи — 2;
3 — верхняя полая вена слева от аор-
ты; 4 — ствол легочной артерии
справа от восходящего отдела аорты;
5 — нисходящий отдел аорты справа
от тел позвонков; 6 — верхушка серд-
ца направлена вправо; 7 — печень
слева; 8 — селезенка справа.
узкая левая дуги аорты. Варианты
отхождения плечеголовных арте-
рий многообразны.
2.6.9. КТ-диагностика заболеваний
артерий конечностей
Показанием к проведению компью-
терно-томографических исследова-
ний при заболеваниях артерий ко-
нечностей является развитие ише-
мии конечностей или наличие объ-
емных образований в мягких тка-
нях. Компьютерно-томографиче-
ская картина при атеросклерозе и
большинстве артериитов однотип-
на. На нативных сканах определя-
ется кальциноз артерий. При атеро-
склерозе он чаще сегментарный и
обнаруживается в крупных сосудах
(бедренной, подколенной, началь-
ной части артерий голени), при ар-
териитах, сопровождающихся каль-
цинацией оболочек сосудов, отло-
жения кальция наблюдаются на бо-
льшом протяжении и более выра-
жены в дистальных отделах, в ар-
териях голени. Передняя и задняя
большеберцовые, а часто и мало-
берцовая артерии на КТ-сканах
имеют вид цепочки кальцинатов.
Артерии на стороне поражения при
контрастном усилении проявляют-
ся с запозданием, а некоторые из
них вообще не контрастируются.
Появление контрастного вещества
в венах на стороне поражения от-
стает от его появления на здоровой
конечности. Длительная хрониче-
ская артериальная недостаточность
конечностей приводит к ишемиче-
ским изменениям мягких тканей.
Уменьшается толщина конечности,
мышечные пучки становятся тонь-
ше, прослойки жировой клетчатки
между ними и отдельными мышца-
ми увеличиваются. Снижается об-
щая плотность мышц (до 25—
35 ед.Н.). При острой ишемии из-за
отека конечность увеличивается в
сечении, структура мышечной тка-
ни исчезает, плотность всех или от-
дельных мышц уменьшается. При
наложенных шунтах (бедренно-
подколенных, бедренно-тибиаль-
ных) с помощью КТ-исследования
с болюсным контрастным усилени-
ем можно оценить проходимость и
эффективность этих шунтов. Если
при ишемии на стопе наложен ар-
териовенозный шунт, то на КТ-ска-
нах определяется раннее и выра-
женное поступление контрастного
вещества в вены голени по сравне-
нию с неоперированной стороной.
Необходимо помнить, что при вы-
полнении спиральной КТ начало
сканирования от начала внутривен-
ного введения контрастного веще-
ства должно запаздывать на 40 с
для бедра и на 50 с для голени.
Трудности возникают при КТ-ис-
следовании верхних конечностей,
так как при расположении их вдоль
тела одновременно сканируется
грудная и брюшная полости, а так-
же таз, а при положении рук за го-
ловой — головной мозг, что неже-
лательно.
Травматические повреждения ар-
терий сопровождаются образовани-
ем травматических ложных анев-
ризм. При КТ-исследовании конт-
растным веществом одновременно
с артериями заполняется полость,
примыкающая к сосуду и имеющая
толстые стенки. Возможно возник-
новение аневризм и без травмы, а
в результате атеросклеротического
или воспалительного изменения
стенки сосуда, при этом аневризмы
являются истинными. Чаще всего
их можно обнаружить в подколен-
ной области (рис. 2.100).
Тромбозы магистральных арте-
рий (подвздошных, бедренных,
подколенных, сонных) определяют-
ся с помощью КТ-исследований
достаточно легко. Тромбированная
артерия в сечении сохраняет круг-
лую форму, ее содержимое приоб-
ретает низкую плотность (25—
35 ед.Н.) и не контрастируется в от-
личие от аналогичной артерии про-
тивоположной стороны.
2.6.10. КТ-диагностика
ангиодисплазий
Впервые КТ для диагностики ан-
гиодисплазий применили Mitty и
Kleiger (1978). КТ-картина ангио-
дисплазий складывается из нали-
чия в подкожной жировой клетчат-
ке множества мелких (3—10 мм)
узелковых образований плотностью
10—40 ед.Н. и тонких полосок
(толщиной 2—3 мм, длиной 3—
5 мм), являющихся расширенными
сосудами в срезе. Внутри узелков
встречаются кальцинаты. При рас-
пространении ангиодисплазий на
мышцы плотность их снижается,
толщина мышечных пучков умень-
шается, несмотря на общее утол-
щение мышцы (рис. 2.101). При
внутривенном усилении плотность
ангиоматозных узлов повышается.
Иногда удается обнаружить один
из главных питающих сосудов.
Считается, что КТ не может диф-
ференцировать артериовенозную и
венозно-кавернозную формы ан-
гиодисплазий. Мы можем предло-
жить ряд признаков для этой цели.
Для артериовенозной формы более
характерны мелкие узловые обра-
зования в подкожной жировой
клетчатке, быстрое накопление в
них контрастного вещества, раннее
появление контрастного вещества
в отводящей вене по сравнению с
противоположной аналогичной ве-
ной, наличие небольшого количе-
ства и мелких (1—3 мм) флеболи-
тов. При венозно-кавернозной
форме узловые образования более
крупные, сливающиеся, с менее
четкими контурами, содержат бо-
льшое количество крупных (5—
10 мм) флеболитов, накапливают
контрастное вещество в отсрочен-
ную фазу (рис. 2.102).
Считается, что КТ в 97 % случаев
определяет локализацию, размеры
ангиодисплазий, степень вовлече-
ния мягких тканей, глубину пора-
жения и топографоанатомические
взаимоотношения в зоне пораже-
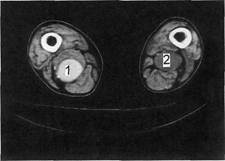
Рис. 2.100. Аневризмы подколенных
областей после внутривенного введе-
ния контрастного вещества.
1 — в аневризме правой подколенной арте-
рии контрастируется просвет и определяется
пристеночный тромб; 2 — тромбированная
аневризма левой подколенной артерии.
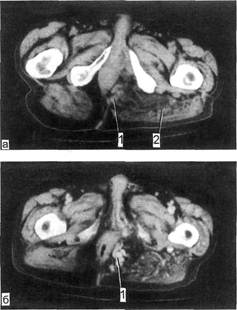
Рис. 2.101. Артериовенозная форма ан-
гиодисплазий промежности.
а — нативный скан: 1 — узелковые образо-
вания в жировой клетчатке; 2 — мышцы с
измененной структурой; б — скан после
внутривенного усиления: 1 — контрастиру-
ются ангиоматозные узлы в жировой клет-
чатке и мышцах.
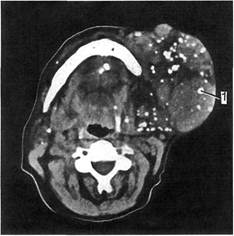
Рис. 2.102. Венозно-кавернозная фор-
ма ангиодисплазии лица и подчелюст-
ной области.
1 — множество крупных ангиоматозных уз-
лов, содержащих большое количество круп-
ных флеболитов.
ния [Лукьянченко А.Б., 1991; Кар-
мазановский Г.Г., 1993; Шу-
бин А.А., 1996].
2.6.11. КТ-диагностика заболеваний
магистральных вен1
Верхняя полая вена образуется из
слияния левой и правой плечего-
ловных вен. На компьютерных то-
мограммах левая плечеголовная
вена расположена в переднем сре-
достении на уровне дуги аорты, но
может располагаться на уровне пе-
рехода восходящего отдела аорты в
дугу, а иногда перед плечеголовны-
ми артериями. Вена попадает в срез
в продольном направлении и, как
правило, определяется отдельными
участками. Отмечается ее неболь-
шое сужение в переднезаднем на-
правлении на уровне пересечения с
аортой. Правая плечеголовная вена
короче левой, на КТ-сканах в попе-
речном срезе имеет вид овала или
круга. Впадающие в плечеголовные
вены внутрение грудные вены, вена
вилочковой железы и нижние вены
щитовидной железы на КТ-сканах
не определяются даже при контра-
стном усилении. Верхняя полая
вена расположена в переднем сре-
достении. Диаметр ее 2—2,5 см,
длина 5—6 см. На КТ-сканах (см.
рис. 2.67) она прилежит к правозад-
ней поверхности стенки восходя-
щего отдела аорты. Кзади к вене
прилежит правая ветвь легочной
артерии, за ней — правый главный
бронх, в дистальном отделе сзади —
правая верхняя легочная вена, лате-
рально — париетальная плевра и
легкое, впереди — легкое и в диста-
льном отделе — ушко правого пред-
сердия, после чего вена вливается в
правое предсердие. Форма вены в
сечении меняется от круглой в про-
ксимальной части до овальной и
полулунной в дистальном сегменте.
Во внутриутробном периоде в
случае сохранения дистальной час-
ти левой общей яремной вены и ле-
вого кювьерова протока формиру-
ется вторая (левая) верхняя полая
вена, впадающая в коронарный си-
нус. У больного в этом случае на
КТ-сканах определяется добавоч-
ная левая верхняя полая вена, кото-
рая собирает кровь из верхней ле-
вой половины тела. На сканах (рис.
2.103) она обнаруживается сначала
в переднем средостении слева от
дуги аорты, далее спереди от левой
ветви легочной артерии и верхней
левой легочной вены, а затем пово-
рачивает к задней стенке левого
предсердия, после чего эта вена не
дифференцируется от сердца (на
месте впадения в коронарный си-
нус). Исследование желательно
проводить после внутривенного
введения контрастного вещества в
левую кубитальную вену. Начало
1 Раздел написан в соавторстве с докт.
мед. наук Е.Б.Гузеевой.
сканирования — через 7 с после на-
чала введения контрастного веще-
ства.
В норме наружные яремные вены
впадают в подключичные вены са-
мостоятельными стволами, внут-
ренние яремные вены, сливаясь с
подключичными венами, образуют
плечеголовные вены. При сохране-
нии внутриутробного варианта на-
ружные яремные вены могут впа-
дать во внутренние яремные вены
на шее, что приводит к расшире-
нию как наружных вен, так и дис-
тальных участков внутренних ярем-
ных вен. Больные в этом случае об-
ращаются с жалобами по поводу
образований на шее, которые набу-
хают при наклонах и натуживании.
Увеличение диаметра внутренних
яремных вен, однако, чаще связано
с нарушением оттока крови по ним
вследствие сдавления венозной си-
стемы в средостении. Уменьшение
же калибра одной из внутренних
яремных вен возможно при резком
сужении или тромбозе внутренней
сонной артерии с той же стороны.
Нижняя полая вена (НПВ) — са-
мый большой венозный ствол чело-
веческого тела, она собирает кровь
от нижних конечностей, органов и
стенок таза и брюшной полости.
Располагается НПВ забрюшинно;
начинается на правой переднебоко-
вой поверхности IV—V поясничных
позвонков из слияния двух общих
подвздошных вен и от места своего
начала следует вверх к отверстию
полой вены в диафрагме.
На аксиальных КТ-срезах попе-
речное сечение нижней полой
вены, имеющее форму овала или
круга, постепенно увеличивается от
начала к диафрагме. Контуры вены
всегда ровные, четкие, стенка ее не
определяется. В краниальном отде-
ле вена отклоняется вправо и кпе-
реди от своего начального хода, со-
относясь с положением вырезки
заднего края печени и собственного
отверстия в диафрагме. Медиальная
стенка вены на большом протяже-
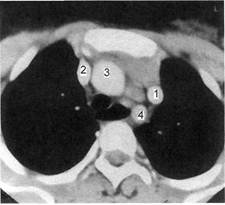
Рис. 2.103. Добавочная левая верхняя
полая вена. Томограмма.
1 — добавочная левая верхняя полая вена;
2 — правая верхняя полая вена; 3 — восхо-
дящий отдел аорты; 4 — нисходящий отдел
аорты.
нии прилежит к аорте и отграниче-
на от нее тонкой жировой прослой-
кой. Задняя стенка в каудальных
отделах соприкасается с фасциями
большой поясничной мышцы. Кра-
ниальнее НПВ граничит с правой
ножкой диафрагмы. Позади вены
проходят.правые поясничные арте-
рии, которые не всегда видны на
аксиальных срезах, и правая почеч-
ная артерия. На этом уровне вена
представляется расширенной, от-
клоняется немного вправо и прохо-
дит впереди медиального края пра-
вого надпочечника. Почечные вены
впадают в нижнюю полую вену
почти под прямым углом на уровне
первого поясничного позвонка. Ле-
вая вена впадает в НПВ несколько
выше правой. С этого уровня ниж-
няя полая вена лежит в вырезке
заднего края печени и играет роль
анатомического ориентира при сег-
ментарном делении печени. На пе-
редней поверхности вены в каудо-
краниальном направлении распола-
гаются корень брыжейки тонкой
кишки и правая яичковая артерия,
которые в норме, как правило, не
определяются, затем нижнегори-
зонтальная часть двенадцатиперст-
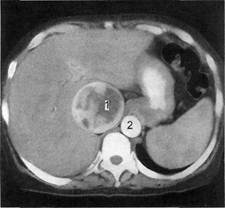
Рис. 2.104. Томограмма после внутри-
венного контрастирования.
1 — тромб в нижней полой вене; 2 — аорта.
ной кишки, над которой находится
головка поджелудочной железы и
частично нисходящая часть двенад-
цатиперстной кишки. Краниальнее
проходит корень брыжейки попе-
речной ободочной кишки, в норме
также не визуализирующийся. Са-
мый краниальный конец вены рас-
ширен и с трех сторон окружен па-
ренхимой печени — так называе-
мый печеночный синус. Печеноч-
ные вены впадают в НПВ по выхо-
де из паренхимы, по заднему краю
печени. Краниальнее вена проходит
через отверстие полой вены диа-
фрагмы и, попадая в полость пери-
карда, сразу же впадает в правое
предсердие.
В НПВ впадают пристеночные
вены (поясничные, правая надпо-
чечниковая, правая яичковая или
яичниковая и нижняя диафрагма-
льная), которые обычно не выявля-
ют при КТ.
Исследование вен таза и нижней
полой вены желательно выполнять
на спиральном компьютерном то-
мографе. Задержка при сканирова-
нии должна составлять для краниа-
льного участка нижней полой вены
40 с, для вен таза и каудального
участка нижней полой вены — 60 с.
Соответственно току крови КТ-ис-
следование НПВ проводят в кау-
докраниальном направлении. Одна-
ко в структуре исследования брюш-
ной полости НПВ, как правило, ча-
стично или на всем протяжении по-
падает в зону сканирования, и тог-
да исследование обычно проводят в
краниокаудальном направлении.
Наиболее часто встречающейся
патологией НПВ и ее ветвей явля-
ется их тромбоз. На нативных
КТ-сканах при тромбозе наружной
или общей подвздошной вены
определяются расширенная вена на
стороне поражения и низкая плот-
ность ее содержимого (25—30 ед.Н.)
по сравнению с таковыми на про-
тивоположной стороне. При введе-
нии контрастного вещества в куби-
тальную вену подвздошные вены на
стороне поражения не контрастиру-
ются. Примерно в 1/3случаев тром-
боз общей подвздошной вены рас-
пространяется на нижнюю полую
вену. Непроходимость или окклю-
зия НПВ может быть частичной,
ограниченной, полной, распростра-
ненной с появлением синдрома
нижней полой вены. Тромбоз инф-
раренального отдела НПВ встреча-
ется сравнительно часто. Более ред-
ко встречается изолированный
тромбоз почечного и печеночного
отделов НПВ. Реже окклюзия НПВ
развивается вследствие сдавления
(прорастания) ее опухолью забрю-
шинного пространства или при
идиопатическом забрюшинном
фиброзе (болезнь Ормонда). Казу-
истической редкостью являются
опухоли, исходящие из венозной
стенки (лейомиома, лейомиосарко-
ма), которые могут сочетаться с
тромбозом вены. При гипернефро-
идном раке почки, особенно пра-
вой, возможно распространение так
называемого опухолевого тромба из
почечной вены в НПВ (рис. 2.104).
Повреждения НПВ обычно соче-
таются с повреждением органов
брюшной полости, что сопровожда-
ется развитием забрюшинной или
паравазальной гематом.
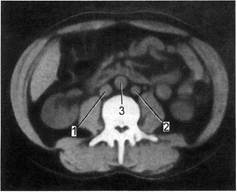
Рис. 2.105. Удвоение проксимальной
части нижней полой вены.
1 — правая нижняя полая вена; 2 — левая
нижняя полая вена; 3 — аорта.
Пороки развития. Нижняя полая
вена формируется из двух участ-
ков — короткого краниального и
более длинного каудального. Гра-
ницей между ними являются почеч-
ные вены. Краниальный участок за-
кладывается как непарный сосуд,
идущий к сердцу справа от аорты.
На каудальном конце этот сосуд че-
рез анастомозы соединяется с дву-
мя кардинальными венами, из ко-
торых кровь поступает в него. В по-
следующем из каудальной части
правой кардинальной вены образу-
ется каудальный участок нижней
полой вены, а каудальная часть ле-
вой кардинальной вены облитери-
руется. В случае облитерации кау-
дальной части правой кардиналь-
ной вены начальная часть нижней
полой вены не формируется. Кро-
воток из нижней половины тела на-
правляется по расширенным непар-
ной и полунепарной венам в верх-
нюю полую вену, а далее в сердце.
Кровь от почек и печени оттекает в
сердце по краниальному участку
нижней полой вены. В случае от-
сутствия облитерации не только
правой, но и левой кардинальной
вены происходит удвоение началь-
ной части нижней полой вены (рис.
2.105). При этом для точной диа-
гностики необходимо выявить не
только две вены справа и слева от
инфраренального отдела аорты, но
и место их слияния. Нижняя полая
вена в случае облитерации только
правой кардинальной вены может
иметь и частичное левостороннее
положение. В этом случае на уров-
не впадения левой почечной вены
она перегибается через аорту и впа-
дает в краниальный участок ниж-
ней полой вены. Редкой аномалией
является отсутствие почечно-пече-
ночного сегмента нижней полой
вены: его заменяет непарная вена, а
печеночные вены единым стволом
впадают в правое предсердие.
Таким образом, компьютерная
томография, особенно спиральная
КТ с болюсным введением контра-
стного вещества автоматическим
инъектором, является современным
высокоинформативным методом
диагностики заболеваний сосуди-
стой системы.
Литература
Беленков Ю.Н., Беличенко О.И., Сини-
цын В.Е. Магнитно-резонансная томогра-
фия в диагностике аневризм и коаркта-
ций аорты//Вестн. радиол. — 1991. —
№ 3. - С. 56-60.
Илюхин В.В., Хаджибеков М.Х. Рентгено-
эндоваскулярная дилатация коарктации
аорты//ВРИР. - 1990. - № 5. - С. 164—
169.
Кармазановский Г.Г., Федоров В.Д. Компь-
ютерная томография поджелудочной же-
лезы и органов забрюшинного простран-
ства // КТ диагностика заболеваний
брюшного отдела аорты. — М.: Паганель,
2000. - С. 164-196.
Кармазановский Г.Г., Дан В.Н., Скуба Н.Д.
КТ характеристика ангиодисплазий с ан-
гиоматозом мягких тканей//ВРИР. —
1993. - № 2. - С. 37-43.
Королев Б.А., Охотин И.К, Соловьев СИ.
и др. Хирургическое лечение коарктации
аорты у взрослых больных//Вестн. хир. —
1976. - № 2. - С. 3-6.
Никитаев И. С, Кармазановский Г.Г., Чер-
няк Б.Б. Коарктация аорты — возможно-
сти спиральной КТ // Мед. визуализа-
ция. - 2001. - № 1. - С. 54-61.
Покровский А.В. Коарктация аорты//Кли-
ническая ангиология. — М.: Медицина,
1979. - С. 63-82.
Рабкин И.Х., Овчинников В.И., Юдин А.А.
Диагностика аневризм аорты с помощью
КТ // Хирургия. - 1983. - № 10. -
С. 134-137.
Синицин В. Е., Дадвани С.А., Артюхи-
на Е.Г. и др. Компьютерная томографиче-
ская ангиография в диагностике атероск-
леротических поражений аорты и артерий
нижних конечностей//Ангиол. и сосуд.
хир. - 2000. - Т.6, № 2. - С. 37-44.
Черняк Б.Б., Коростелев А.Н., Кармазанов-
ский Г.Г. и др. Спиральная компьютерная
томография с контрастным усилением в
диагностике и предоперационном плани-
ровании коррекции коарктации аорты и
ее осложнений//Межд. мед. журн. —
2000. - № 6. - С. 502-508.
Adachi H., /по Т., Ide H. et al. Preoperative
diagnosis of the thoracic aortic aneurysm by
three-dimansional CT angiography//!. Jap.
Associat. Thorac. surg.— 1993.— Vol. 41.—
P. 1478-1486.
Allen H.D., Marx G.T., Ovit T.W. et al. Bal-
loon dilatation angioplasty for coarctation of
the aorta//Am. J. Cardiol. - 1986. - Vol.
57. - P. 828-832.
Balm R., Eikelboom B.C., van Leeuwen M.S.
et al. Spiral CT-angiography of the aorta//
Europ. J. Vase. surg. — 1994. — Vol. 8. —
P. 544-551.
Becker C, Soppa C, Fink U. et al. Spiral CT
angiography and 30 reconstruction patients
with aortic coarctation//Europ. Radiol. —
1997. - Vol. 7. - P. 1473-1478.
Belair N., Soulez G., Oliva V. et al. Aortic
graft infection: the value of percutaneous
dgainage//AJR. - 1998. - Vol. 171. -
P. 119-124.
Bradshaw K.A., Pagano D., Bonser R.S. et al.
Multiplanar reformatting and three-dimensi-
onal reconstraction: for pre-operative asses-
ment of the thoracic aorta by computed to-
mography//Clin. Radiol. - 1998. - Vol.
53. - P. 198-202.
Cholankeril J.V., Ketyer S., Cholankeril M.V.
CT detection of coarctation of the aorta//J.
Comput. Tomogr. - 1981. — Vol. 5, N 4. —
P. 355-358.
Dapunt O.E., de Asia R.A., Griepp E.B. et al.
Computer-generated 3D representations of
the aorta: a new tool in the managememt of
aortic aneurysm patients//J. Thorac. Cardio-
vasc. Surg. - 1994. - Vol. 42. - P. 25-28.
Edwards F.H., Wind G, Thompson L. et al.
Threedimensional image recostruction for
planning of a complex cardiovascular proce-
dure//Ann. Thorac. surg. — 1990. — Vol.
49. - P. 486-488.
Erbel R., Bednarezyk J., Pop T. et al. Detec-
tion of dissection of the aortic intima and
media after angioplasty coarctation of the
aorta. An angiographic, computertomograp-
hic, and echocardiographic comparative stu-
dy//Circulation. - 1990. - Vol. 81. - P.
805-814.
Farmer D.W., Lipton M.J., Webb W.R. et al.
Computed tomography in congenital heart
disease // J. Comput. Assist. Tomogr. —
1984. - Vol. 8, N 4. - P. 677-687.
Fritschen U., Malzfeld E., Clasen A., Kort-
mann H. Inflammatory abdominal aortic
aneurysm: A postoperative course of retrope-
ritoneal fibrosis//J. Vase. surg. — 1999. —
Vol. 30, N 6. - P. 1090-1098.
Garant M.L., Menke P.G., Fabian T. et al.
Hellical CT of the chest to detect blunt trau-
matic aortic rupture//Radiology. — 1995. —
Vol. 197. - P. 125-133.
Godwin J.D., Her/kens R.J., Brundage B.H. et
al. Evaluation of coarctation of the aorta by
computed tomography//J. Comput. To-
mogr. - 1981. - Vol. 5, N 2. - P. 153-
156.
Graeter Т., Schaefer C, Prokop M. et al.
Three demensional vascular imaging — an
additional diagnostic tool//Thorac. Cardio-
vasc. surg. - 1993. - Vol. 41, N 3. —
P. 250-253.
Johnson K.K., Russ P.D., Bair J.H., Frie-
feld G D. Diagnosis of synthetic vascular graft
infection: comparision with CT and gallium
scans//AJR. - 1990. - Vol. 154. -
P. 405-409.
Lupetin A.R., Dash N., Beckman I. Coarctati-
on of the aorta associate with intercostal ar-
tery aneurysms — computed tomography di-
agnosis//!. Comput. Tomogr. — 1985. —
Vol. 5, N 2. - P. 145-152.
Low R.N., Wall S.D., Jeffrey R.B. et al. Aor-
toenteric fistula and perigraf infection: evalu-
ation witt CT//Radiology. — 1990. - Vol.
175. - P. 157-162.
Marchal G, Bogaert J. Non-invasive imaging
of the graet vessels of the chest//Eur. Radiol.
- 1998. - Vol. 8, N 7. - P. 1099-1105.
Orton D.F., Le Veen R.F., Saigh J.A. et al.
Aortic prosthetic graft infection: radiologic
manifestation and managemant//Radiograp-
hics.- 2000.- Vol. 20, N 4.- P. 977- 993.
Oudkerk M., Overbosch E., Dee P. CT recog-
nition of acute aortic dissection//Am. J.
Rentgenol. - 1983. - Vol. 141. - P. 671 —
676.
Rankin S.C. CT angiography//Eur. Radiol.—
1999. - Vol. 9, N 2. - P. 297-310.
Seror 0., Fain 0., Dordea M. et al. Aortitis
with antiphospholipid antibodies: CT and
MR findings//Eur. Radiol. - 1998. - Vol.
8, N8. - P. 1373-1378.
Sultan S., Duffy S., Madhavan P. et al. Fifte-
en-year experience of transperitoneal mana-
gement of inflammatory abdominal aortic
aneurysms//Eur. J. Vase. Endovasc. surg. —
1999. - Vol. 18, N 6. - P. 510-514.
Qanadli S.D., Mesurolle В., Hajjam M. et al.
Helical computed tomography of the aorta
and its branches//.!. Radiol. — 1999. — Vol.
80, N 9. - P. 998-1010.
Vaid Y, Shin M.S., Soto B. Role of compu-
ted tomography in nonobstructive coarctati-
on//.!. Comput. Tomogr. — 1987. — Vol. 11,
N 1. - P. 95-103.
Yamada N.A. J. Cardiogr. — 1984. - Vol.
14, N 3. - P. 577-585.
2.7. Томографические методы исследования
сосудистой системы
Магнитно-резонансная томография
(MPT) и рентгеновская компьютер-
ная томография (КТ) в настоящее
время все шире применяются для
исследований сосудов.
Стандартные системы КТ
(3—4-го поколений) применялись в
основном для диагностики анев-
ризм аорты, тромбоэмболии легоч-
ной артерии. Настоящий расцвет
ангиографических исследований с
помощью МРТ и КТ произошел
после создания методик МР-анги-
ографии (МРА) и КТ-ангиографии
(КТА). Широкое использование то-
мографических методов исследова-
ний сосудов привело к тому, что
традиционная рентгеноконтрастная
ангиография все реже используется
с диагностическими целями и все
чаще — для интервенционных вме-
шательств.
2.7.1. Магнитно-резонансная
ангиография
Магнитно-резонансная ангиогра-
фия (МРА) стала применяться с
конца 80-х годов. На сегодняшний
день МРА используется для иссле-
дования практически всех сосуди-
стых бассейнов человеческого орга-
низма. Основное достоинство МРА
состоит в том, что сосудистые
структуры могут визуализироваться
с точностью до малейших деталей
без использования контрастных
средств в двухмерном или трехмер-
ном (3D) формате. При примене-
нии специальных методик МРТ
можно количественно определить
кровоток и его направление (по-
добно ультразвуковой допплерогра-
фии).
Физические принципы МРА и им-
пульсные последовательности. При
МРТ движущаяся кровь является
естественным контрастом. Кровь
может давать сигнал высокой или
низкой интенсивности в зависимо-
сти от скорости, характера и на-
правления потока, а также от при-
меняемой импульсной последовате-
льности. Для МРА используют
ускоренные, так называемые гради-
ентные последовательности с уме-
ньшенным углом отклонения век-
тора намагниченности (FLASH,
FISP, GRASS и им подобные) с ма-
лым временем повторения импуль-
сов (TR) — менее 100 мс, обычно
20—40 мс, очень коротким време-
нем эха (ТЕ) — 1 — 12 мс и неболь-
шим углом отклонения вектора на-
магниченности (обычно 20—60°).
Применяют двух- или трехмерные
импульсные последовательности.
Импульсные последовательности
оптимизированы таким образом,
что движущаяся кровь имеет мак-
симальную интенсивность сигнала,
а неподвижные ткани — низкую.
Обе методики МРА основаны на
двух главных параметрах, определя-
ющих интенсивность изображения
движущейся крови при МР-иссле-
дованиях. Первая — времяпролет-
ная МРА (TOF — time-of-flight) -
использует время перемещения бо-
люса крови из одной области в дру-
гую за интервал между возбуждаю-
щим и рефокусирующим радиочас-
тотными импульсами. Вторая ме-
тодика МРА — фазоконтрастная
(PC — phase contrast) — использует
для получения высокого сигнала от
движущейся крови фазовый сдвиг
спинов за определенный промежу-
ток времени. Особенностью МРА
является выбор размещения облас-
тей предварительного насыщения
сигнала (пресатурации). Они при-
меняются для селективного выделе-
ния артериальных или венозных со-
судов.
Недостаток МРА заключается в
возможности «выпадения» сигнала
от кровотока из-за артефактов, тур-
булентностей, малого калибра сосу-
дов, насыщения сигнала от движу-
щихся спинов и других причин. Это
может приводить к переоценке сте-
пени стеноза или ложноположите-
льным заключениям. Пространст-
венное разрешение метода (0,5—
1 мм) существенно ниже, чем у тра-
диционной ангиографии.
MP-ангиография с контрастным
усилением. Для устранения арте-
фактов и сокращения времени ис-
следования в последние годы все
большую популярность приобретает
МРА с контрастным усилением.
Для этой цели используют хелаты
гадолиния (гадолиний-ДТПА или
ДТПА-БМА), которые вводят бо-
люсно на задержке дыхания. Обыч-
но применяют градиентные трех-
мерные последовательности с ори-
ентацией реконструируемых срезов
во фронтальной плоскости, что по-
зволяет получать качественные ан-
гиограммы исследуемых сосудов на
большом протяжении без артефак-
тов от дыхания. Желательно испо-
льзование автоматического инъек-
тора.
Для расчета времени начала запу-
ска импульсной последовательно-
сти желательно определение време-
ни прибытия болюса контрастного
вещества к первому срезу исследуе-
мой области. Программное обеспе-
чение томографа дает возможность
получать график интенсивность-
время и определять время прибы-
тия болюса. При введении основ-
ной дозы гадолиния (можно приме-
нять дозу 20 мл, однако более каче-
ственные изображения получают
при применении 30—40 мл) задерж-
ку начала введения препарата после
запуска импульсной последователь-
ности рассчитывают по специаль-
ным формулам. Наиболее простой
является следующая: время задерж-
ки введения препарата равно поло-
вине времени циркуляции болюса
плюс 4 с. В этом случае максималь-
ная концентрация препарата в аор-
те создается во время середины
сбора данных, что обеспечивает оп-
тимальное контрастирование сосу-
дов на MP-изображениях. Появи-
лись специальные импульсные по-
следовательности для автоматиче-
ского запуска МРА после улавлива-
ния программным обеспечением
прибора повышения интенсивности
сигнала (под воздействием гадоли-
ния) в области интереса.
В последнее время новым шагом
в развитии этой методики стало
применение автоматического дви-
жения стола, синхронизированного
со скоростью движения болюса и
выполнением импульсной последо-
вательности, что дает возмож-
ность получать высококачествен-
ные изображения больших анато-
мических областей с продольным
ходом сосудов при одном введении
контрастного вещества. Несмотря
на то что МРА с контрастным уси-
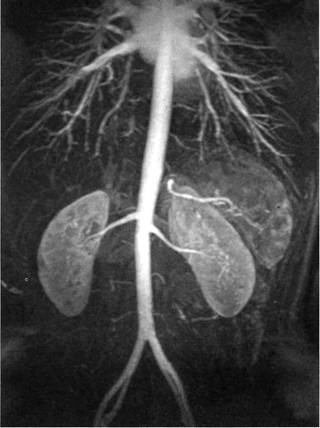
Рис. 2.106. МРА брюш-
ной аорты с контрастным
усилением гадолинием.
лением существенно дороже, чем
обычная МРА, все тенденции раз-
вития MP-оборудования и его кли-
нического использования показы-
вают, что болюсное контрастирова-
ние становится ведущей методикой
MP-ангиографии брюшной аорты и
ее ветвей. Ожидается, что примене-
ние новых внутрисосудистых конт-
растных препаратов, таких как кла-
рискан фирмы «Никомед Амер-
шем» или ангиомарк фирмы «Мал-
линкродт» и подобных им, позво-
лит повысить качество МР-ангио-
грамм и увеличить временное
«окно» для выполнения МРА с
контрастированием (рис. 2.106).
Измерение скорости кровотока.
МРТ чувствительна к эффектам
кровотока. Это дает возможность
создать импульсные последователь-
ности, позволяющие количественно
определять скорость движения кро-
ви в сосудах. Импульсные последо-
вательности, служащие для количе-
ственного определения скорости
кровотока, основаны на времяпро-
летном эффекте и фазовых сдвигах,
возникающих при движении прото-
нов крови в сосудах. Наиболее рас-
пространенной является двухмер-
ная фазоконтрастная методика из-
мерения скорости кровотока. Она
основывается на том факте, что фа-
зовый сдвиг поперечной намагни-
ченности движущихся протонов во
время выполнения исследования
пропорционален их скорости. При
этом применяют градиентную по-
следовательность для кино-МРТ
(FLASH), синхронизированную с
ЭКГ, без градиентной компенсации
эффектов кровотока в плоскости
выбора среза. В этом случае полу-
чают серию двухмерных изображе-
ний, где интенсивность отдельных
пикселов соответствует скорости
кровотока. Кровь, движущаяся к
наблюдателю, выглядит светлой, а
от него — темной. При компьютер-
ной обработке данных величину
фазового сдвига пересчитывают в
абсолютные значения скорости
движения крови по сосуду с учетом
направления ее движения. Поме-
щая область интереса на исследуе-
мый сосуд, компьютер томографа
строит график изменения скорости
движения крови на протяжении
сердечного цикла через выбранную
площадь. Если выбрать область ин-
тереса равной поперечному сече-
нию сосуда, то, используя значения
интеграла площади под кривой,
можно рассчитать минутный объем
кровотока через выбранный сосуд.
Дата добавления: 2015-02-06 | Просмотры: 1011 | Нарушение авторских прав
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|