|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Аневризма восходящей аорты
Симптомы и признаки. Большинство аневризм восходящей аорты выявляются случайно во время рентгенографии грудной клетки или при использовании других методов визуализации, применяемых для диагностики различных заболеваний. Около 25—30 % пациентов жалуются на боль в грудной клетке, которая обычно локализуется пре-кардиально с иррадиацией в шею и нижнюю челюсть при вовлечении в патологический процесс дуги аорты. В то же время 75 % пациентов с острым расслоением аорты отмечают сильную боль, локализующуюся обычно в спине. Иногда определяется синдром верхней полой вены, сопровождающийся одышкой и непродуктивным кашлем. Охриплость голоса свидетельствует о поражении дуги и/или проксимальных отделов нисходящей аорты. Физикальное исследование. Число физикальных признаков заболевания не столь велико. Аневризмы больших размеров порождают эктопическую пульсацию, пальпируемую на передней стенке грудной клетки, вызывают узурацию ребер, выбухание грудной клетки и кожи. При наличии аортальной регургитации определяются высокое пульсовое давление, дефицит пульса, а также диастолический шум, выслушиваемый обычно парастернально. Инструментальные методы диагностики. Распознавание аневризмы восходящего отдела аорты не представляется трудной задачей и может быть достигнуто уже при использовании обычных диагностических методов. В то же время определенные, а иногда значительные трудности возникают при диагностике расслоения аортальной стенки и его протяженности. Электрокардиография. Электрокардиограмма может оставаться нормальной. При наличии аорталь-
Рис. 5.17. Аневризма восходящей аорты. ной регургитации определяются признаки левожелудочковой гипертрофии и перегрузки. Признаки ишемии миокарда могут наблюдаться у пациентов с расслаивающей аневризмой вследствие перекрытия отслоившейся интимой устьев коронарных артерий. Рентгенография органов грудной клетки. Как отмечено выше, многие бессимптомные аневризмы удается выявить во время рентгенографии. Расширение средостения в сочетании с дислокацией трахеи и пищевода на рентгенограмме в прямой проекции может свидетельствовать о наличии аневризмы. Аневризмы восходящего отдела аорты могут давать выпуклый контур в правом верхнем средостении (рис. 5.17). Тень грудины часто затеняет расширенную аорту в переднезадней проекции. В боковой проекции нередко определяется уменьшение ретростернального воздушного пространства. В тени артериальной стенки могут определяться глыбки кальция. Аневризмы, ограниченные корнем аорты и синусами Вальсальвы, иногда затеняются сердцем. Эхокардиография (Эхо КГ) — чрезвычайно важный метод диагностики аневризм восходящей аорты и контроля над ними. Дилатация корня аорты или аневризма восходящей аорты с клапанной регурги-тацией могут быть впервые обнаружены во время эхокардиографиче-ского исследования. При подозрении на острое расслоение при трансторакальной ЭхоКГ могут определяться признаки гемопери-карда. Несмотря на простоту и доступность перечисленных выше методов, полученная с их помощью информация остается ограниченной. При трансторакальной ЭхоКГ не удается оценить состояние дуги аорты и ее ветвей, а при рентгенографии невозможно получить представление о морфологии и замыка-тельной функции аортального клапана. Оба метода малоинформативны при расслоении аортальной стенки, но оказываются ценными в качестве первых диагностических
Рис. 5.18. Чреспищеводная ЭхоКГ: расслоение аортальной стенки (а, б). 1 — ложный просвет; 2 — истинный просвет. процедур, позволяющих врачу заподозрить патологию аорты и рекомендовать пациенту дальнейшее обследование в специализированном отделении. Чреспищеводная ЭхоКГ является быстрым и точным методом визуализации, позволяющим получить более подробную информацию о состоянии восходящей аорты и в более высоком проценте наблюдений (до 90 %) распознать расслоение аортальной стенки (рис. 5.18), тромботические массы в ложном просвете аорты или интрамураль-ной гематомы, а также более детально оценить морфологию аортального клапана, что может оказаться ценным при выборе метода хирургической коррекции, в частности определении возможности проведения клапансберегающих операций. Четкая визуализация дистальных отделов восходящей аорты и дуги при чреспищеводной ЭхоКГ затруднена воздушным столбом трахеи и главных бронхов. Это обстоятельство не позволяет четко визуализировать дистальные сегменты во время чреспищеводной ЭхоКГ приблизительно в 40 % наблюдений. Аортография. Золотым стандартом при диагностике аневризмы восходящей аорты в течение длительного времени считали аортогра-фию, которую и сегодня широко используют в клинической практике. Этот метод, доступный только в специализированных клиниках, дает возможность оценить диаметр аорты на уровне аневризматическо-го расширения, протяженность патологически измененного участка аорты, степень аортальной регурги-тации (рис. 5.19) и у части больных с большей или меньшей степенью достоверности — выявить наличие и распространенность расслоения аортальной стенки. При аортогра-фии также хорошо определяются расположение аневризмы по отношению к сосудам дуги аорты, выраженность дилатации синусов Валь-сальвы и смещение устьев коронарных артерий. Ограничениями данного метода являются его относительная труд-нодоступность, инвазивность и недостаточная информативность при расслоении. Коронарография обычно входит в стандартный план предоперацион-
Рис. 5.19. Аортография: аортальная ре-гургитация. фии. При подозрении на острое расслоение аортальной стенки независимо от возраста пациента ко-ронарография должна производиться лишь в исключительных случаях. Компьютерная томография (КТ) с внутривенным введением контрастных веществ (компьютерная томографическая ангиография) дает возможность довольно точно оценить характер и размеры аневризм аорты. КТ дополняет данные, полученные при аортографии, особенно в случае внутрисосудистого тромбоза и расслоения (рис. 5.20, а—в). При этом наблюдается экстраваза-ция контраста с вовлечением в процесс рядом расположенных структур. КТ может быть полезной для
ного обследования пациентов, имеющих на момент поступления или в анамнезе симптомы патологического процесса в коронарных артериях, и пациентов, возраст которых превышает 40 лет. Аномалии корня аорты иногда затрудняют классическую канюляцию коронарных артерий и введение контрастного вещества; в этих случаях необходимо использовать специальные методики. Левая вентрикулография часто дополняет процедуру коронарогра- Рис. 5.20. Компьютерная томограмма: расслоение аортальной стенки (а—в).
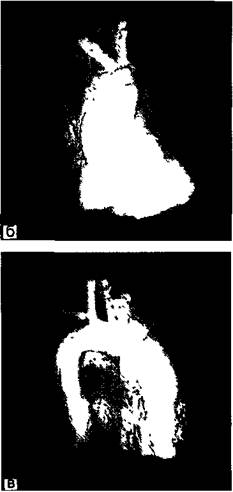
Рис. 5.21. ЭЛТ: объемное изображение аневризмы (а—в). динамической оценки небольших бессимптомных аневризм и количественных изменений размеров и скорости дилатации, однако усреднение объемов в зонах с быстроменяющейся кривизной наряду с томографическими «срезами» в плоскостях, неперпендикулярных продольной оси аорты, может привести к неверной оценке диаметра аорты. Польза трехмерной техники визуализации в рамках КТ не установлена. Теоретически трехмерное сканирование дает больше информации о протяженности аневризм, особенно для аневризм нисходящей аорты. Использование указанной методики дает возможность прецизионной визуализации и количественной оценки мешковидных образований. Наиболее современным из методов КТ в диагностике аневризм восходящей аорты является электронно-лучевая томография. Благодаря современным технологиям формирования изображения и его обработки метод при меньшей дозе рентгеновского излучения обеспечивает получение достоверных данных о состоянии аортальной стен-
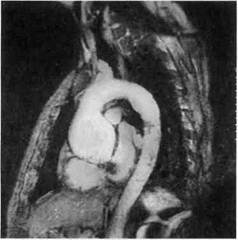
ки, форме и протяжености аневризмы. Электронно-лучевая томография позволяет моделировать трехмерное изображение аорты, наиболее точно отражающее ее реальное состояние (рис. 5.21, а—в). Магнитно-резонансная томография (МРТ) дает информацию, подобную по своей сути той, которую получают при КТ, однако обладает рядом преимуществ, главными из которых представляется отсутствие необходимости введения рентгено-контрастных препаратов и использования ионизирующей радиации. Стенки сердца и сосудов имеют до-
Рис. 5.22. MPT: сагиттальный срез. статочное количество натуральных контрастов. Во время МРТ могут быть получены четкие срезы в различных плоскостях (рис. 5.22; 5.23). Современные технологии позволяют оценить направление и скорость кровотока не только в аорте, но и в коронарных артериях. Теоретически МРТ можно использовать не только для визуализации и оценки кровотока в коронарных артериях и аорте, но и для получения информации о клапанах и функции сердца. МРТ в настоящее время менее распространена, чем КТ, так как является более дорогостоящей и нередко недоступна для пациентов. Хирургическое лечение аневризмы восходящей аорты. Хирургическое лечение аневризмы восходящей аорты по-прежнему остается сложной, но при современном уровне развития кардиохирургии решаемой задачей. История хирургии аневризмы восходящей аорты исчисляется десятилетиями и тесно связана с начальным периодом становления хирургии открытого сердца в целом. Первые записи об артериальных аневризмах принадлежат Галену (II в.). Aetius в VI в. описал разрыв аорты во время родов. Везалию по праву принадлежит клиническое первенство в диагностике мешковидной аневризмы грудного отдела аорты, о которой он сообщил в 1557 г. В 1757 г. William Hunter представил клиническое наблюдение аневризмы грудной аорты, определяющейся через стенку грудной клетки. Кроме того, им подробно были описаны симптомы компрессии грудной клетки и ее органов, а также четкие дифференциальные критерии, позволяющие отличить аневризму от псевдоаневризмы. Несмотря на многовековую историю, хирургическое лечение аневризм аорты было предпринято лишь в XX столетии и в «доперфу-зионный» период ограничивалось укреплением аорты путем ее оборачивания (окутывания) теми или иными материалами, а в случае ограниченных мешковидных аневризм — латеральной резекцией с последующим восстановлением целости аортальной стенки.
Первые резекции аневризмы восходящей аорты с замещением аортальным аллографтом осуществили D.Cooley и M.DeBakey. Результаты этих операций были опубликованы в 1956 г. Протезирование супрако- ронарного сегмента восходящей аорты в сочетании с восстановлением несостоятельности аортального клапана описано W.Mueller и со-авт. в 1960 г. Комбинированное протезирование супракоронарного отдела аорты синтетическим сосудистым протезом и аортального клапана механическим протезом выполнено A.Starr и соавт. в 1963 г. Протезирование восходящей аорты в целом, за исключением небольшого сегмента, содержащего коронарные артерии и аортальный клапан, с изолированным протезированием последнего осуществили M.Wheat и соавт. в 1964 г. В том же году L. Groves и соавт. высказали идею о необходимости реимпланта-ции устьев коронарных артерий в сосудистый протез аорты. В 1968 г. H.Bentall и A.DeBono впервые сообщили об использовании «кондуита», состоящего из тефлонового сосудистого протеза и вшитого в него шарового протеза Старра-Эдвардса для одномоментного протезирования восходящей аорты и аортального клапана. В 1970 г. W.Edwards и A.Kerr использовали подобную методику для коррекции расслоения восходящей аорты, сопровождающегося аортальной регургитацией. Авторами использовалась техника окутывания, которая подразумевала погружение и окутывание (оборачивание) сосудистого протеза тканью пораженной патологическим процессом стенки аорты с последующим ушиванием ее над протезом с целью профилактики послеоперационного кровотечения. Последующие работы были посвящены модификации методик выделения устьев коронарных артерий и имплантации их в стенку протеза, а также профилактике сдавливания стенкой аорты сосудистого протеза. Указанные исследования проводили с целью уменьшить вероятность формирования псевдоаневризм, которые нередко наблюдались при использовании техники окутывания. В 1981 г. C.Cabrol и соавт. предложили методику полного замещения восходящей аорты с реимплантацией коронарных артерий при помощи дополнительного 8—10-миллиметрового дакронового протеза. Как уже было указано, первыми структурными изменениями и отдаленной функцией этих протезов в конечном итоге привели к экспериментальным работам по созданию синтетических протезов, имеющих в своем составе стекло, золото, ме-тилметакрилат и полиэтиленовые пластмассы. Первое протезирование аорты тканевым протезом Viny-on N предприняли A.Blakemore и A.Voorhees в 1954 г. В дальнейшем наиболее широкое распространение получил синтетический материал дакрон. В настоящее время импрег-нированные коллагеном или желатином дакроновые протезы, характеризующиеся высокой резистентностью к проницаемости элементов крови, являются, пожалуй, наиболее распространенными заменителями пораженной аорты. Альтернативой им в последние годы становятся ксеноперикардиа-льные кондуиты (так называемые биокондуиты), впервые предложенные группой авторов из Бразилии. В России первую успешную резекцию мешковидной аневризмы восходящей аорты с наложением краевого шва аорты в условиях искусственного кровообращения выполнил 28 декабря 1962 г. А.В.Покровский. Первые успешные опера- ции супракоронарнои резекции аневризмы восходящей аорты с раздельным протезированием аорты и аортального клапана, а также вмешательства по методикам Бентал-ло—Де Боно и Каброля при СМ выполнил Г.И.Цукерман соответственно в 1973, 1978 и 1983 гг. Био-кандуит впервые в России использовал А.И.Малашенков в декабре 1989 г. Показания к операции. Клинические и диагностические симптомы. Наличие симптомов аневризмы восходящей аорты и выраженной или клинически значимой аортальной регургитации является прямым показанием к хирургическому лечению этой патологии. При подозрении на острое расслоение аорты и тем более при верифицированном диагнозе требуется срочное, а при надрыве или разрыве аорты — экстренное оперативное вмешательство. Прогрессирующее расширение аорты. Аневризмы с прогрессирующим течением, т.е. постепенным увеличением диаметра аорты, что устанавливается в результате динамического наблюдения за пациентом по данным серии рентгенограмм, эхокардиограмм, компьютерных и/или магнитно-резонансных томограмм, требуют хирургической коррекции. Резкое увеличение размеров нередко предшествует разрыву аорты. В настоящее время считается, что скорость расширения аневризмы, превышающая 1 см в год, — прямое показание к операции. Размер аневризмы. Бессимптомные аневризмы более 5,5—6 см в диаметре в сочетании с аортальной регургитацией или без нее следует подвергать хирургической коррекции, поскольку риск разрыва аневризмы при прогрессировании ее размера увеличивается, тогда как летальность и частота осложнений после хирургических вмешательств невысоки. Как показывают резуль- таты ретроспективных исследований по оценке естественного течения неоперированных грудных аневризм, средний диаметр разорвавшихся аневризм составил 6— 10 см. Ряд авторов считают, что пациентов с СМ необходимо оперировать во всех случаях, когда диаметр аорты превышает 5,5—6 см. Пациентов, в семейном анамнезе которых отмечены расслоение аорты или случаи внезапной гибели родственников, рекомендуется оперировать при достижении аортой диаметра 5—5,5 см. Другие авторы показанием к операции считают прогрессивное увеличение диаметра аорты или удвоение диаметра в сравнении с исходным. Пациентам с тяжелой аортальной регургитацией или симптомами расслоения аорты необходимо проводить коррекцию аневризмы и пластику либо протезирование аортального клапана. Сочетание патологии аортального клапана с расширением восходящей аорты. Недостаточность аортального клапана при СМ является признаком нарушения коаптации его створок. Клинические симптомы и/или прогрессирование регургитации часто делают необходимой операцию до того, как диаметр аорты достигнет значительного размера (5—6 см). P.Michael отмечает, что у 25 % пациентов с аортальной регургитацией, диаметр аорты у которых превышает 4 см, в дальнейшем требуются повторные операции с целью протезирования аорты. Частота расслоения аорты после протезирования аортального клапана довольно высока и составляет около 27 % среди пациентов с диаметром аорты более 5 см. Описанные исследования свидетельствуют о необходимости протезирования восходящей аорты во время операций по коррекции клапанных нарушений в том случае, когда диаметр аорты превышает 4—5 см. Аневризмы синусов Вальсалъвы могут развиваться после протезирования восходящей аорты у пациентов с СМ или кистозным медионекро-зом. Коррекция этой патологии показана при прогрессирующей дила-тации аорты на уровне синусов Ва-льсальвы, надрыве интимы либо превышении диаметра аорты более 6 см. Виды операций при аневризме восходящей аорты. Из всего многообразия операций, предложенных для хирургического лечения аневризм восходящей аорты, лишь немногие могут быть с успехом использованы при СМ. Это обусловлено как характером патологических изменений в аортальной стенке и аортальном клапане, так и многолетним опытом хирургического лечения восходящей аорты. На сегодняшний день методом выбора при необходимости хирургической коррекции патологии восходящей аорты и аортального клапана при СМ является имплантация клапансо-держащего кондуита. У части больных при сохранных створках аортального клапана возможно выполнение того или иного вида клапансох-раняющей операции, предусматривающей протезирование восходящей аорты с реимплантацией устьев коронарных артерий и укреплением кольца аортального клапана. Супракоронарное протезирование восходящей аорты — изолированное или в сочетании с раздельным протезированием аортального клапана — оказалось несостоятельным из-за неблагоприятных отдаленных результатов. У значительного числа пациентов (до 38 % при СМ) возникал рецидив аневризмы ниже проксимальной линии шва аорты и сосудистого протеза (на уровне синусов Вальсальвы), что требовало повторной операции или приводило к разрыву аневризмы. На сегодняшний день такая методика, равно как и изолированное супракоронарное протезирование восходящей аорты без замены аортального клапана, сохранили свое значение при расслаивающей аневризме восходящей аорты атероскле-ротического генеза. 5.3.6. Общие вопросы хирургии аневризм восходящей аорты Доступ. В большинстве случаев прибегают к срединной стерното-мии. В случае необходимости выделения дистального отдела дуги или нисходящего отдела аорты этот разрез может быть продолжен поперечно на третьем или четвертом межреберье слева. Альтернативой описанному способу служит поперечная торакостернотомия. Выраженная деформация грудной клетки (pectus excavatum) у пациентов с СМ может осложнять оперативный доступ к сердцу через срединную стернотомию. Р.Аrn и соавт. рекомендуют в случае необходимости плановой операции на восходящей аорте за несколько месяцев до нее выполнять коррекцию деформации грудины. При этом в большинстве случаев наблюдается восстановление реберно-хрящевых соединений, стабилизирующих грудную клетку и обеспечивающих хороший функциональный и косметический эффект, что в дальнейшем облегчает операцию на аорте и послеоперационное восстановление. Одновременная коррекция сердечно-сосудистых нарушений и деформации грудной клетки хотя и возможна, но более продолжительна по времени и может осложниться трудно контролируемым кровотечением, связанным с гепариниза-цией и искусственным кровообращением. Искусственное кровообращение (ИК). Перед канюляцией вводят гепарин в дозе 3 ЕД/кг. Во время ИК активированное время свертывания (ACT) крови поддерживают на уровне более 450 с. Если аневризма не распространяется на дистальные отделы восходящей аорты, то сохраняется возможность канюляции восходящей аорты или проксимальных отделов ее дуги. В противном случае выделяют общую бедренную артерию или дистальные отделы наружной подвздошной артерии с последующей их канюляцией. При отсутствии необходимости остановки кровообращения в правое предсердие вводят двухуровневую канюлю размером 32/40 или 36/40 Fr. При повторных операциях, необходимости протезирования митрального клапана или гипотермической остановки кровообращения в верхнюю и нижнюю полые вены вводят отдельные канюли. Канюли соединяют с экстракорпоральным контуром, состоящим из мембранного оксигенатора с интегрированным в него теплообменником. Состав первичного объема заполнения контура варьирует в зависимости от индивидуальных особенностей пациента. Ориентиром служит раствор Рингер-лактата с ман-нитолом (25 г). Глюкозу обычно не добавляют, поскольку гипергликемия усугубляет повреждение ЦНС. В левый желудочек через кисетный шов, наложенный на верхнюю правую легочную вену, проводят лево-желудочковый дренаж. Альтернативой этому может быть введение дренажа в легочную артерию. Объемная скорость перфузии обычно составляет 2,2—2,5 л(мин • м2), гемато-крит — 22—28 % (гемодилюция). Температуру тела снижают до 28 °С (умеренная гипотермия). Для дополнительного охлаждения сердца, особенно при предполагаемой ишемии более 60 мин, используют ледяную крошку. Для защиты диафраг-мального нерва применяют изолирующие прокладки. Защита миокарда при операциях на восходящей аорте имеет определенные особенности, обусловленные рядом факторов, среди которых:
• большая, чем при рутинном протезировании клапанов сердца, продолжительность операции; • необходимость манипуляций на устьях коронарных артерий при использовании стандартной прерывистой антеградной кардиоплегии, в том числе в условиях расслоения аортальной стенки; • затрудненный доступ к устьям коронарных артерий после реимп-лантации их в сосудистый протез. В связи с этим при выборе метода защиты миокарда в хирургии восходящей аорты обоснованы следующие требования: ▲ метод должен обеспечивать адекватную защиту миокарда при длительном выключении сердца из кровообращения; ▲ контакт с устьями коронарных артерий должен быть по возможности минимальным; ▲ время, необходимое для обеспечения защиты миокарда, определяющееся частотой и продолжительностью инфузий кардиоплегиче-ского раствора, по возможности должно оказывать минимальное влияние на продолжительность внутрисердечного этапа операции. Выполнение указанных требований может быть достигнуто как уменьшением частоты инфузий кардиоплегического раствора в коронарные артерии, так и использованием других методик защиты миокарда, позволяющих полностью исключить контакт с коронарными артериями. Указанным требованиям в полной мере отвечает метод высокообъемной кардиоплегии с использованием кустодиола — раствора внутриклеточного типа. Метод защиты миокарда, разработанный H.Bretschneider, базируется на двух составляющих — составе раствора и методике его применения. В отличие от других методов, основанных на внеклеточном механизме защиты миокарда, кус-тодиол является раствором внутриклеточного типа (гипонатриевый, бескальциевый, с высоким гисти-диновым буфером), при однократном введении которого происходит отмывание не только внутрисосуди-стого русла, но и всего интерстици-ального пространства. В России метод впервые был внедрен в клиническую практику в НИИ трансплантологии и искусственных органов в 1992 г., и к концу 2000 г. был накоплен опыт его применения — проведено более 80 операций по поводу аневризмы восходящей аорты. Введение кустодиола требует четкого соблюдения определенных методических условий. Это относится к объему, давлению и продолжительности введения раствора. Стандартная методика проведения кардиоплегии заключается в введении непосредственно в коронарные артерии 3000 мл кустодиола в течение 8—10 мин, при этом объемная скорость составляет около 300 мл/мин. До остановки сердца перфузионное давление поддерживают на уровне 100 мм рт.ст., а затем снижают до 40—50 мм рт.ст. Снижение перфу-зионного давления в процессе введения кардиоплегического раствора необходимо из-за наступающей кардио- и вазоплегии. Наружное охлаждение сердца не является обязательным. Жидкость, вытекающую из коронарного синуса, удаляют из правого предсердия, распустив предварительно турникет, фиксирующий канюлю верхней полой вены. Наружным отсосом эвакуируют раствор из полости перикарда. Попадание части кардиоплегического раствора в общую систему перфузии не имеет существенного значения. Необходимость в повторном введении раствора, по опыту НИИТ и ИО, не возникает. В течение последних 2 лет в НИИТ и ИО у части пациентов, как правило, при расслаивающей аневризме восходящей аорты, подозрении на сопутствующую коронар- ную патологию или при наличии открытого овального окна использовали ретроградное введение кустодиола через коронарный синус, что позволяло полностью исключить контакт с устьями коронарных артерий. После небольшой правой атриотомии и канюляции коронарного синуса специальной канюлей вводили кустодиол в том же объеме (3000 мл), но с меньшей скоростью, чтобы давление в коронарном синусе не превышало 40 мм рт.ст. Раствор, поступающий из устьев коронарных артерий, удаляли непосредственно из корня аорты или через дренаж левого желудочка. Удлинение процедуры кардиоплегии до 13—15 мин не влияло на общую продолжительность операции, так как сразу после фиксации канюли к стенке правого предсердия приступали к основным манипуляциям на аорте. Защита миокарда с использованием антеградного или ретроградного введения кустодиола оказалась высокоэффективной. При средней продолжительности интраопераци-онной ишемии миокарда 121+20 мин (максимально 215 мин) ни в одном наблюдении не отмечено осложнений, обусловленных защитой миокарда. Летальность в течение первой недели после операции составила 3,8 %. Другим методом, который также отвечает перечисленным выше требованиям, является прерывистая кровяная ретроградная кардиопле-гия через коронарный синус (РККС). Этот метод также впервые в России был внедрен в НИИТ и ИО в 1987 г. Отличие РККС от кардиоплегии кустодиолом заключается в необходимости повторных введений кардиоплегического раствора, которые, однако, не требуют дополнительных манипуляций от хирурга. Протокол РККС заключается в следующем: после правой атриотомии и фиксации кардиоплегической ка- июли в коронарном синусе вводят 700—800 мл раствора на основе крови с объемной скоростью 150— 200 мл/мин, при этом давление в коронарном синусе не должно превышать 40 мм рт.ст.; повторные ин-фузии 400—500 мл кардиоплегиче-ского раствора проводят через каждые 20—30 мин. РККС при коррекции расслаивающих аневризм восходящей аорты использована в НИИТ и ИО у 15 пациентов со средним временем интраоперационной ишемии миокарда 137+22 мин без летальных исходов и острой сердечной недостаточности. Безусловно, при хирургическом лечении неосложненных аневризм восходящей аорты, когда не предполагается длительное выключение сердца из кровообращения, возможно использование антеградной кар-диоплегии кристаллоидным (или кровяным) раствором как наиболее широко распространенного метода защиты миокарда. Тем не менее высокообъемная кардиоплегия кусто-диолом представляется оптимальным методом защиты миокарда в любой клинической ситуации, особенно при расслаивающей и других осложненных аневризмах аорты. Выбор протеза и его подготовка. Идеальный сосудистый протез для замещения аорты должен иметь минимальную порозность (пористость), быть прост в обращении, давать возможность тканям прорастать стенки протеза с целью снижения риска тромбоэмболии. После протезирования восходящей аорты в прошлом у пациентов нередко наблюдались скотомы (дефекты полей зрения) и эпизоды преходящей слепоты (amaurosis fugax), связанные с эмболией тромбами, формирующимися на поверхности протеза. Наиболее часто используемые в настоящее время синтетические дакроно-вые протезы характеризуются минимальной реактивностью и хорошей биосовместимостью. В зависимости от технологии изготовления дакроновых протезов различают вязаные и тканые. Применявшиеся ранее плетеные протезы из нейлона из-за существенных недостатков с начала 60-х годов в клинике не используют. Вязаные и тканые протезы обладают высокой прочностью и эластичностью, легко прорастают тканями организма и просты в обращении. Вязаные протезы изготавливают на вязальных станках. Для снижения их порозности стенку протеза делают двойной («двойной велюр»), что обеспечивает значительно меньшую кровоточивость. Тканые протезы изготавливают на специальных ткацких станках; особенностью протезов является плотное переплетение нитей. Благодаря такой технологии проницаемость тканых протезов становится очень низкой. Широко используют коммерческие протезы, импрегнированные желатином (например, Gelseal™ и Gelweave™, Sulzer Vascutec Ltd, Renfrewshire, UK) или коллагеном (например, Hemashield™, Meadox Medical, Oakland, NJ). Такие протезы также удобны и отличаются практически нулевой порозно-стью. Бесшовные внутрипросветные аортальные протезы, фиксирующиеся на цилиндрах внутри проксимальных или дистальных отделов аорты, ряд авторов используют с хорошими результатами. Однако эти устройства не дают существенного выигрыша во времени операции, имеют склонность к миграции и аррозии, ассоциируются с высокими градиентами давления и вероятностью окклюзии коронарных артерий. При СМ возможно использование подобного внутрипросветно-го протеза с заранее имплантированным в него эластичным кольцом, но только для бесшовного формирования дистального анастомоза. Современная тактика при выборе протезов для протезирования корня аорты основывается на предпочтительном использовании клапансо-держащих кондуитов, представляющих собой комплекс механического клапана (предпочтительно двустворчатого) с синтетическим протезом, импрегнированным коллагеном или желатином. При необходимости в составе описанного комплекса вместо механического клапана возможно использование биопротеза. В 1987 г. R.Ardito и J.Santos из Бразилии сообщили о внедрении в хирургию аневризм восходящей аорты так называемого биокондуита, основное отличие которого от описанных выше клапансодержа-щих кондуитов заключается в том, что синтетический сосудистый протез заменен ксеноперикардом, причем моделирование из него трубки производят непосредственно во время операции. Авторы использовали биокондуиты, состоящие из бычьего перикарда и биологического протеза. Другие бразильские авторы [Gontijo В. et al., 1995] сообщили о результатах 5-летнего опыта применения ксеноперикарда для замещения восходящей аорты у 80 пациентов, в том числе у 33 в сочетании с замещением аортального клапана, при этом в состав биокондуита входили как биологические, так и механические протезы клапана сердца. Преимущества биокондуитов могут быть сформулированы следующим образом: • гибкость и податливость биоткани облегчают моделирование анастомозов и упрощают схему операции в целом; • высокая степень гемостатично-сти биоткани в сочетании со стандартной схемой гемостатических мероприятий способствует значительному снижению частоты ранних послеоперационных кровотечений; • простота изготовления и низкая стоимость. Биокондуиты в России широко используют в двух клиниках (НЦ ССХ им. А.Н.Бакулева РАМН и НИИ трансплантологии и искусственных органов МЗ РФ). На сегодняшний день предпочтительным считается применение комбинации ксеноперикарда с дисковым или двустворчатым протезом. Кооперативный опыт указанных клиник к 2000 г. достиг 200 имплантаций биокондуитов со средней летальностью 7,5 %. Дата добавления: 2015-02-06 | Просмотры: 2930 | Нарушение авторских прав |