|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Коарктация аорты
Впервые описал эту аномалию развития аорты патологоанатом Morgagni в 1761 г., хотя ряд авторов указывают на первое описание коарктации Meckel в 1750 г., а наиболее подробно Paris (1789), а сам термин «коарктация» был введен во врачебный лексикон Mercier в 1839 г. Что касается причин формирования коарктации, то, несмотря на множество предложенных теорий, ни одна из них не нашла достоверного подтверждения. На сегодняшний день наиболее приемлемой считается теория нарушения закладки и формирования аортальных дуг, предполагающая, что развитие дуги и перешейка аорты происходит как во время внутриутробной жизни, так и в течение определенного времени после рождения ребенка. Дуга аорты состоит из третьей, четвертой (перешеек аорты) и шестой (артериальный проток) эмбриональных аортальных (преимущественно левосторонних) дуг. Различные эндогенные и экзогенные неблагоприятные воздействия, нарушающие правильность закладки эмбриональных дуг, в конечном итоге могут привести к различным аномалиям данного сегмента аорты. Предложенная A.Rudolph и со-авт. (1972) гемодинамическая теория развития коарктации аорты предполагает, что во время внутриутробного развития большая часть суммарного выброса крови из желудочков сердца поступает в восходящий и нисходящий сегменты аорты через открытый артериальный проток (ОАП), а через перешеек аорты проходит лишь 25 % крови, что обусловливает его узость, которая в определенных условиях может сохраняться и усугубляться после рождения ребенка. В настоящее время признана неубедительной классическая теория Шкоды [Skoda J., 1855], объясняющая сужение аорты закрытием ОАП, в результате которого в процесс вовлекается прилегающий участок аорты. Частота коарктации аорты, по данным различных авторов, составляет от 6 до 14,2 % всех врожденных пороков сердца, поэтому эта аномалия развития аорты справедливо считается одним из наиболее распространенных врожденных пороков сердечно-сосудистой системы. Аорта в зоне коарктации часто смещена кпереди и медиально, при этом наблюдают как бы подтягивание ее артериальной связкой или открытым артериальным протоком. Редко сужение аорты может начинаться в месте отхождения левой подключичной артерии или сочетаться с гипоплазией ее начального отдела. Гипертензия в артериях верхней половины туловища приводит к резким необратимым изменениям структуры стенок аорты и артерий с их истончением и образованием аневризм. Начиная с 10-летнего возраста, а иногда и раньше, в аорте и сосудах появляются атеросклеротические нарушения. Очень часто при изучении результатов патоморфологических исследований стенки аорты у больных с расслоением восходящей аорты при наличии двустворчатого аортального клапана и коарктации в стенке аорты были обнаружены кистозно-некротическое перерождение медии или изменения стенки, аналогичные таковым при синдроме Марфана. Это можно объяснить тем, что КА, двустворчатый аортальный клапан и врожденная несостоятельность стенки восходящей аорты являются проявлением дефекта развития артериального дерева. Сочетание КА с другими заболеваниями сердца и сосудов. На частое сочетание КА с другими врожденными или приобретенными пороками сердца и сосудов обратила внимание еще M.Abbott, описав, что коарктация в 85 % случаев сочетается с двустворчатым аортальным клапаном. Столь же частое сочетание (от 25 до 50 %) отмечали A.E.Becker и соавт., а также целый ряд других авторов. Частота сочетания КА с другими пороками напрямую зависит от воз- раста больных. Так, S.Sinha и со-авт., R.Thawes и соавт. считают, что в грудном возрасте КА сочетается с другими ВПС в 60—70 % случаев, причем подобное сочетание тем чаще, чем меньше возраст ребенка. Нередко КА сочетается с несколькими ВПС. Изолированную КА наблюдают лишь у 15—18 % больных с осложненным течением заболевания в грудном возрасте. По данным ряда авторов, у 70 % грудных детей КА сочетается с ОАП, у 53 % - с ДМЖП, у 14 % -со стенозом аорты и другими пороками аортального клапана и у 3— 8 % — со стенозом или недостаточностью митрального клапана. У 6 % детей зафиксирован синдром гипоплазии левых отделов сердца. В течение первого года жизни КА сочетается с другими ВПС в 84 % случаев, а после первого года — лишь у 27 %, причем тяжесть сопутствующих ВПС находится в обратной зависимости от возраста. Дианетические ВПС с коарктацией развиваются значительно реже. Чаще бывает транспозиция магистральных сосудов. У 26 % новорожденных с КА имеются тяжелые экстракардиаль-ные врожденные пороки развития, в 14 % случаев они не поддаются лечению. Тубулярная гипоплазия дуги или перешейка аорты описана у 60—70 % детей первого полугодия жизни с КА. Анализируя частоту сопутствующей патологии у больных КА старше 5 лет, А.В.Покровский обнаружил сочетание КА с другими врожденными и приобретенными заболеваниями сердца и сосудов у 15,2 % пациентов. Автор считает, что из всех сочетаний у детей и взрослых комбинацию КА с аортальным пороком регистрируют в 45 % случаев. Наиболее частыми сердечно-сосудистыми заболеваниями, осложняющими течение КА у больных старшей возрастной группы, являются пороки аортального и митра- льного клапанов, аневризмы аорты и ее ветвей, хроническая ишемиче-ская болезнь сердца. Пороки аортального клапана имеют место у 14,3—50 % больных с КА старше 5 лет, пороки митрального клапана—у 2,6—15 % пациентов. Одно из наиболее тяжелых осложнений КА — развитие аневризм аорты и ее ветвей. Частота сопутствующих аневризм составляет 1 — 1,8 % случаев во всех возрастных группах, а у больных с КА старше 35 лет подобное сочетание зафиксировано в 14,3 — 42 % наблюдений. Длительно существующая артериальная гипертензия в верхней половине туловища может явиться предрасполагающим фактором развития атеросклеротических изменений в коронарных артериях у больных с КА. В течении патологического процесса необходимо отметить следующую закономерность: декомпенсация развивается или в первый год жизни, или в 3—4-м десятилетии. Если в первый год жизни преобладают явления сердечной декомпенсации, то во 2—3-м десятилетии — патологические изменения со стороны артериальной системы в виде аневризм и разрывов различных ее отделов (аорты, артерий головного и спинного мозга). Коарктация аорты характеризуется крайне неблагоприятным естественным течением. По данным ряда авторов, 56 % больных умирают в течение первого года жизни, причем сочетание КА с другими пороками обусловливает еще более неблагоприятный прогноз. Даже при изолированной коарктации смертность в течение первого года жизни достигает 34 %. Смертельные исходы наблюдают чаще всего в период новорожденности, первые дни и недели жизни. При этом наиболее значимы вариант сужения аорты, характер и тяжесть сопутствующих ВПС. В возрасте от 2 до 10 лет смертельные исходы среди больных с КА бывают редко. Лишь 5,6 и 4,5 % больных, переживших первый год жизни, умирают в этом возрасте; 19 % больных — в возрасте 10—20 лет, а 59 % — в возрасте 20—50 лет. Течение КА у неоперированных больных старше 5 лет отличается развитием выраженной клинической симптоматики и жизненно-опасных осложнений. Средняя продолжительность жизни неоперированных больных составляет 24,4 — 35 лет. По данным М.М.Кичева (70), 35-летний возраст переживают лишь 0,7 % больных с КА старшего возраста. Основными причинами смертельных исходов являются застойная сердечная недостаточность (25,5 %), расслоение (часто у беременных с КА) или разрыв аорты (21 %), бактериальный эндокардит или аортит (18 %), внутричерепные кровотечения (11,5 %), внезапная смерть или другие неизвестные причины (24 %). Описаны лишь единичные случаи КА у больных старше 60 и 70 лет. Причинами снижения качества жизни неоперированных больных с КА более старшего возраста, особенно при сочетанных пороках, служат застойная сердечная недостаточность, дилатационная карди-омиопатия, коронарная болезнь и ишемическая болезнь сердца. У больных с КА старше 35 лет частота дооперационного инфаркта миокарда составляет от 5 до 10,7 %. Основы гемодинамики при КА. Общепризнанным считается наличие при КА двух режимов кровообращения — проксимальнее и диста-льнее места сужения с регионарной артериальной гипертензией в верхнем этаже и снижением объемного кровотока в нижнем. А.В.Покровский установил 3 типа нарушения гемодинамики при КА в зависимости от изменения сердечного выброса и уровня общего периферического сопротивле- ния. При I типе сердечный выброс повышается на 34 %, ударный индекс — на 20 %, общее периферическое сопротивление (ОПС) — в среднем на 31 %. Объем циркулирующей крови превышает норму на 18 %. При II типе сердечный и ударный индексы в пределах нормы, однако ОПС возрастает до 70 %. Для третьего (III) типа характерно повышение ОПС более чем в 3 раза и снижение сердечного и ударного индексов на 30 %. Сердечный выброс может быть повышенным или в норме при отсутствии признаков сердечной недостаточности, в то время как присоединение симптомов сочетанных пороков сердца и повышение нагрузки на миокард может сопровождаться различными проявлениями сердечной декомпенсации со снижением сердечного выброса. При сочетании КА с большим ДМЖП может развиваться высокая легочная гипертензия, протекающая злокачественно с быстрым формированием склероза сосудов легких. При этом АД выше места сужения может быть в норме или незначительно повышено из-за большего сброса крови через дефект и снижения ударного объема крови. При сочетании КА с небольшим ДМЖП возможно бессимптомное течение заболевания вплоть до достижения больным зрелого возраста. Многие авторы пришли к мнению, что при сочетанном клапанном стенозе аорты резко возрастает нагрузка на левый желудочек сердца, повышается давление в левом желудочке, в то время как в восходящей аорте давление может быть увеличено незначительно. Характерные изменения гемодинамики зафиксированы при сопутствующем фиброэластозе: на фоне миогенной дилатации сердца и снижения его сократительной способности значительно повышаются конечно-диастолическое давление (на 18—30 мм рт.ст.) и конечно-диастолический объем, снижаются ударный объем крови и фракция выброса. В последние годы исследования посвящены в основном изучению микроструктурных изменений в стенках аорты и артерий при КА и нарушениям деятельности ре-нин-ангиотензин-альдостероновой системы (РААС) как возможной причины развития и поддержания гипертензии. О существовании структурных и функциональных различий, а также микроструктурных изменениях сосудистой стенки при КА, приводящих к нарушениям функции баро-рецепторов, указывают и другие авторы, a D.Heath и соавт., кроме того, описали еще и резкую гипертрофию каротидных телец с изменением в них структурных элементов у больного с КА, умершего в возрасте 61 года. Изменения микроциркуляции в почках часто приводят к дисфункции РААС. Изучая содержание в плазме крови ренина и медиаторов симпатической нервной системы в покое и при физической нагрузке, R.Simsolo и соавт. выявили отклонение от нормы РААС и симпатической нервной системы, но при этом им не удалось обнаружить взаимосвязь между этими отклонениями и уровнем АД. Таким образом, нарушения гемодинамики при КА могут быть обусловлены механическим препятствием току крови по аорте, кроме того, сопутствующими заболеваниями сердца и сосудов, микроструктурными изменениями сосудистой стенки с дисфункцией регионарной барорегуляции, нарушением деятельности системы гормонального го-меостазиса. Клиническая картина и диагностика КА. Ю.Е.Березов и А.В.Покровский выделяют 5 периодов течения заболевания в зависимости от возраста больных. Первый период — критический, который наблюдают в течение первого года жизни. В это время регистрируют наиболее высокую смертность больных. Второй период — приспособление или адаптация (от 1 года до 5 лет). Именно в этот период могут появляться жалобы, характерные для КА: головная боль, одышка, утомляемость и боль в нижних конечностях при физических нагрузках. Однако в большинстве случаев жалобы отсутствуют, а клинические проявления недостаточно яркие, вследствие чего порок может быть обнаружен случайно. Третий период — компенсация — охватывает возраст от 5 до 15 лет. И в этом периоде могут отсутствовать жалобы, что также обусловливает позднее выявление заболевания. Четвертый — относительная декомпенсация. По возрасту он обычно соответствует периоду полового созревания, для которого характерно появление в ряде случаев жалоб на головную боль, утомляемость, нередко — носовые кровотечения, что заставляет больных обращаться к врачу. Пятый период — декомпенсация, наблюдающаяся в возрасте 20—40 лет, т.е. практически в том возрасте, до которого они доживают. В этот период жалобы больных характерны для проявлений артериальной гипертензии. В возрасте от 1 года до 15 лет жалоб у детей обычно не бывает и КА обнаруживают случайно при врачебном осмотре по поводу других причин. При этом основными клиническими проявлениями могут быть шум над областью сердца и повышенное АД. Лишь у 5 % больных в этом возрасте возможны признаки сердечной недостаточности. Жалобы больных подразделяют на 3 группы: • жалобы, связанные с гипертен-зией в проксимальном отделе аорты, — головная боль, ощущение пульсации в голове, быстрая умственная утомляемость, ухудшение памяти и зрения, носовые кровотечения; • жалобы, являющиеся результатом нарастающей перегрузки левого желудочка сердца — боль в области сердца, одышка, ощущение перебоев, сердцебиение; • жалобы, обусловленные недостаточным кровообращением в нижней половине тела — быстрая утомляемость, слабость нижних конечностей, боль в икроножных мышцах, особенно при физических нагрузках. Артериальная гипертензия является одним из важнейших клинических признаков КА. Как правило, повышается систолическое давление, в то время как диастолическое повышено незначительно. Однако даже при нормальном или умеренно повышенном АД проба с физической нагрузкой приводит к значительному повышению АД, что служит своеобразным диагностическим тестом. Диагностические трудности могут возникать при аномалиях подключичных артерий при КА, когда одна или обе подключичные артерии отходят диста-льнее места сужения. В связи с этим чрезвычайно важно измерять АД на обеих руках. Невысокое АД у больных с КА может быть обусловлено сопутствующим аортальным стенозом. Характер систолического шума определяется наличием расширения восходящей части аорты, артериальной гипертензией, а также сопутствующими пороками клапанов. Чаще всего грубый систолический шум выслушивается над всей поверхностью сердца, проводится на сосуды шеи и в межлопаточное пространство. Точку максимального звучания систолического шума описывают как второе—третье меж-реберье слева от грудины, но иногда спереди шум бывает плохо выражен, и тогда приходится ориен- тироваться на шум в межлопаточном пространстве и по ходу внутренних грудных артерий. В отдельных случаях вследствие длительной артериальной гипертензии выслушивается акцент 2-го тона над аортой, систолодиастолический шум при сопутствующем открытом артериальном протоке. У 10—30 % больных выслушивается диастоличе-ский шум недостаточности клапана аорты, что часто может быть связано с наличием двустворчатого аортального клапана. Сопутствующие пороки митрального клапана могут сопровождаться усилением систолического шума на верхушке сердца, а при ДМЖП грубый систолический шум может иметь эпицентр в третьем—четвертом межреберье слева от грудины. Определение пульсации бедренных артерий имеет чрезвычайно важное значение, так как при отсутствии других характерных признаков КА этот симптом может быть основным в установлении характера патологии. Ослабление или отсутствие пульса на бедренных артериях позволяет заподозрить КА, а при умеренном сужении аорты и сопутствующей аортальной недостаточности пальпатор-но можно определить симптом «обратной пульсовой волны». Однако у взрослых пациентов необходимо исключить атеросклеротическую окклюзию брюшной аорты или бедренных артерий, что также сопровождается исчезновением пульсации. Наличие патологического градиента АД между верхними и нижними конечностями считается основным объективным признаком КА. В норме АД на ногах на 10—20 мм рт.ст. выше, чем на руках, поэтому снижение АД на ногах на 20 мм рт.ст. и более по сравнению с руками позволяет заподозрить КА. И.М.Орлова, изучив нервную систему у больных с КА, у 87 % выявила функциональные или органические изменения. Симптомы орга-
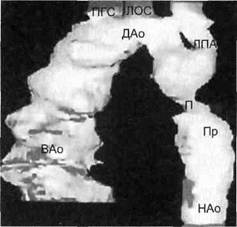
Рис. 5.42. Компьютерная томограмма. Коарктация аорты мембранозного типа. нического поражения головного мозга зафиксированы ею у 42 % пациентов. В основном это были признаки микроочагового поражения головного мозга, проявляющиеся полушарными и стволовыми синд-
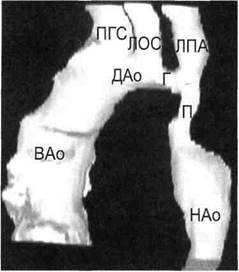
Рис. 5.43. Компьютерная томограмма. Коарктация аорты пролонгированного типа. ромами. Поражения спинного мозга обнаружены у 19 % больных, при этом у 13 % симптомы органических нарушений функции спинного мозга были обусловлены обеднением спинального кровоснабжения ниже места коарктации. У 43 % больных с КА зарегистрированы симптомы вегетативно-сосудистой дисфункции с преобладанием тонуса симпатической нервной системы. Некоторые авторы указывают на появление церебральных симптомов на втором десятилетии жизни больных с КА и на их нарастание с возрастом. Так, очаговые симптомы поражения головного мозга отмечены у 12 % пациентов в возрасте до 20 лет и у 28 % — старше 20 лет. Число больных с церебральными сосудистыми кризами возрастает с 5 до 24 %. Основными методами объективной инструментальной диагностики являются рентгенография грудной клетки обязательно в трех проекциях с контрастированным барием пищеводом; электрокардиография (ЭКГ); ультразвуковая допплеро-графия (УЗДГ); ультразвуковое дуплексное сканирование, ЭхоКГ, причем последняя в силу своей чувствительности и специфичности играет все большую роль для выявления сопутствующих пороков сердца и сосудов; аортография и ангиокардиография (в отдельных случаях по показаниям) при тяжелых сочетан-ных заболеваниях, а также при неясной клинической картине и в целях дифференциальной диагностики. В последнее время все большее значение приобретают магнитно-резонансная и компьютерная томо-ангиография в силу своей высокой информативности и неинвазивно-сти, однако широкое применение данной методики пока ограничено высокой стоимостью исследования (рис. 5.42; 5.43). К классическим рентгенологическим признакам КА, таким как сглаженность «клюва» аорты, уве- личение левого желудочка, выбухание сосудистого пучка справа за счет расширения восходящей части аорты, отклонение контрастирован-ного пищевода в области постсте-нотического расширения по правому контуру (симптом «обратной тройки») и узурация ребер у больных старшей возрастной группы, возможно присоединение рентгенологических признаков клапанных пороков сердца. К ним относят увеличение правых и левых отделов сердца, своеобразную форму сердца, усиление легочного рисунка при патологии митрального клапана с признаками венозного застоя в легких, расширении тени восходящей и нисходящей грудной аорты при аневризматическом расширении последних, появление дополнительной тени в области дуги аорты при наличии Luzoria. И тем не менее большинство исследователей указывают, что перечисленные рентгенологические признаки непостоянны, нестабильны и не всегда соответствуют истинной интра-операционной картине заболевания. На ЭКГ признаки гипертрофии левого желудочка сердца (в 55— 80 % случаев), блокада одной из ножек предсердно-желудочкового пучка (в 37—55 %), гипертрофия правого желудочка у больных с сопутствующими ВПС и легочной ги-пертензией. У пациентов старшей возрастной группы с явлениями сердечной декомпенсации часто обнаруживают признаки относительной коронарной недостаточности, рубцовые изменения в зоне перенесенных инфарктов миокарда и нарушения конечной части желудочкового комплекса. Эхокардиография в настоящее время — один из важнейших методов исследования в диагностике КА и сопутствующих пороков, а также заболеваний сердечно-сосудистой системы. При двухмерном изображении нормальная аорта выглядит на экране как дугообразное образование без каких-либо сужений с симметричной пульсацией по всей длине. Коарктация аорты дает сужение просвета с активной пульсацией выше этого места. Обычно удается выявить и крупные сосуды, отходящие от дуги аорты. Для сканирования аорты используют супрастернальную позицию, датчик направляют кзади, вниз и влево параллельно длинной оси аорты. Типичная ориентация датчика — под углом 45° по двум плоскостям. Возможна также установка датчика в правой или левой парастернальной позиции. Косвенными признаками, подтверждающими коарктацию, могут быть постстенотическое расширение аорты и гипертрофия миокарда левого желудочка. Точность диагностики увеличивается с помощью непрерывной допплерографии и цветового картирования потоков крови, при этом регистрируют турбулентный кровоток в месте сужения аорты и сниженный кровоток дистальнее места сужения. На величину кровотока влияют многие факторы, а именно площадь сечения аорты, длина суженного сегмента, наличие коллатералей или большого ОАП, величина сердечного выброса. На этом основано определение градиента давления непосредственно в области коарк-тации с помощью непрерывной допплерографии. Диагностика сопутствующих пороков развития сердечно-сосудистой системы базируется на прямой визуализации последних с помощью неинвазивных и инвазивных методов исследования. Для подтверждения диагноза допплерогра-фией определяют наличие сброса в соответствующую камеру сердца, перепад давления или степень ре-гургитации на клапанах сердца. Обычно определить величину и локализацию ДМПП, ДМЖП, ОАП, двустворчатый клапан аорты, мит-
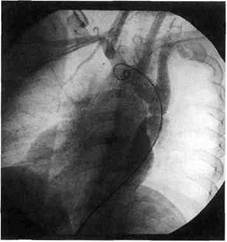
Рис. 5.44. Ангиограмма. Коарктация аорты в типичном месте. ральную недостаточность не представляет трудностей. Для диагностики наиболее сложны такие сочетания, как добавочная верхняя полая вена, аномалии отхождения ветвей дуги аорты, гипоплазия дуги аорты. До недавнего времени считалось невозможным оперировать больного с КА без данных аортографии. Однако совершенствование методов неинвазивной диагностики способствовало тому, что в последнее время контрастное исследование аорты и артерий при КА в сочетании с другими заболеваниями сердца и сосудов применяют лишь в сомнительных случаях. Используют либо трансартериальную аорто-графию по Селдингеру с обязательным измерением градиента АД в месте максимального сужения аорты (при сохранении пульсации бедренных артерий), либо трансвенозную дигитальную субтракционную ангиографию (при полной КА). По мнению ряда авторов, аортография обязательна при аневризмах и каль-цинозе аорты, гипоплазии дисталь-ного отдела дуги аорты, аномалиях развития и отхождения подключич- ных артерий, а также с целью дифференциального диагноза при подозрении на сегментарную врожденную гипоплазию нисходящей грудной аорты. Даже при достаточно точных данных ультразвуковой допплеро-графии при любой аортографии необходимо измерять АД выше и ниже места сужения с определением уровня патологического градиента. В последнее время многие авторы рекомендуют все же проводить ангиографию в каждом случае КА для определения показаний к возможной транслюминальной баллонной ангиопластике (рис. 5.44). Катетеризация полостей сердца, по мнению ряда исследователей, необходима в отдельных случаях при сложных врожденных пороках сердца и сосудов, для уточнения степени легочной гипертензии при больших межпредсердных и межжелудочковых дефектах. Некоторые авторы советуют выполнять ангиографию всем пациентам с КА старшей возрастной группы, а после 30—35 лет дополнять аортографию коронарографией с левой вентрику-лографией при наличии симптомов ишемической болезни сердца или коронарита. Хирургическое лечение КА и сопутствующих заболеваний сердца и сосудов. Диагноз коарктации аорты является показанием к операции. Оптимальным возрастом выполнения оперативного вмешательства считается 5—15 лет, т.е. до развития осложнений сердечно-сосудистой системы. История хирургического лечения КА насчитывает немногим более 50 лет. В 1944 г. в Швеции была проведена первая в мире операция по поводу КА 12-летнему мальчику (Crafoord), операция заключалась в резекции аорты и восстановлении ее проходимости с помощью анастомоза конец в конец, а первое замещение дефекта аорты после резекции КА транспланта- том из консервированной гомоаор-ты было осуществлено в 1951 г. (Gross). Первым в СССР операцию по поводу КА выполнил Е.Н.Ме-шалкин в 1955 г. За 50 с небольшим лет накоплен громадный клинический материал, изданы многочисленные научные исследования по тактике и результатам хирургического лечения КА. В связи с этим, не касаясь исторических и тактических аспектов этого раздела, мы хотим остановиться лишь на отдельных вопросах техники оперативного вмешательства. Тем более, что за последние годы она претерпела некоторые изменения. В результате многочисленных поисков было разработано 4 вида операций при КА: • резекция с наложением анастомоза конец в конец; • резекция с протезированием; • прямая и непрямая истмопла-стика; • шунтирующие операции. На сегодняшний день общепризнано, что истмопластика аорты (либо прямая, либо за счет левой подключичной артерии) наиболее широко показана детям первого года жизни и в раннем возрасте. Что же касается больных старшей возрастной группы с КА, то некоторые исследователи не рекомендуют истмопластику, считая ее возможной лишь у крайне небольшого числа пациентов. Основные методы хирургической коррекции КА у больных старше 5 лет — резекция с анастомозом конец в конец и резекция с протезированием. Шунтирующие операции, и как особая их разновидность — аорто-аортальное шунтирование от восходящей в нисходящую аорту из правосторонней тора-котомии — применяют крайне редко и лишь при наличии особых показаний. Как раньше, так и теперь большинство авторов едины во мнении,
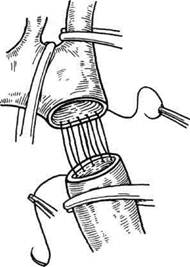
Рис. 5.45. Резекция коарктации аорты с анастомозом конец в конец. что наиболее физиологичной операцией является резекция КА с анастомозом конец в конец (рис. 5.45), так как патологический сегмент удаляют, а непрерывность аорты восстанавливается за счет собственной стенки. А.В.Покровский и ряд других исследователей считают возможным рост анастомоза в последующем. Одно из основных правил наложения анастомоза конец в конец — создание максимально широкого соустья (у взрослых не менее 15 мм или 2/3диаметра дуги аорты). При этом техника сшивания передней и задней стенок аорты также меняется в соответствии с возрастом — от отдельных узловых швов по всему периметру до комбинированного П-образного и обвивного. Широкому применению резекции КА с протезированием предшествовало определение основных показаний к ней. При этом опять-таки учитывали основные требования, предъявляемые к хирургической коррекции КА: для достижения хороших ближайших и отда- ленных результатов анастомозы должны быть широкими и накладываться, по мнению А.В.Покровского, без натяжения. Gross и со-авт. считают, что использование эксплантатов необходимо при: • пролонгированном сужении пре- или постстенотического отделов аорты; • узком диаметре верхнего сегмента аорты; • наличии сопутствующей аневризмы аорты; • технических осложнениях во время операции. Для создания адекватного широкого проксимального анастомоза протеза с аортой некоторые авторы предлагали рассекать стенки пре-стенотического отдела аорты с переходом на начальный отдел левой подключичной артерии. В последующем этот прием стали использовать и при наложении анастомоза конец в конец. Хирургическое лечение КА у больных старшей возрастной группы имеет свои особенности, так как оно обусловлено потенциально высоким риском развития осложнений в связи с дегенеративными изменениями стенок аорты и ее ветвей, недостаточностью коронарного кровообращения, исходной сердечной недостаточностью, наличием сопутствующих заболеваний (аневризмы аорты, врожденные и приобретенные пороки сердца). Помимо чисто технических трудностей оперативного вмешательства, у данных больных существуют и патофизиологические проблемы, связанные со снижением у них АД после коррекции КА и ухудшением в связи с этим кровообращения головного мозга и сердца. О значительных технических трудностях и более высокой летальности (5— 44,4 %) у больных с КА старше 30 лет сообщали многие авторы. Основными причинами смерти у оперированных больных старшей возрастной группы в отдаленном периоде были названы инфаркт миокарда, аортальные пороки и связанная с ними сердечная недостаточность, митральные пороки, кровоизлияние в головной мозг, разрыв аневризмы аорты, внезапная смерть. У больных с КА в сочетании с другими врожденными и приобретенными заболеваниями сердца и сосудов, а также при КА у пациентов старшей возрастной группы основными методами хирургической коррекции также остаются все перечисленные выше. Следует реже использовать непрямую истмопластику, так как исследования Ala-Kulju и соавт. доказали высокую частоту образования ложных аневризм на месте коррекции (27 %), особенно у взрослых больных в сроки от 3 до 13 лет после операции. А.Б.Зорин и Н.Г.Алешкин обнаружили аневриз-мообразование в отдаленные сроки после непрямой истмопластики в 30 % случаев. По-видимому, и этим можно объяснить тот факт, что большинство хирургов, даже при КА у пациентов старшей возрастной группы, предпочитают анастомоз конец в конец, наблюдая наилучшие отдаленные результаты именно после этой процедуры, и выполняют его в 45—96,9 % случаев. Другие авторы оптимальным методом коррекции КА у взрослых больных считают резекцию с протезированием, объясняя это возможностью избежать прорезывания швов и кровотечения из-за дегенеративных изменений в стенках аорты, хотя Б.А.Константинов и соавт. выявили, что ложные аневризмы аорты после протезирования возникают в 3 раза чаще (в 13,5 % случаев), чем после анастомоза конец в конец. На сегодняшний день не решен однозначно вопрос о тактике хирургического лечения сочетания КА с другими заболеваниями сердца и сосудов. В связи с этим возникают 2 вопроса: • следует ли обязательно корригировать оба значимых порока? • если да, то с какого следует начинать или же проводить одновременную коррекцию? Тактики двух-этапного хирургического вмешательства придерживаются многие хирурги, но в этом случае возникает проблема выбора последовательности этапов. Некоторые авторы, наблюдавшие летальные исходы после резекции КА при выраженной аортальной недостаточности вследствие острой левожелудочковой недостаточности, опровергают мнение, что даже выраженная аортальная недостаточность при КА не требует немедленной хирургической коррекции и первым этапом при подобном сочетании всегда необходима коррекция КА. Учитывая возможность ухудшения коронарной перфузии из-за снижения АД после коррекции КА, ряд авторов советуют первым этапом устранять гемодинамически значимый аортальный стеноз или аортальную недостаточность, а затем проводить коррекцию КА. При сочетании КА с пороками митрального и аортального клапанов некоторые хирурги считают показанной одномоментную коррекцию обоих пороков через срединную стернотомию в условиях искусственного кровообращения, устраняя КА аорто-аортальным шунтированием от восходящей к нисходящей аорте с помощью синтетического эксплантата. Наибольшие технические трудности возникают при сочетании КА с аневризмами аорты и ее ветвей. Аневризмы аорты и межреберные, а также другие артерии, расположенные вблизи коарктации, рекомендуется удалять одновременно при устранении КА. В описанных в литературе случаях сочетания КА с аневризмой восходящей аорты авторы рекомендуют двухэтапное лечение: первоначально коррекция КА для уменьшения постнагрузки на миокард, в последующем — ликвидация аневризмы восходящей аорты через срединную стернотомию в условиях ИК. Одной из интереснейших проблем хирургического лечения КА является проблема сочетания коарктации с гемодинамически значимым поражением коронарных артерий у больных старшей возрастной группы. В мировой литературе имеются лишь единичные описания успешного лечения подобных больных. Сначала Goebel и соавт. сообщили о первоэтапной баллонной ангиопластике стеноза передней межжелудочковой ветви (ПМЖВ) с последующей коррекцией КА (через 8 мес после ТЛБАП) у пациента в возрасте 42 лет. В 1983 г. Gontijo Filho и соавт. описали случай одномоментной коррекции КА и реваскуляри-зации миокарда при выраженном атеросклеротическом поражении коронарных артерий у больного в возрасте 62 лет: через срединную стернотомию было выполнено аор-токоронарное шунтирование и аор-то-аортальное шунтирование между восходящей и нисходящей аортой на уровне диафрагмы синтетическим эксплантатом. Первая в нашей стране такого же типа операция с хорошим результатом была выполнена в ИССХ им.А.Н.Бакулева профессором А.А.Спиридоновым в 1987 г. у больного в возрасте 42 лет. Тем не менее эта операция не получила широкого распространения, так как сами ее авторы и исполнители указывали на необходимость определения строгих показаний к одномоментной реваскуля-ризации миокарда и коррекции КА в каждом индивидуальном случае в зависимости от гемодинамиче-ской значимости одного из заболеваний. У отдельных новорожденных с предуктальной коарктацией аорты кровоток в нисходящую аорту осу- ществляется из легочной артерии через открытый артериальный проток (ОАП) и в случае закрытия последнего может наступить катастрофическое ухудшение состояния. В настоящее время существуют препараты, позволяющие искусственно поддерживать проходимость протока. Это так называемые тканевые гормоны — простагландины группы Е. Оказывая избирательное действие на стенку ОАП в дозе 0,025—0,1 мкг (кг/мин), они расширяют проток и усиливают через него кровоток. Одновременно снижается общелегочное и общепериферическое сопротивление, что также благотворно для больных с КА. Введение препарата возможно непосредственно в аорту, легочную артерию или периферическую вену. В последние годы созданы и пероральные средства на основе ПГЕ. В процессе лечения необходимо тщательно контролировать состояние больных, так как возможно побочное действие лекарства в виде тахикардии, гиперемии кожных покровов, жидкого стула. Наиболее грозное осложнение — апноэ. Однако при отмене препарата эти явления быстро исчезают. Лечение с помощью ПГЕ возможно, как правило, не позже 3 нед после рождения ребенка, так как затем ОАП полностью закрывается и не поддается воздействию препарата. Лечебный эффект может отсутствовать, если ОАП исходно большего размера и расслабление его стенки не дает дальнейшего увеличения просвета и кровотока. В то же время, если введение ПГЕ начато у больного с закрывающимся ОАП, эффект может быть весьма впечатляющим: быстро исчезает метаболический ацидоз, возрастают РО2 и наполнение капилляров дистальнее коарктации, начинается активное мочеотделение. Значительно снижается градиент давления между проксималь- ным и дистальным участками аорты, что можно объяснить релаксацией дуктальной ткани, имеющейся в стенке аорты. В связи с тем что уменьшается постнагрузка на левый желудочек, конечно-диасто-лическое давление в его полости также нормализуется. Все это способствует улучшению состояния больных и возможности выполнить операцию в более благоприятных условиях. Широкое использование ПГЕ у новорожденных с КА улучшило показатели выживаемости в этой возрастной группе. Если раньше погибал каждый третий ребенок, то в настоящее время лишь в единичных случаях не удается выполнить операцию из-за тяжести состояния таких больных. За последние несколько лет альтернативой хирургическому лечению КА стала считаться транслю-минальная баллонная ангиопластика. С тех пор как работами Lock, Castaneda-Zuniga и соавт. в эксперименте и на резецированных хирургически коарктациях была доказана возможность их дилатации баллоном, эта методика стала завоевывать все больше и больше сторонников по всему миру. На сегодняшний день уже накоплен достаточно большой клинический материал применения ТЛБАП при КА (рис. 5.46). Установлено, что эта методика высокоэффективна у новорожденных, особенно при тяжелых сопутствующих заболеваниях и угрожающих жизни состояниях. При этом авторы указывают, что ТЛБАП помогает либо совсем избежать хирургического вмешательства, либо отложить его до достижения ребенком более старшего возраста. Преимущества данной процедуры заключаются в отсутствии тора-котомии и общей анестезии, меньших сроках госпитализации больного. Однако техническая сторона вмешательства достаточно сложна. Для адекватного расширения аорты необходимо использовать баллон в 2,5—3 раза шире, чем суженное место. Фиксированное расширение достигается только при повреждении интимы и среднего слоя стенки аорты. Это может повлечь за собой тромбоз аорты, а в отдаленные сроки — развитие ее аневризмы. Кроме того, часты случаи рекоарктации уже через несколько недель после вмешательства, а операция осложняется наличием размозженных тканей в стенке аорты. В связи с этим ТЛБАП показана лишь при тяжелом общем состоянии больного и при наличии определенной анатомии коарктации, например при так называемом мембранозном типе КА. В отношении детей старше 5 лет мнения исследователей совершенно различны. Одни рекомендуют эту процедуру во всех случаях, другие — только в отдельных медицинских центрах, обладающих большим клиническим опытом и длительным периодом наблюдения; кроме того, при наличии строго определенных анатомических и патофизиологических показаний. И наконец, ряд авторов категорически отрицают возможность применения ТЛБАП при КА, ссылаясь на большую частоту рекоарктации даже при стентировании и возможность формирования аневризм в зоне вмешательства. В исследовании, посвященном данной проблеме, доктор P.Syam-sasundar Rao считает, что все эти мнения имеют право на существование, хотя сам является сторонником очень широкого применения баллонной пластики при КА у детей независимо от возраста и анатомии порока. В любом случае всеми авторами признается необходимость дальнейшего накопления клинического опыта и проведения дополнительных исследований для окончательного решения
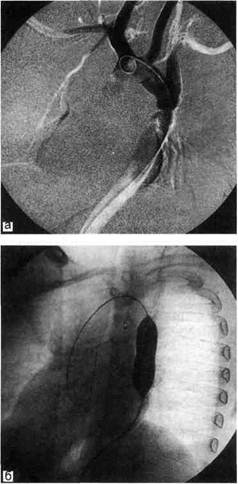
Рис. 5.46. ТЛБАП зоны коарктации аорты. а, б — этапы вмешательства вопроса о возможности ТЛБАП при КА. Отдаленные результаты хирургического лечения коарктации аорты хорошие. Отдаленная выживаемость оперированных больных составляет 90,3—95 %. Частота рекоарктации после операций у пациентов, оперированных в возрасте 5 лет и старше, не превышает 1 — 3 %. Все это свидетельствует о высокой эффективности оперативного лечения КА. Дата добавления: 2015-02-06 | Просмотры: 1526 | Нарушение авторских прав |

 Коарктация аорты — это врожденное сегментарное сужение аорты, располагающееся в области ее перешейка. Некоторые авторы называют этот порок «сужением перешейка аорты», однако этот термин в клинической практике не получил широкого распространения.
Коарктация аорты — это врожденное сегментарное сужение аорты, располагающееся в области ее перешейка. Некоторые авторы называют этот порок «сужением перешейка аорты», однако этот термин в клинической практике не получил широкого распространения.